Вода: различия между версиями
| [отпатрулированная версия] | [отпатрулированная версия] |
Нет описания правки |
QBA-bot (обсуждение | вклад) м Защитил страницу Вода: повторяющиеся неконсенсусные правки ([Редактирование=только автоподтверждённые] (истекает 09:30, 20 декабря 2024 (UTC)) [Переименование=только автоподтверждённые] (истекает 09:30, 20 декабря 2024 (UTC))) |
||
| (не показано 639 промежуточных версий, сделанных более чем 100 участниками) | |||
| Строка 1: | Строка 1: | ||
{{перенаправление|H2O |
{{перенаправление|H2O}} |
||
{{Значения|Вода (значения)}} |
|||
{{Вещество |
|||
|картинка = [[Файл:Splash 2 color.jpg|200px]] |
|||
|картинка3D = Water3d3.png |
|||
|картинка малая = [[Файл:Water molecule dimensions.svg|200px]] |
|||
|хим. имя = Оксид водорода <br> Вода<ref>{{lang-en|International Union of Pure and Applied Chemistry. Nomenclature of Inorganic Chemistry. IUPAC RECOMMENDATIONS 2005. RSC Publishing, 2005. — p. 306.}}</ref> |
|||
|хим. формула = H{{sub|2}}O |
|||
|молярная масса = 18,01528 |
|||
|традиционные названия = вода |
|||
|темп. плавления = 273,1 K (0 ° C) |
|||
|темп. кипения = 373,1 K (99,974 ° C) |
|||
|тройная точка = 273,2 K (0,01 ° C), 611,72 Па |
|||
|критическая точка = 647,1 K (374 ° C), 22,064 МПа |
|||
|плотность = 0,9982 |
|||
|скорость звука = (дистиллированная вода) 1348 |
|||
|CAS = |
|||
|SMILES = |
|||
|состояние = жидкость |
|||
|теплоёмкость = 75,37 |
|||
|теплопроводность = 0,56 |
|||
|удельная теплота плавления = 332,4 кДж/кг<ref name="FE">{{статья|заглавие=Вода|ссылка=http://www.femto.com.ua/articles/part_1/0532.html|автор=Маленков Г. Г.|издание=[[Физическая энциклопедия]]|место=М.|издательство=[[Советская энциклопедия]]|год=1988|том=I. Ааронова — Бома эффект — Длинные линии|страницы=294—297}}</ref> |
|||
|удельная теплота парообразования = 2256,2 кДж/кг<ref name="FE"/> |
|||
|динамическая вязкость = 0,00101 |
|||
|кинематическая вязкость = 0,01012 |
|||
|токсичность = {{NFPA 704 |
|||
|опасность для здоровья = 0 |
|||
|огнеопасность = 0 |
|||
|реакционоспособность = 0 |
|||
|прочее = 0 |
|||
}} }} |
|||
[[Файл:The Earth seen from Apollo 17.jpg|thumb|71 % поверхности Земли покрывает вода]] |
|||
'''Вода́''' ([[Оксиды|оксид]] [[водород]]а) — [[Бинарные соединения|бинарное]] [[Неорганическое вещество|неорганическое соединение]] с [[химическая формула|химической формулой]] [[Водород|Н]]<sub>2</sub>[[Кислород|O]]. [[Молекула]] воды состоит из двух атомов [[водород]]а и одного — [[кислород]]а, которые соединены между собой [[Ковалентная связь|ковалентной связью]]. При [[Стандартные условия|нормальных условиях]] представляет собой прозрачную [[жидкость]], не имеющую [[цвет]]а (при малой толщине слоя), [[запах]]а и [[вкус]]а. В [[твёрдое тело|твёрдом]] [[Агрегатное состояние|состоянии]] называется [[лёд|льдом]] (кристаллы льда могут образовывать [[снег]] или [[иней]]), а в [[газ]]ообразном — водяным [[пар]]ом. Вода также может существовать в виде [[Жидкие кристаллы|жидких кристаллов]] (на [[Гидрофильность|гидрофильных]] поверхностях)<ref>{{Cite journal|last=Henniker|first=J. C.|title=The Depth of the Surface Zone of a Liquid|year=1949|publisher=Reviews of Modern Physics|doi=10.1103/RevModPhys.21.322|journal=Reviews of Modern Physics|volume=21|issue=2|pages=322–341}}</ref><ref>{{cite web|url=http://faculty.washington.edu/ghp/researcthemes/water-science|title=Water Science|author=Pollack, Gerald|publisher=University of Washington, Pollack Laboratory|accessdate=2011-02-05|quote=Water has three phases – gas, liquid, and solid; but recent findings from our laboratory imply the presence of a surprisingly extensive fourth phase that occurs at interfaces.|archiveurl=https://www.webcitation.org/6ERWeNR9m?url=http://faculty.washington.edu/ghp/researcthemes/water-science|archivedate=2013-02-15}}</ref>. Составляет приблизительно около 0,05 % массы Земли<ref>[http://space-era.com/solar14-01.htm Моря принесены на Землю из космоса?]</ref>. |
|||
{{Значения}} |
|||
Около 71 % поверхности [[Земля|Земли]] покрыто водой ([[океан]]ы, [[море|моря]], [[озеро|озёра]], [[река|реки]], льды) — 361,13 млн км<sup>2</sup><ref>{{cite web|url=https://www.cia.gov/library/publications/the-world-factbook/geos/xx.html#Geo|title=CIA- The world fact book|publisher=[[Центральное разведывательное управление|Central Intelligence Agency]]|accessdate=2008-12-20}}</ref><ref name="Mari">Marine Science: An Illustrated Guide to Science</ref>. На Земле примерно 96,5 % воды приходится на океаны, 1,7 % мировых запасов составляют грунтовые воды, ещё 1,7 % — ледники и ледяные шапки [[Антарктида|Антарктиды]] и [[Гренландия|Гренландии]], небольшая часть находится в реках, озёрах и [[Болото|болотах]], и 0,001 % в облаках (образуются из взвешенных в воздухе частиц льда и жидкой воды)<ref name=b1>{{Книга|заглавие=Water in Crisis: A Guide to the World's Freshwater Resources|автор=Gleick, P.H.|издательство=[[Oxford University Press]]|год=1993|page=13, Table 2.1 "Water reserves on the earth"|ссылка=http://www.yemenwater.org/wp-content/uploads/2013/03/Gleick-Peter.-1993.-Water-in-crisis.pdf}}</ref><ref>{{cite web|url=http://www.eso.org/gen-fac/pubs/astclim/espas/pwv/mockler.html|title=Water Vapor in the Climate System|publisher=[[American Geophysical Union]]|lang=en|accessdate=2013-02-13|archiveurl=https://www.webcitation.org/6ERWeyWkC?url=http://www.eso.org/gen-fac/pubs/astclim/espas/pwv/mockler.html|archivedate=2013-02-15}}</ref>. Бо́льшая часть земной воды — солёная, непригодная для [[Сельское хозяйство|сельского хозяйства]] и питья. Доля [[Пресная вода|пресной]] составляет около 2,5 %, причём 98,8 % этой воды находится в ледниках и [[Грунтовая вода|грунтовых водах]]. Менее 0,3 % всей пресной воды содержится в реках, озёрах и [[Атмосфера|атмосфере]], и ещё меньшее количество (0,003 %) находится в живых организмах<ref name=b1/>. |
|||
{{Вещество |
|||
Является хорошим [[Ковалентная связь|сильнополярным]] [[растворитель|растворителем]]. В природных условиях всегда содержит растворённые вещества ([[соли]], [[газ]]ы). |
|||
| картинка = Water molecule dimensions.svg |
|||
| картинка3D = Water3d3.png |
|||
| изображение = |
|||
{{Фотомонтаж |
|||
| photo1a = Parque Nacional de Brasília (14543997474).jpg{{!}}Вода в бассейне |
|||
| photo2a = The Earth seen from Apollo 17.jpg{{!}}71 % поверхности Земли [[Водный объект|покрывает вода]] |
|||
| position = center |
|||
| color = white |
|||
| color_border = white |
|||
}} |
|||
| хим. имя = Оксид водорода <br> Вода<ref>{{lang-en|International Union of Pure and Applied Chemistry. Nomenclature of Inorganic Chemistry. IUPAC RECOMMENDATIONS 2005. RSC Publishing, 2005. — p. 306.}}</ref> |
|||
| хим. формула = H{{sub|2}}O |
|||
| молярная масса = 18,01528 |
|||
| традиционные названия = вода |
|||
| темп. плавления = 273,1 K (0 ° C) |
|||
| темп. кипения = 373,1 K; 99,974 |
|||
| темп. разложения = при 2200 °C разлагаются 3% молекул |
|||
| энтальпия образования = −285,83 |
|||
| тройная точка = 273,2 K (0,01 ° C), 611,72 Па |
|||
| критическая точка = 647,1 K (374 ° C), 22,064 МПа |
|||
| плотность = 1 г/см<sup>3</sup><ref>''Riddick, John'' (1970). Organic Solvents Physical Properties and Methods of Purification. Techniques of Chemistry. Wiley-Interscience. ISBN 0471927260.</ref> |
|||
| скорость звука = (дистиллированная<br>вода) 1348 |
|||
| состояние = жидкость |
|||
| теплоёмкость = 75,37 |
|||
| теплопроводность = 0,56 |
|||
| удельная теплота плавления = 332,4 кДж/кг<ref name="FE">{{статья|заглавие=Вода|ссылка=http://www.femto.com.ua/articles/part_1/0532.html|автор=Маленков Г. Г.|издание=[[Физическая энциклопедия]]|место=М.|издательство=[[Советская энциклопедия]]|год=1988|том=I. Ааронова — Бома эффект — Длинные линии|страницы=294—297|archivedate=2016-08-18|archiveurl=https://web.archive.org/web/20160818113302/http://www.femto.com.ua/articles/part_1/0532.html}}</ref> |
|||
| удельная теплота парообразования = 2256,2 кДж/кг<ref name="FE"/> |
|||
| динамическая вязкость = 0,00101 |
|||
| кинематическая вязкость = 0,01012 |
|||
| NFPA 704 = |
|||
{{NFPA 704 |
|||
| опасность для здоровья = 0 |
|||
| огнеопасность = 0 |
|||
| реакционноспособность = 0 |
|||
| прочее = - |
|||
}} |
|||
| конст. диссоц. кислоты = 15,74 |
|||
| от. диэлектр. прониц. = 80,4 (20 ° C)<br>78,5 (25 ° C) |
|||
}} |
|||
'''Вода́''' (в [[Химия|химии]] — ''[[Оксиды|монооксид]]'' ''[[водород]]а'', ''[[гидроксид]] водорода''; [[химическая формула]] — '''H<sub>2</sub>O''') — [[Вещество (химия)|химическое вещество]], представляющее собой [[Бинарное соединение|бинарное]] [[Неорганические вещества|неорганическое соединение]], [[молекула]] которого состоит из двух [[атом]]ов водорода и одного атома [[кислород]]а, соединённых между собой [[Ковалентная связь|ковалентной связью]]. Вода является продуктом [[Горение|горения]] ([[Окисление|окисления]]) водорода при реакции с кислородом, но также может выступать конечным результатом и иных химических реакций, таких как горение [[Углеводороды|углеводородов]] и других [[Органические вещества|органических соединений]]. |
|||
Исключительно важна роль воды в возникновении и поддержании [[Жизнь|жизни]] на Земле, в химическом строении живых организмов, в формировании [[климат]]а и [[погода|погоды]]. Вода является важнейшим веществом для всех живых существ на [[Земля|Земле]]<ref>{{cite web|url=http://www.un.org/waterforlifedecade/background.html|title=[[United Nations]]|publisher=Un.org|date=2005-03-22|accessdate=2010-07-25|archiveurl=https://www.webcitation.org/6ERWfnGax?url=http://www.un.org/waterforlifedecade/background.shtml|archivedate=2013-02-15}}</ref>. |
|||
При [[Стандартные условия|нормальных условиях]] вода представляет собой прозрачную [[жидкость]], не имеющую [[цвет]]а (при малой толщине слоя), [[запах]]а и [[вкус]]а. При переходе в [[твёрдое тело|твёрдое]] [[агрегатное состояние]] вода преобразуется в [[лёд]] ([[кристаллы]] льда могут образовывать [[снег]] или [[иней]]), а в [[газ]]ообразное — в [[водяной пар]]. Вода также может существовать в виде [[Жидкие кристаллы|жидких кристаллов]] (на [[Гидрофильность|гидрофильных]] поверхностях)<ref>{{статья |заглавие=The Depth of the Surface Zone of a Liquid |издательство=Reviews of Modern Physics |doi=10.1103/RevModPhys.21.322 |издание=[[Reviews of Modern Physics]] |том=21 |номер=2 |страницы=322—341 |язык=en |автор=Henniker, J. C. |год=1949 |тип=journal|issn = 0034-6861}}</ref><ref>{{cite web|url=http://faculty.washington.edu/ghp/researcthemes/water-science|title=Water Science|author=Pollack, Gerald|publisher=University of Washington, Pollack Laboratory|accessdate=2011-02-05|quote=Water has three phases – gas, liquid, and solid; but recent findings from our laboratory imply the presence of a surprisingly extensive fourth phase that occurs at interfaces.|archiveurl=https://www.webcitation.org/6ERWeNR9m?url=http://faculty.washington.edu/ghp/researcthemes/water-science|archivedate=2013-02-15}}</ref>. Она совершенно не токсична и безопасна для здоровья человека по причине [[Стабильность материи|стабильности вещества]] и негорючести воды (невосприимчивость к горению, наподобие [[Диоксид углерода|углекислого газа]]). |
|||
Вода является хорошим [[Полярные вещества|сильнополярным]] [[растворитель|растворителем]]. В природных условиях всегда содержит [[раствор]]ённые [[Вещество|вещества]] ([[соли]], [[газ]]ы). |
|||
Исключительно важна роль воды в глобальном кругообороте вещества и [[Энергия|энергии]]<ref>''[[Криволуцкий, Александр Евгеньевич|Криволуцкий А. Е.]]'' Голубая планета. Земля среди планет. Географический аспект. — М.: Мысль, 1985. — С. 212.</ref>, возникновении и поддержании [[Жизнь|жизни]] на Земле, в химическом строении живых организмов, в формировании [[климат]]а и [[погода|погоды]]. Она является важнейшим веществом для всех живых существ на [[Земля|Земле]]<ref>{{cite web|url=http://www.un.org/waterforlifedecade/background.html|title=[[United Nations]]|publisher=Un.org|date=2005-03-22|accessdate=2010-07-25|archiveurl=https://www.webcitation.org/6ERWfnGax?url=http://www.un.org/waterforlifedecade/background.shtml|archivedate=2013-02-15}}</ref>. В среднем, в [[организм]]е растений и животных содержится более 50 % воды<ref name="НТ.ЗПВ">{{Cite web |url=http://n-t.ru/ri/ar/zv01.htm |title=Наука и техника. Книги. Загадки простой воды. |access-date=2008-08-27 |archive-date=2009-01-22 |archive-url=https://web.archive.org/web/20090122023522/http://n-t.ru/ri/ar/zv01.htm |deadlink=no }}</ref>. |
|||
Всего на Земле около 1400 млн км³ воды; она покрывает 71 % поверхности земного шара ([[океан]]ы, [[море|моря]], [[озеро|озёра]], [[река|реки]], [[Лёд|льды]] — 361,13 млн км²<ref>{{cite web|url=https://www.cia.gov/library/publications/the-world-factbook/geos/xx.html#Geo|title=CIA- The world fact book|publisher=[[Центральное разведывательное управление|Central Intelligence Agency]]|accessdate=2008-12-20|archive-date=2010-01-05|archive-url=https://web.archive.org/web/20100105171656/https://www.cia.gov/library/publications/the-world-factbook/geos/xx.html#Geo|deadlink=yes}}</ref><ref name="Mari">Marine Science: An Illustrated Guide to Science</ref>). Бо́льшая часть земной воды (97,54 %) принадлежит [[Мировой океан|Мировому океану]] — это [[солёная вода]], непригодная для сельского хозяйства и питья. [[Пресная вода|Пресная]] же вода находится в основном в ледниках (1,81 %) и подземных водах (около 0,63 %), и лишь небольшая часть (0,009 %) — в реках и озёрах. Материковые солёные воды составляют 0,007 %, в [[Атмосфера Земли|атмосфере]] содержится 0,001 % от всей воды [[Земля|планеты Земля]]<ref name="b1">{{Книга |заглавие=Water in Crisis: A Guide to the World's Freshwater Resources |автор=Gleick, P.H. |издательство=[[Oxford University Press]] |год=1993 |page=13, Table 2.1 "Water reserves on the earth" |ссылка=http://www.yemenwater.org/wp-content/uploads/2013/03/Gleick-Peter.-1993.-Water-in-crisis.pdf |язык=en |access-date=2016-02-14 |archive-date=2016-03-05 |archive-url=https://web.archive.org/web/20160305205904/http://www.yemenwater.org/wp-content/uploads/2013/03/Gleick-Peter.-1993.-Water-in-crisis.pdf |url-status=dead |archive-date=2016-03-05 |archive-url=https://web.archive.org/web/20160305205904/http://www.yemenwater.org/wp-content/uploads/2013/03/Gleick-Peter.-1993.-Water-in-crisis.pdf }}</ref><ref>{{cite web|url=http://www.eso.org/gen-fac/pubs/astclim/espas/pwv/mockler.html|title=Water Vapor in the Climate System|publisher=[[American Geophysical Union]]|lang=en|accessdate=2013-02-13|archiveurl=https://www.webcitation.org/6ERWeyWkC?url=http://www.eso.org/gen-fac/pubs/astclim/espas/pwv/mockler.html|archivedate=2013-02-15}}</ref>. В составе [[Мантия Земли|мантии]] Земли воды содержится в 10—12 раз больше, чем в Мировом океане<ref>{{Cite web |url=http://www.priroda.ru/lib/detail.php?ID=5546 |title=Состав и природа мантии Земли |access-date=2011-04-06 |archive-date=2011-11-02 |archive-url=https://web.archive.org/web/20111102195520/http://www.priroda.ru/lib/detail.php?ID=5546 |deadlink=no }}</ref>. |
|||
Вода — это одно из немногих веществ в природе, которые расширяются при переходе из жидкой фазы в твёрдую (кроме воды, таким свойством обладают [[сурьма]]<ref name="Slovar2">{{статья|заглавие=Сурьма|год=1990|ответственный=Сост. В. А. Крицман, В. В. Станцо|место={{М}}|издание=[[Энциклопедический словарь (Педагогика)|Энциклопедический словарь]] юного химика. 2-е изд.|издательство=[[Педагогика (издательство)|Педагогика]]|страницы=235|isbn=5-7155-0292-6}}</ref>, [[висмут]], [[галлий]], [[германий]] и некоторые соединения и смеси). |
|||
== Этимология == |
|||
В письменных источниках слово «вода» встречается ещё в «[[Изборник 1076 года|Изборнике Святослава]]» (1076 год)<ref>{{книга|заглавие=Словарь русского языка XI—XVII веков. Вып. 2|год=1975|место=М.|издательство=[[Наука (издательство)|Наука]]|часть=Вода|ответственный=[[Академия наук СССР]], [[Институт русского языка имени В. В. Виноградова РАН|Институт русского языка]]; ред. колл., гл. ред. [[Бархударов, Степан Григорьевич|С. Г. Бархударов]]|страницы=249|ссылка=https://etymolog.ruslang.ru/doc/xi-xvii_2.pdf|тираж=16500|access-date=2024-01-22|archive-date=2023-02-16|archive-url=https://web.archive.org/web/20230216183501/https://etymolog.ruslang.ru/doc/xi-xvii_2.pdf|url-status=live}}</ref>. |
|||
Слово происходит от [[Древнерусский язык|др.-русск.]] ''вода'', далее — от [[праславянский язык|праславянского]] *''[[wikt:*voda|voda]]''<ref>Derksen, Rick. Etymological Dictionary of the Slavic Inherited Lexicon</ref> (ср. ст.-слав. ''вода'', [[Болгарский язык|болг.]] ''вода́'', [[Сербохорватский язык|сербохорв.]] ''во̀да'', [[Словенский язык|словен.]] ''vóda'', [[Чешский язык|чеш.]] ''voda'', [[Словацкий язык|слвц.]] ''voda'', [[Польский язык|польск.]] ''woda'', [[Верхнелужицкий язык|в.-луж.]], [[Нижнелужицкий язык|н.-луж.]] ''woda''), затем — от [[праиндоевропейский язык|праиндоевропейского]] *''wed''-, родственного [[Литовский язык|лит.]] ''vanduõ'', жем. ''unduo'', [[Древневерхненемецкий язык|д.-в.-н.]] ''waʒʒar'' «вода», [[Готский язык|гот.]] ''[[wikt:𐍅𐌰𐍄𐍉|watō]]'', [[Английский язык|англ.]] ''water'', [[Древнегреческий язык|греч.]] ''ὕδωρ'', ''ὕδατος'', [[Армянский язык|арм.]] ''գետ'' «река», [[Фригийский язык|фриг.]] ''βέδυ'', [[Древнеиндийский язык|др.-инд.]] ''udakám'', ''uda''-, ''udán''- «вода», ''unátti'' «бить ключом», «орошать», ''ṓdman''- «поток», [[Албанский язык|алб.]] ''uj'' «вода»<ref>М. Фасмер. Этимологический словарь русского языка. Вода</ref><ref>{{Cite web |url=https://www.etymonline.com/word/water?ref=etymonline_crossreference#etymonline_v_4854 |title=Online Etymology Dictionary. Water |access-date=2019-11-09 |archive-date=2019-07-09 |archive-url=https://web.archive.org/web/20190709113716/https://www.etymonline.com/word/water?ref=etymonline_crossreference#etymonline_v_4854 |deadlink=no }}</ref>. Русские слова «ведро», «[[выдра]]» имеют тот же корень. |
|||
В рамках необщепринятой гипотезы о существовании некогда [[праностратический язык|праностратического языка]] слово может сравниваться с гипотетическим [[Прауральский язык|прауральским]] *''wete'' (ср., например, [[Финский язык|фин.]] ''vesi'', [[Эстонский язык|эст.]] ''vesi'', [[Коми язык|коми]] ''va'', [[Венгерский язык|венг.]] ''víz''), а также с предполагаемыми [[Алтайские языки|праалтайскими]], [[Прадравидский язык|прадравидийским]] и прочими словами, и реконструироваться как *''wetV'' для [[праязык]]а<ref>{{Cite web |url=https://starling.rinet.ru/cgi-bin/response.cgi?single=1&basename=%2fdata%2fnostr%2fnostret&text_number=++58&root=config |title=«Ностратическая этимология» (база данных) |access-date=2020-09-08 |archive-date=2021-01-18 |archive-url=https://web.archive.org/web/20210118071830/https://starling.rinet.ru/cgi-bin/response.cgi?single=1&basename=%2Fdata%2Fnostr%2Fnostret&text_number=++58&root=config |deadlink=no }}</ref>. |
|||
== Химические названия == |
== Химические названия == |
||
<!-- Предполагается дать объяснения корректности каждого названия. |
<!-- Предполагается дать объяснения корректности каждого названия. — = APh =--> |
||
С формальной точки зрения вода имеет несколько различных корректных [[Химия|химических]] названий: |
С формальной точки зрения вода имеет несколько различных корректных [[Химия|химических]] названий: |
||
* [[Оксиды| |
* [[Оксиды|оксид]] водорода: [[бинарное соединение]] водорода с атомом кислорода в степени окисления −2, встречается также устаревшее название «окись водорода»; |
||
* [[Гидроксиды| |
* [[Гидроксиды|гидроксид]] водорода: соединение гидроксильной группы OH{{Sup|−}} и [[катион]]а (H{{Sup|+}}); |
||
* |
* гидроксильная [[кислота]]: воду можно рассматривать как соединение катиона H{{Sup|+}}, который может быть замещён металлом, и «гидроксильного остатка» OH{{Sup|−}}<!-- {{lang-en|hydroxylic acid}} тут с переводом ясно --= APh =-->; |
||
* [[Дигидрогена монооксид| |
* [[Дигидрогена монооксид|монооксид дигидрогена]]; |
||
* дигидромонооксид, |
|||
* Оксидан |
|||
* Дигидромонооксид |
|||
== Образование воды == |
|||
{{план}} |
|||
== Свойства == |
== Свойства == |
||
=== Физические свойства === |
=== Физические свойства === |
||
Вода при [[Стандартные условия|нормальных условиях]] находится в жидком состоянии, тогда как аналогичные водородные соединения других элементов являются |
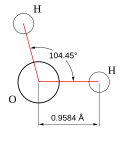
Вода при [[Стандартные условия|нормальных условиях]] находится в жидком состоянии, тогда как аналогичные водородные соединения других элементов являются [[газ]]ами ([[Сероводород|H{{sub|2}}S]], [[Метан|CH{{sub|4}}]], [[Фтороводород|HF]]). [[Атом водорода|Атомы водорода]] присоединены к атому кислорода, образуя угол 104,45° (104°27′). Из-за большой разности [[электроотрицательность|электроотрицательностей]] [[атом]]ов [[водород]]а и [[кислород]]а [[электронное облако|электронные облака]] сильно смещены в сторону кислорода. По этой причине [[Молекула водорода|молекула воды]] обладает большим [[Электрический дипольный момент|дипольным моментом]] (p = 1,84 [[Дебай|Д]], уступает только [[Синильная кислота|синильной кислоте]] и [[диметилсульфоксид]]у). |
||
Каждая молекула воды образует до четырёх [[Водородная связь|водородных связей]] — две из них образует атом кислорода и две — атомы водорода<ref name="гидрогео">{{книга |
Каждая молекула воды образует до четырёх [[Водородная связь|водородных связей]] — две из них образует атом кислорода и две — атомы водорода<ref name="гидрогео">{{книга |
||
|автор = Ларионов А. К. |
|автор = Ларионов А. К. |
||
| Строка 62: | Строка 82: | ||
|издательство = [[Недра (издательство)|Недра]] |
|издательство = [[Недра (издательство)|Недра]] |
||
|год = 1979 |
|год = 1979 |
||
|страницы = |
|страницы = 5—12 |
||
|страниц = 157}}</ref>. |
|страниц = 157 |
||
}}</ref>. |
|||
Количество водородных связей и их разветвлённая структура определяют высокую температуру кипения воды и её удельную теплоту парообразования<ref name="гидрогео" />. Если бы не было водородных связей, вода, на основании места кислорода в таблице Менделеева и температур кипения гидридов аналогичных кислороду элементов ([[сера|серы]], [[селен]]а, [[теллур]]а), кипела бы при −80 |
Количество водородных связей и их разветвлённая структура определяют высокую [[Температура кипения|температуру кипения]] воды и её удельную теплоту парообразования<ref name="гидрогео" />. Если бы не было [[Водородная связь|водородных связей]], вода, на основании места кислорода в [[Периодическая система химических элементов|таблице Менделеева]] и температур кипения гидридов аналогичных кислороду элементов ([[сера|серы]], [[селен]]а, [[теллур]]а), кипела бы при −80 °C, а замерзала при −100 °C<ref name="HiZh0365">{{статья|автор=[[Петрянов-Соколов, Игорь Васильевич|Петрянов И.В.]]|заглавие=Самое необыкновенное вещество|издание=[[Химия и жизнь]]|год=1965|номер=3|страницы=2—14}}</ref>. |
||
При переходе в твёрдое состояние молекулы воды упорядочиваются, при этом объёмы пустот между молекулами увеличиваются, и общая плотность воды падает, что и объясняет меньшую плотность (больший объём) воды в фазе льда. При [[Испарение|испарении]], напротив, все водородные связи рвутся. Разрыв связей требует много энергии, отчего у воды самая большая [[удельная теплоёмкость]] среди прочих жидкостей и твёрдых веществ. Для того чтобы нагреть один килограмм воды на один градус, требуется затратить 4,1868 [[Джоуль|кДж]] энергии. Благодаря этому свойству вода нередко используется как [[теплоноситель]]. |
|||
Помимо большой [[Удельная теплоёмкость|удельной теплоёмкости]], вода также имеет большие значения [[Удельная теплота плавления|удельной теплоты плавления]] (333,55 кДж/кг при 0 °C) и [[Удельная теплота испарения|парообразования]] (2250 кДж/кг). |
|||
При переходе в твёрдое состояние молекулы воды упорядочиваются, при этом объёмы пустот между молекулами увеличиваются, и общая плотность воды падает, что и объясняет меньшую плотность (больший объём) воды в фазе льда. При испарении, напротив, все водородные связи рвутся. Разрыв связей требует много энергии, отчего у воды самая большая [[удельная теплоёмкость]] среди прочих жидкостей и твёрдых веществ. Для того чтобы нагреть один литр воды на один градус, требуется затратить 4,1868 [[Джоуль|кДж]] энергии. Благодаря этому свойству вода нередко используется как [[теплоноситель]]. |
|||
Помимо большой удельной теплоёмкости, вода также имеет большие значения [[Удельная теплота плавления|удельной теплоты плавления]] (333,55 кДж/кг при 0 °C) и [[Удельная теплота испарения|парообразования]] (2250 кДж/кг). |
|||
{| class="wikitable" |
{| class="wikitable" |
||
|- |
|- |
||
! Температура |
! Температура, [[°С]]!! Удельная теплоёмкость воды, кДж/(кг*К) |
||
|- |
|- |
||
| |
| −60 (лёд) || 1,64 |
||
|- |
|- |
||
| |
| −20 (лёд) || 2,01 |
||
|- |
|- |
||
| |
| −10 (лёд) || 2,22 |
||
|- |
|- |
||
| 0 (лёд) || 2,11 |
| 0 (лёд) || 2,11 |
||
| Строка 99: | Строка 122: | ||
{| class="wikitable" |
{| class="wikitable" |
||
|- |
|- |
||
! Модификация воды !! Максимальная плотность при температуре |
! Модификация воды !! Максимальная плотность при температуре, °С !! Тройная точка при температуре, °С |
||
|- |
|- |
||
| Н<sub>2</sub>O || 3,9834 || 0,01 |
| Н<sub>2</sub>O || 3,9834 || 0,01 |
||
| Строка 108: | Строка 131: | ||
|- |
|- |
||
| Н<sub>2</sub><sup>18</sup>O || 4,3 || 0,31 |
| Н<sub>2</sub><sup>18</sup>O || 4,3 || 0,31 |
||
|}<!-- Вода обладает также высоким [[Поверхностное натяжение|поверхностным натяжением]], уступая в этом только ртути<ref name="о воде">[http://www.vodoobmen.ru/13-prop.html Свойства воды. Физические свойства воды]</ref><ref name="МГУП">[http://www.msuee.ru/html2/med_gidr/l3_4.html Основные физические свойства воды, водяного пара, льда, снега] {{Wayback|url=http://www.msuee.ru/html2/med_gidr/l3_4.html |date=20110824040553 }}</ref><ref>{{Cite web |url=http://www.habit.ru/35/188.html |title=Коэффициенты поверхностного натяжения жидкостей |accessdate=2010-06-08 |archiveurl=https://web.archive.org/web/20100929095746/http://habit.ru/35/188.html |archivedate=2010-09-29 |deadlink=yes }}</ref>. Чушь это из неавторитетного источника--> |
|||
|} |
|||
Вода является хорошим [[растворитель|растворителем]] веществ с молекулами, обладающими [[Электрический дипольный момент|электрическим дипольным моментом]]. При растворении молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества. |
|||
Вода обладает также высоким поверхностным натяжением, уступая в этом только ртути<ref name="о воде">[http://www.vodoobmen.ru/13-prop.html Свойства воды. Физические свойства воды]</ref><ref name="МГУП">[http://www.msuee.ru/html2/med_gidr/l3_4.html Основные физические свойства воды, водяного пара, льда, снега]</ref><ref>[http://www.habit.ru/35/188.html Коэффициенты поверхностного натяжения жидкостей]</ref><ref>[[:en:Surface tension|Surface tension (англ.)]]</ref>. Относительно высокая вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями. |
|||
Это свойство воды важно для живых существ. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде<ref>{{Cite web |url=http://www.pereplet.ru/obrazovanie/stsoros/355.html |title=Молекулярные преобразователи энергии в живой клетке (Тихонов А. Н., 1997) |access-date=2007-11-24 |archive-date=2009-01-23 |archive-url=https://web.archive.org/web/20090123040046/http://www.pereplet.ru/obrazovanie/stsoros/355.html |deadlink=no }}</ref>. Вода необходима для жизни всех без исключения живых существ на Земле. |
|||
Вода является хорошим [[растворитель|растворителем]] полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества. |
|||
Вода обладает отрицательным [[Электрический потенциал|электрическим потенциалом]] [[поверхность воды|поверхности]]{{уточнить}}. |
|||
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде<ref>[http://www.pereplet.ru/obrazovanie/stsoros/355.html Молекулярные преобразователи энергии в живой клетке (Тихонов А. Н., 1997)]</ref>. Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле. |
|||
[[Файл:2006-01-28 Drop-impact.jpg|thumb|right|181x181px|Капля, ударяющаяся о поверхность воды]] |
|||
Вода обладает отрицательным [[Электрический потенциал|электрическим потенциалом]] [[поверхность воды|поверхности]]. |
|||
[[Деионизированная вода|Чистая вода]] — хороший [[Диэлектрик|изолятор]]. При нормальных условиях вода слабо диссоциирована на ионы и концентрация [[протон]]ов (точнее, ионов [[гидроксоний|гидроксония]] H<sub>3</sub>O<sup>+</sup>) и [[Гидроксильный ион|гидроксильных ионов]] OH<sup>−</sup> составляет {{e|−7|-}} моль/л. Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные вещества, например, соли, то есть в растворе присутствуют другие положительные и отрицательные ионы. Поэтому обычная вода хорошо проводит электрический ток. По электропроводности воды можно определить её чистоту. |
|||
Вода имеет [[показатель преломления]] n=1,33 в оптическом диапазоне. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, чем обусловлен нагрев пищевых продуктов в [[Микроволновая печь|микроволновой печи]]. |
|||
[[Файл:2006-01-28 Drop-impact.jpg|thumb|Капля, ударяющаяся о поверхность воды|181x181px]] |
|||
[[Деионизированная вода|Чистая вода]] — хороший [[Диэлектрик|изолятор]]. При нормальных условиях вода слабо диссоциирована и концентрация [[протон]]ов (точнее, ионов [[гидроксоний|гидроксония]] H<sub>3</sub>O<sup>+</sup>) и [[Гидроксильный ион|гидроксильных ионов]] OH<sup>−</sup> составляет {{e|-7|-}} моль/л. |
|||
Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть присутствуют другие положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту. |
|||
Вода имеет [[показатель преломления]] n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным [[Парниковый газ|парниковым газом]], отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия [[Микроволновая печь|микроволновой печи]]. |
|||
==== Агрегатные состояния ==== |
==== Агрегатные состояния ==== |
||
<!-- |
<!-- |
||
[[Файл:Water phase diagram.svg|right|400px|thumb|[[Фазовая диаграмма]] воды: ось ''Y'' — [[давление]] в {{nowrap|[[Паскаль (единица измерения)|Па{{e|n}}]]}}, ось ''X'' — температура в [[Кельвин]]ах, S — твёрдое состояние, L — жидкое, V — пар, CP — [[Критическая точка (термодинамика)|критическая точка]], TP — [[тройная точка воды]] (273 |
[[Файл:Water phase diagram.svg|right|400px|thumb|[[Фазовая диаграмма]] воды: ось ''Y'' — [[давление]] в {{nowrap|[[Паскаль (единица измерения)|Па{{e|n}}]]}}, ось ''X'' — температура в [[Кельвин]]ах, S — твёрдое состояние, L — жидкое, V — пар, CP — [[Критическая точка (термодинамика)|критическая точка]], TP — [[тройная точка воды]] (273,16 K, 611,73 [[Паскаль (единица измерения)|Па]]).]] |
||
--> |
--> |
||
[[Файл:Water phase diagram.gif|right|400px |
[[Файл:Water phase diagram.gif|thumb|right|400px|[[Фазовая диаграмма воды]]: по вертикальной оси — [[давление]] в [[Паскаль (единица измерения)|Па]], по горизонтальной — температура в [[Кельвин]]ах. Отмечены [[Критическая точка (термодинамика)|критическая]] (647,3 K; 22,1 МПа) и [[тройная точка воды|тройная]] (273,16 K; 610 Па) точки. Римскими цифрами отмечены различные [[Лёд#Фазы льда|структурные модификации льда]]]] |
||
{{main|Водяной пар|Лёд|Фазовая диаграмма воды}} |
|||
{{главная|Водяной пар|Лёд|Фазовая диаграмма воды}} |
|||
По [[Агрегатное состояние|состоянию]] различают: |
По [[Агрегатное состояние|состоянию]] различают: |
||
* « |
* «твёрдое» — [[лёд]] |
||
* « |
* «жидкое» — вода |
||
* « |
* «газообразное» — [[водяной пар]] |
||
[[Файл:SnowflakesWilsonBentley.jpg |
[[Файл:SnowflakesWilsonBentley.jpg|thumb|left|125px|Типы [[Снежинки|снежинок]]]] |
||
При [[Атмосферное давление|нормальном атмосферном давлении]] (760 [[Миллиметр ртутного столба|мм рт. ст.]], 101 325 [[Паскаль (единица измерения)|Па]]) вода переходит в твёрдое состояние при температуре в |
При [[Атмосферное давление|нормальном атмосферном давлении]] (760 [[Миллиметр ртутного столба|мм рт. ст.]], {{nobr|101 325 [[Паскаль (единица измерения)|Па]])}} вода переходит в твёрдое состояние при температуре в {{nobr|0 °C }}и [[Кипение|кипит (превращается в водяной пар)]] при температуре {{nobr|100 °C}} (значения {{nobr|0 °C}} и {{nobr|100 °C}} были выбраны как соответствующие температурам таяния льда и кипения воды при создании [[Градус Цельсия|температурной шкалы «по Цельсию»]]). При снижении давления температура таяния (плавления) льда медленно растёт, а температура кипения воды — падает. При давлении в {{nobr|611,73 Па}} (около 0,006 [[Атмосфера (единица измерения)|атм]]) температура кипения и плавления совпадает и становится равной {{nobr|0,01 °C.}} Такие давление и температура называются [[тройная точка|тройной точкой]] воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура [[Возгонка|возгонки (сублимации)]] льда падает со снижением давления. При высоком давлении существуют модификации [[лёд|льда]] с температурами плавления выше комнатной. |
||
С ростом давления температура кипения воды растёт<ref>''П. И. |
С ростом давления температура кипения воды растёт<ref>''Воскресенский П. И.'' Техника лабораторных работ. 9-е изд. — Л.: «[[Химия (издательство)|Химия]]», 1970. — С. 696—697</ref>: |
||
{| class="wikitable" |
{| class="wikitable" |
||
|- |
|- |
||
! Давление, атм. !! Т<sub>кип</sub>, °C |
! Давление, атм. !! Температура кипения (Т<sub>кип</sub>), °C |
||
|- |
|- |
||
| 0,987 (10<sup>5</sup> Па — нормальные условия) || 99 |
| 0,987 (10<sup>5</sup> Па — нормальные условия) || 99,63 |
||
|- |
|- |
||
| 1 || 100 |
| 1 || 100 |
||
| Строка 154: | Строка 175: | ||
|} |
|} |
||
При росте давления плотность [[Насыщенный пар|насыщенного водяного пара]] в точке кипения тоже растёт, а жидкой воды — падает. При температуре |
При росте давления плотность [[Насыщенный пар|насыщенного водяного пара]] в точке кипения тоже растёт, а жидкой воды — падает. При температуре {{nobr|374 °C}} {{nobr|(647 [[Кельвин|K]])}} и давлении {{nobr|22,064 [[Паскаль (единица измерения)|МПа]]}} (218 [[Атмосфера (единица измерения)|атм]]) вода проходит [[критическая точка (термодинамика)|критическую точку]]. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении и/или температуре исчезает разница между жидкой водой и водяным паром. Такое агрегатное состояние называют «[[сверхкритическая жидкость]]». |
||
Вода может находиться в [[Метастабильное состояние|метастабильных состояниях]] — [[пересыщенный пар]], [[перегретая жидкость]], [[переохлаждённая жидкость]]. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, можно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже |
Вода может находиться в [[Метастабильное состояние|метастабильных состояниях]] — [[пересыщенный пар]], [[перегретая жидкость]], [[переохлаждённая жидкость]]. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, можно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже {{nobr|0 °C,}} однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд. |
||
Также вода может существовать в виде двух разных жидкостей («вторая вода» возникает при температуре около {{nobr|−70 °C}} и давлении в тысячи атмосфер), которые при определённых условиях даже не смешиваются друг с другом; гипотеза, что вода может существовать в двух различных жидких состояниях, была предложена примерно 30 лет назад на основе результатов компьютерного моделирования и экспериментально проверена только в 2020 г<ref>[https://www.vesti.ru/nauka/article/2488442 Невероятно: у воды есть два жидких состояния] {{Wayback|url=https://www.vesti.ru/nauka/article/2488442 |date=20201127235119 }} // [[Вести.ру]], 21 ноября 2020</ref>. |
|||
==== Удельная теплоёмкость ==== |
|||
{| class="wikitable" |
|||
|+Изобарная теплоёмкость воды при нормальном атмосферном давлении<ref>{{Cite web|lang=ru|url=http://thermalinfo.ru/svojstva-zhidkostej/voda-i-rastvory/udelnaya-teploemkost-vody|title=Удельная теплоемкость воды: таблицы при различных температуре и давлении|author=Thermalinfo ruАвтор11 11 2016 в 15:06|website=Thermalinfo.ru|access-date=2022-05-30|archive-date=2021-11-23|archive-url=https://web.archive.org/web/20211123220407/http://thermalinfo.ru/svojstva-zhidkostej/voda-i-rastvory/udelnaya-teploemkost-vody|deadlink=no}}</ref> |
|||
!t, °С |
|||
|0 |
|||
|10 |
|||
|15 |
|||
|20 |
|||
|'''25''' |
|||
|30 |
|||
|35 |
|||
|40 |
|||
|45 |
|||
|50 |
|||
|55 |
|||
|60 |
|||
|65 |
|||
|70 |
|||
|75 |
|||
|80 |
|||
|85 |
|||
|90 |
|||
|95 |
|||
|100 |
|||
|- |
|||
!C<sub>p</sub>, Дж/(кг·град) |
|||
|4217 |
|||
|4191 |
|||
|4187 |
|||
|4183 |
|||
|'''4179''' |
|||
|4174 |
|||
|4174 |
|||
|4174 |
|||
|4177 |
|||
|4181 |
|||
|4182 |
|||
|4182 |
|||
|4185 |
|||
|4187 |
|||
|4191 |
|||
|4195 |
|||
|4202 |
|||
|4208 |
|||
|4214 |
|||
|4220 |
|||
|} |
|||
Эти данные можно аппроксимировать эмпирической формулой: |
|||
: <math>C_{p}\left(t\right)=4219{,}7+0{,}009356\cdot t^{2}-9{,}2788\cdot\sqrt{t};\ \ (0 \le t \le 100\ ^{\text{o}}\text{C})</math><ref>{{Cite web|lang=ru|url=https://www.desmos.com/calculator/up7cbcpbl9?lang=ru|title=Теплоёмкость воды desmos|website=Desmos|access-date=2022-05-30}}</ref>. |
|||
[[Файл:Heat_capacity_of_water_2.jpg|мини|Теплоёмкость льда, воды, и водяного пара при различных давлениях<ref>{{Cite web|lang=ru|url=https://www.desmos.com/calculator/wicmrvrznj?lang=ru|title=График теплоёмкости онлайн|website=Desmos|access-date=2022-06-03|archive-date=2022-06-06|archive-url=https://web.archive.org/web/20220606020344/https://www.desmos.com/calculator/wicmrvrznj?lang=ru|deadlink=no}}</ref>]] |
|||
==== [[Диэлектрическая проницаемость]] воды ==== |
|||
Статическая (для постоянного [[Электростатическое поле|электростатического поля]]) диэлектрическая проницаемость воды <math>\varepsilon</math> при разной абсолютной температуре <math>T</math> при давлении 1 бар в диапазоне температур −13…100 °C выражается [[Эмпирическая формула (познание)|эмпирической формулой]]<ref>{{Cite web|url=https://www.desmos.com/calculator/6nnip9esql|title=аппроксимация диэлектрической проницаемости|website=|access-date=2021-11-16|archive-date=2021-11-16|archive-url=https://web.archive.org/web/20211116051904/https://www.desmos.com/calculator/6nnip9esql|deadlink=no}}</ref>: |
|||
: <math>\varepsilon(T) = 253{,}0390655 - 0,810393675889 \cdot T + 0{,}000753946922643 \cdot T^{2};</math> |
|||
: <math>P = 1~bar; \quad 260~K\le T\le373{,}15~K.</math> |
|||
Результаты вычислений по этой формуле<ref>{{Cite web|url=https://core.ac.uk/download/pdf/276286476.pdf|title=look at page 1162|access-date=2021-11-16|archive-date=2021-11-16|archive-url=https://web.archive.org/web/20211116051902/https://core.ac.uk/download/pdf/276286476.pdf|deadlink=no}}</ref>: |
|||
{| class="wikitable" |
|||
!T, K |
|||
|260 |
|||
|273 |
|||
|283 |
|||
|293 |
|||
|298 |
|||
|303 |
|||
|313 |
|||
|323 |
|||
|333 |
|||
|343 |
|||
|353 |
|||
|363 |
|||
|373 |
|||
|- |
|||
!<math>t^\circ C</math> |
|||
| −13 |
|||
|0 |
|||
|10 |
|||
|'''20''' |
|||
|'''25''' |
|||
|30 |
|||
|40 |
|||
|50 |
|||
|60 |
|||
|70 |
|||
|80 |
|||
|90 |
|||
|100 |
|||
|- |
|||
!<math>\varepsilon</math> |
|||
|93,41 |
|||
|87,99 |
|||
|84,08 |
|||
|'''80,32''' |
|||
|'''78,5''' |
|||
|76,71 |
|||
|73,25 |
|||
|69,94 |
|||
|66,78 |
|||
|63,78 |
|||
|60,92 |
|||
|58,21 |
|||
|55,66 |
|||
|} |
|||
=== Оптические свойства === |
=== Оптические свойства === |
||
Они оцениваются по прозрачности воды, которая, в свою очередь, зависит от [[длина волны|длины волны]] излучения, проходящего через воду. Вследствие поглощения оранжевых и красных компонентов [[свет]]а вода приобретает голубоватую окраску. Вода прозрачна только для видимого света и сильно поглощает [[инфракрасное излучение]], поэтому на инфракрасных фотографиях водная поверхность всегда получается чёрной. [[Ультрафиолетовое излучение|Ультрафиолетовые лучи]] легко проходят через воду, поэтому растительные организмы способны развиваться в толще воды и на дне водоёмов, инфракрасные лучи проникают только в поверхностный слой. Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света. |
Они оцениваются по прозрачности воды, которая, в свою очередь, зависит от [[длина волны|длины волны]] излучения, проходящего через воду. Вследствие поглощения оранжевых и красных компонентов [[свет]]а вода приобретает голубоватую окраску. Вода прозрачна только для видимого света и сильно поглощает [[инфракрасное излучение]], поэтому на инфракрасных фотографиях водная поверхность всегда получается чёрной. [[Ультрафиолетовое излучение|Ультрафиолетовые лучи]] легко проходят через воду, поэтому растительные организмы способны развиваться в толще воды и на дне водоёмов, инфракрасные лучи проникают только в поверхностный слой. Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света<ref>{{Cite web|url=https://bigenc.ru/c/optika-okeana-c81e50|title=Оптика океана|lang=ru|website=Большая российская энциклопедия|date=2023-06-07|access-date=2024-04-14}}</ref><ref>{{Статья|ссылка=https://misclab.umeoce.maine.edu/boss/classes/RT_Weizmann/Chapter3.pdf|автор=University of Maine System|заглавие=Optical properties of water|язык=en|издание=}}</ref>. |
||
=== Изотопные модификации === |
=== Изотопные модификации === |
||
{{ |
{{главная|Изотопный состав воды}} |
||
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа [[изотоп]]ов водорода, входящих в молекулу, выделяют следующие виды воды: |
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа [[изотоп]]ов водорода, входящих в молекулу, выделяют следующие виды воды: |
||
* [[Изотопный состав воды#Свойства и эффекты лёгкой воды| |
* [[Изотопный состав воды#Свойства и эффекты лёгкой воды|лёгкая вода]] (основная составляющая привычной людям воды) <small><ce>H2O</ce></small>; |
||
* [[ |
* [[тяжёлая вода]] (дейтериевая) <small><ce>D2O</ce></small>; |
||
* [[ |
* [[тритиевая вода|сверхтяжёлая вода]] (тритиевая) <small><ce>T2O</ce></small>; |
||
* тритий-дейтериевая вода < |
* тритий-дейтериевая вода <small><ce>TDO</ce></small>; |
||
* тритий-протиевая вода < |
* тритий-протиевая вода <small><ce>THO</ce></small>; |
||
* дейтерий-протиевая вода < |
* дейтерий-протиевая вода <small><ce>DHO</ce></small>. |
||
Последние три вида возможны, так как молекула воды содержит два атома водорода. [[Протий]] — самый лёгкий изотоп водорода, [[дейтерий]] имеет атомную массу 2,0141017778 а. е. м., [[тритий]] — самый тяжёлый, атомная масса 3,0160492777 а. е. м. В воде из-под крана тяжелокислородной воды ( |
Последние три вида возможны, так как молекула воды содержит два атома водорода. [[Протий]] — самый лёгкий изотоп водорода, [[дейтерий]] имеет атомную массу 2,0141017778 а. е. м., [[тритий]] — самый тяжёлый, атомная масса 3,0160492777 а. е. м. В воде из-под крана тяжелокислородной воды (<small><ce>H2 ^{17}O</ce></small> и <small><ce>H2 ^{18}O</ce></small>) содержится больше, чем воды <small><ce>D2 ^{16}O</ce></small>: их содержание, соответственно, {{nobr|1,8 кг}} и {{nobr|0,15 кг}} на тонну<ref name="HiZh0365"/>. |
||
Хотя тяжёлая вода часто считается мёртвой водой, так как живые организмы в ней жить не могут, некоторые микроорганизмы могут быть приучены к существованию в ней<ref name="HiZh0365"/>. |
Хотя тяжёлая вода часто считается мёртвой водой, так как живые организмы в ней жить не могут, некоторые микроорганизмы могут быть приучены к существованию в ней<ref name="HiZh0365"/>. |
||
<!-- Известно, что тяжёлая вода не поддерживает жизни, то есть большинство живых организмов (за исключением некоторых микроорганизмов и грибов) в такой воде умирает<ref name="k">{{lang-en|{{ |
<!-- Известно, что тяжёлая вода не поддерживает жизни, то есть большинство живых организмов (за исключением некоторых микроорганизмов и грибов) в такой воде умирает<ref name="k">{{lang-en|{{статья |pmid=10535697 |заглавие=Pharmacological uses and perspectives of heavy water and deuterated compounds |издание={{Нп3|Canadian Journal of Physiology and Pharmacology|Can. J. Physiol. Pharmacol.|en|Canadian Journal of Physiology and Pharmacology}} |том=77 |номер=2 |страницы=79–88 |цитата=used in boron neutron capture therapy ... D<sub>2</sub>O is more toxic to malignant than normal animal cells ... Protozoa are able to withstand up to 70% D<sub>2</sub>O. Algae and bacteria can adapt to grow in 100% D<sub>2</sub>O |doi=10.1139/cjpp-77-2-79 |язык=en |тип=journal |автор=D. J. Kushner, Alison Baker, and T. G. Dunstall |год=1999}}}}</ref>. --> |
||
По стабильным [[Изотопы кислорода|изотопам кислорода]] < |
По стабильным [[Изотопы кислорода|изотопам кислорода]] <small><ce>^{16}O</ce></small>, <small><ce>^{17}O</ce></small> и <small><ce>^{18}O</ce></small> существуют три разновидности молекул воды. Таким образом, по изотопному составу существуют 18 разновидностей молекул воды. В действительности природная вода содержит все разновидности молекул. |
||
=== Химические свойства === |
=== Химические свойства === |
||
Вода является наиболее распространённым растворителем на планете [[Земля]], во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как [[химия]] водных растворов веществ. |
Вода является наиболее распространённым растворителем на планете [[Земля]], во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как [[химия]] водных растворов веществ. |
||
Воду иногда рассматривают как [[амфолит]] — и кислоту и основание одновременно ([[катион]] H<sup>+</sup> [[анион]] OH<sup>−</sup>). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов [[Гидроксоний|гидроксония]]), [[Константа диссоциации|pK<sub>a</sub>]] = p(1,8⋅10<sup>−16</sup>) ≈ 15,74. |
|||
Вода — химически активное вещество. Сильно полярные молекулы воды [[Сольволиз|сольватируют]] ионы и молекулы, образуют [[гидрат]]ы и [[кристаллогидрат]]ы. Сольволиз, и в частности [[гидролиз]], происходит в живой и неживой природе, и широко используется в [[Химическая промышленность|химической промышленности]]. |
|||
Вода — химически активное вещество. Сильно полярные молекулы воды [[Сольволиз|сольватируют]] ионы и молекулы, образуют [[гидрат]]ы и [[кристаллогидрат]]ы. Сольволиз, и в частности [[гидролиз]], происходит в живой и неживой природе, и широко используется в [[Химическая промышленность|химической промышленности]].<br> |
|||
Воду можно получать: |
Воду можно получать: |
||
* В ходе реакций — |
|||
: <math>\mathsf{2H_2O_2 \rightarrow 2H_2O + O_2\uparrow}</math> |
|||
* в ходе реакций — |
|||
:<math>\mathsf{ |
: <math>\mathsf{NaHCO_3 + CH_3COOH \rightarrow CH_3COONa + H_2O + CO_2\uparrow}</math> |
||
:<math>\mathsf{ |
: <math>\mathsf{2CH_3COOH + CaCO_3 \rightarrow Ca(CH_3COO)_2 + H_2O + CO_2 \uparrow}</math> |
||
:<math>\mathsf{2CH_3COOH + CaCO_3 \rightarrow Ca(CH_3COO)_2 + H_2O + CO_2 \uparrow}</math> |
|||
* В ходе [[Нейтрализация|реакций нейтрализации]] — |
* В ходе [[Нейтрализация|реакций нейтрализации]] — |
||
:<math>\mathsf{H_2SO_4 + 2KOH \rightarrow K_2SO_4 + 2H_2O}</math> |
: <math>\mathsf{H_2SO_4 + 2KOH \rightarrow K_2SO_4 + 2H_2O}</math> |
||
:<math>\mathsf{HNO_3 + NH_4OH \rightarrow NH_4NO_3 + H_2O}</math> |
: <math>\mathsf{HNO_3 + NH_4OH \rightarrow NH_4NO_3 + H_2O}</math> |
||
:<math>\mathsf{2CH_3COOH + Ba(OH)_2 \rightarrow Ba(CH_3COO)_2 + 2H_2O}</math> |
: <math>\mathsf{2CH_3COOH + Ba(OH)_2 \rightarrow Ba(CH_3COO)_2 + 2H_2O}</math> |
||
* Восстановлением водородом оксидов металлов — |
* Восстановлением водородом оксидов металлов — |
||
:<math>\mathsf{CuO + H_2 \rightarrow Cu + H_2O}</math> |
: <math>\mathsf{CuO + H_2 \rightarrow Cu + H_2O}</math> |
||
Под воздействием очень высоких температур или электрического тока (при [[электролиз]]е)<ref name="Uch">{{книга|часть=§ 7. Атомы|автор=Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А.|заглавие=Неорганическая химия: Учебник для 7—8 классов средней школы|издание=18-е изд|год=1987|место=М.|издательство=[[Просвещение (издательство)|Просвещение]]|страницы= |
Под воздействием очень высоких температур или электрического тока (при [[электролиз]]е)<ref name="Uch">{{книга|часть=§ 7. Атомы|автор=Ходаков Ю. В., Эпштейн Д. А., Глориозов П. А.|заглавие=Неорганическая химия: Учебник для 7—8 классов средней школы|ссылка=https://archive.org/details/libgen_00104925|издание=18-е изд|год=1987|место=М.|издательство=[[Просвещение (издательство)|Просвещение]]|страницы=[https://archive.org/details/libgen_00104925/page/n13 15]—18|страниц=240|тираж=1630000}}</ref>, а также под воздействием [[ионизирующее излучение|ионизирующего излучения]], как установил в [[1902 год в науке|1902 году]]<ref name="Slovar">{{статья|заглавие=Радиационная химия|издание=[[Энциклопедический словарь (Педагогика)|Энциклопедический словарь]] юного химика. 2-е изд.|ответственный=Сост. В. А. Крицман, В. В. Станцо|место={{М}}|издательство=[[Педагогика (издательство)|Педагогика]]|isbn=5-7155-0292-6|год=1990|страницы=200}}</ref> {{не переведено 5|Гизель, Фридрих Оскар|Фридрих Гизель|en|Friedrich Oskar Giesel}} при исследовании водного раствора [[Бромид радия|бромида радия]]<ref>{{статья |заглавие=Water Radiolysis: Influence of Oxide Surfaces on H<sub>2</sub> Production under Ionizing Radiation |издание=Water |том=3 |страницы=236 |ссылка=http://www.mdpi.com/2073-4441/3/1/235/pdf |язык=en |тип=journal |автор=Le Caër S. |год=2011 |archivedate=2014-03-23 |archiveurl=https://web.archive.org/web/20140323172912/http://www.mdpi.com/2073-4441/3/1/235/pdf }}</ref>, вода разлагается на молекулярный [[кислород]] и молекулярный [[водород]]: |
||
:<math>\mathsf{2H_2O \rightarrow 2H_2\uparrow + O_2\uparrow}</math> |
: <math>\mathsf{2H_2O \rightarrow 2H_2\uparrow + O_2\uparrow}</math> |
||
Вода реагирует при комнатной температуре: |
Вода реагирует при комнатной температуре: |
||
* с активными [[Металлы|металлами]] ([[натрий]], [[калий]], [[кальций]], [[барий]] и др.) |
* с активными [[Металлы|металлами]] ([[натрий]], [[калий]], [[кальций]], [[барий]] и др.) |
||
:<math>\mathsf{2H_2O + 2Na \rightarrow 2NaOH + H_2\uparrow}</math> |
: <math>\mathsf{2H_2O + 2Na \rightarrow 2NaOH + H_2\uparrow}</math> |
||
* со [[фтор]]ом и межгалоидными соединениями |
* со [[фтор]]ом и межгалоидными соединениями |
||
:<math>\mathsf{2H_2O + 2F_2 \rightarrow 4HF + O_2}</math> |
: <math>\mathsf{2H_2O + 2F_2 \rightarrow 4HF + O_2}</math> |
||
:<math>\mathsf{H_2O + F_2 \rightarrow HF + HOF}</math> (при низких температурах) |
: <math>\mathsf{H_2O + F_2 \rightarrow HF + HOF}</math> (при низких температурах) |
||
:<math>\mathsf{3H_2O + 2IF_5 \rightarrow 5HF + HIO_3}</math> |
: <math>\mathsf{3H_2O + 2IF_5 \rightarrow 5HF + HIO_3}</math> |
||
:<math>\mathsf{9H_2O + 5BrF_3 \rightarrow 15HF + Br_2 + 3HBrO_3}</math> |
: <math>\mathsf{9H_2O + 5BrF_3 \rightarrow 15HF + Br_2 + 3HBrO_3}</math> |
||
* с [[Соли|солями]], образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз |
* с [[Соли|солями]], образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз |
||
:<math>\mathsf{Al_2S_3 +6H_2O \rightarrow 2Al(OH)_3\downarrow + 3H_2S\uparrow}</math> |
: <math>\mathsf{Al_2S_3 +6H_2O \rightarrow 2Al(OH)_3\downarrow + 3H_2S\uparrow}</math> |
||
* с ангидридами и галогенангидридами карбоновых и неорганических кислот |
* с ангидридами и галогенангидридами карбоновых и неорганических кислот |
||
| Строка 225: | Строка 353: | ||
Вода реагирует при нагревании: |
Вода реагирует при нагревании: |
||
* с [[железо]]м, [[Магний|магнием]] |
* с [[железо]]м, [[Магний|магнием]] |
||
:<math>\mathsf{4H_2O + 3Fe \rightarrow Fe_3O_4 + 4H_2}</math> |
: <math>\mathsf{4H_2O + 3Fe \rightarrow Fe_3O_4 + 4H_2}</math> |
||
* с углём, [[метан]]ом |
* с углём, [[метан]]ом |
||
:<math>\mathsf{H_2O + C \rightleftarrows \ CO + H_2}</math> |
: <math>\mathsf{H_2O + C \rightleftarrows \ CO + H_2}</math> |
||
* с некоторыми алкилгалогенидами |
* с некоторыми алкилгалогенидами |
||
Вода реагирует в присутствии [[катализатор]]а: |
Вода реагирует в присутствии [[катализатор]]а: |
||
* с амидами, эфирами карбоновых кислот |
|||
{{кол}} |
|||
* с ацетиленом и другими [[алкины|алкинами]] |
|||
* с амидами, эфирами карбоновых кислот; |
|||
* с алкенами |
|||
* с ацетиленом и другими [[Алкины|алкинами]]; |
|||
* с |
* с нитрилами |
||
* с нитрилами. {{конец}} |
|||
==== Волновая функция основного состояния воды ==== |
==== Волновая функция основного состояния воды ==== |
||
| Строка 249: | Строка 376: | ||
<math>(a_1)\otimes(a_1)\otimes(b_2)\otimes(b_2)\otimes(a_1)\otimes(a_1)\otimes(b_1)\otimes(b_1).</math> |
<math>(a_1)\otimes(a_1)\otimes(b_2)\otimes(b_2)\otimes(a_1)\otimes(a_1)\otimes(b_1)\otimes(b_1).</math> |
||
Принимая во внимание, что прямое произведение невырожденного НП самого на себя является полносимметричным НП и прямое произведение любого невырожденного представления Г на полносимметричное есть Г, получаем: |
|||
Принимая во внимание, что: |
|||
* прямое произведение невырожденного НП самого на себя является полносимметричным НП. |
|||
* прямое произведение любого невырожденного представления Г на полносимметричное есть Г, получаем: |
|||
<math>\underbrace{\underbrace {a_{1}\otimes a_{1}\otimes}_{A_{1}} \underbrace{b_{2}\otimes b_{2}}_{A_1}\otimes \underbrace{a_{1}\otimes a_{1}}_{A_{1}} \otimes \underbrace{b_{1}\otimes b_{1}}_{A_1}}_{A_{1}}</math> |
<math>\underbrace{\underbrace {a_{1}\otimes a_{1}\otimes}_{A_{1}} \underbrace{b_{2}\otimes b_{2}}_{A_1}\otimes \underbrace{a_{1}\otimes a_{1}}_{A_{1}} \otimes \underbrace{b_{1}\otimes b_{1}}_{A_1}}_{A_{1}}</math> |
||
[[Файл:Water drops on spider web.jpg|мини|справа|Капли воды на паутине]] |
|||
== Виды == |
== Виды == |
||
Вода на Земле может существовать в трёх основных состояниях: |
Вода на Земле может существовать в трёх основных состояниях: |
||
* твёрдом |
|||
* жидком, |
|||
* жидком |
|||
* газообразном |
* газообразном |
||
* твёрдом. |
|||
Вода может приобретать различные формы, которые могут одновременно соседствовать и взаимодействовать друг с другом: |
Вода может приобретать различные формы, которые могут одновременно соседствовать и взаимодействовать друг с другом: |
||
* водяной [[пар]] и [[облако|облака]] в [[небо|небе]]; |
|||
{{кол}} |
|||
* [[морская вода]] и [[айсберг]]и; |
|||
* водяной [[пар]] и [[Облако|облака]] в [[Небо|небе]], |
|||
* [[ледник]]и и [[река|реки]] на поверхности земли; |
|||
* [[морская вода]] и [[айсберг]]и, |
|||
* [[водоносный горизонт|водоносные слои]] в земле. |
|||
* [[ледник]]и и [[Река|реки]] на поверхности земли, |
|||
* [[Водоносный горизонт|водоносные слои]] в земле. {{конец}} |
|||
Вода способна растворять в себе множество органических и неорганических веществ. Из-за важности воды как источника жизни, её нередко подразделяют на типы по различным принципам. |
|||
Виды воды по особенностям происхождения, состава или применения. |
|||
;<nowiki>По содержанию катионов кальция и магния:</nowiki> |
|||
* [[мягкая вода]] |
|||
* [[жёсткая вода]] |
|||
;<nowiki>По изотопам водорода в молекуле:</nowiki> |
|||
* [[Изотопный состав воды#Свойства и эффекты лёгкой воды|лёгкая вода]] (по составу почти соответствует обычной) |
|||
* [[тяжёлая вода]] (дейтериевая) |
|||
* [[сверхтяжёлая вода]] (тритиевая) |
|||
;<nowiki>Другие виды:</nowiki> |
|||
* [[пресная вода]] |
|||
* [[Дождь|дождевая вода]] |
|||
* [[морская вода]] |
|||
* [[подземные воды]] |
|||
* [[минеральная вода]] |
|||
* [[солоноватая вода]] |
|||
* [[питьевая вода]] и [[водопроводная вода]] |
|||
* [[дистиллированная вода]] и [[деионизированная вода]] |
|||
* [[сточные воды]] |
|||
* [[ливневая вода]] или [[поверхностные воды]] |
|||
* [[апирогенная вода]] |
|||
* [[поливода]] |
|||
* [[структурированная вода]] — термин, применяемый в [[псевдонаука|неакадемических теориях]] |
|||
* [[талая вода]] |
|||
* [[мёртвая вода]] и [[живая вода]] — виды воды со [[сказка|сказочными]] свойствами |
|||
Вода, входящая в состав другого вещества и связанная с ним физическими связями, называется ''влагой''. В зависимости от вида связи, выделяют: |
|||
* сорбционную, капиллярную и осмотическую влагу в твёрдых веществах, |
|||
* растворённую и эмульсионную влагу в жидкостях, |
|||
* водяной пар или [[туман]] в [[газ]]ах. |
|||
[[Вещество (химия)|Вещество]], содержащее влагу, называют ''влажным веществом''. Влажное вещество, не способное более сорбировать (поглощать) влагу, — ''насыщенное влагой вещество''. |
|||
Вода способна растворять в себе множество органических и неорганических веществ. Из-за важности воды, «как источника жизни», её нередко подразделяют на типы по различным принципам. |
|||
Вещество, в котором содержание влаги пренебрежимо мало при данном конкретном применении, называют ''сухим веществом''. Гипотетическое вещество, совершенно не содержащее влагу, — ''абсолютно сухое вещество''. Сухое вещество, составляющее основу данного влажного вещества, называют ''сухой частью влажного вещества''. |
|||
Виды воды по особенностям происхождения, состава или применения: |
|||
;по содержанию катионов кальция и магния |
|||
* [[Мягкая вода]], |
|||
* [[жёсткая вода]]. |
|||
Смесь газа с водяным паром носит название ''влажный газ'' (''парогазовая смесь'' — устаревшее название){{sfn|rmg|2015|с=2}}. |
|||
;по изотопам водорода в молекуле |
|||
* [[Изотопный состав воды#Свойства и эффекты лёгкой воды|Лёгкая вода]] (по составу почти соответствует обычной), |
|||
* [[Тяжёлая вода]] (дейтериевая), |
|||
* [[Сверхтяжёлая вода]] (тритиевая). |
|||
[[Файл:2005. Марка России list hi12612326694b2ce21dd8c2a.jpg|thumb|right|350px|[[Малый лист]] России 2005 года «Земля — голубая планета» с выразительной цитатой о воде из «[[Планета людей|Земли людей]]» [[Антуан де Сент-Экзюпери|Антуана де Сент-Экзюпери]] вверху на полях: «ВОДА! У тебя нет ни вкуса, ни цвета, ни запаха, тебя невозможно описать, тобою наслаждаются, не ведая, что ты такое. Нельзя сказать, что ты необходима для жизни, ты — сама жизнь…»<ref>Перевод тут близок к первому: {{книга|часть=Земля людей (Перевод Горация Велле). VII. В сердце пустыни|страницы=181|ответственный=Пер. с фр. под ред. Е. Зониной| заглавие=Антуан де Сент-Экзюпери. Земля людей|издательство=[[Государственное издательство художественной литературы]]|место=М.|год=1957|серия=Зарубежный роман XX века|тираж=165000}}</ref>{{ЦФА|1050—1054}}]] |
|||
;другие виды |
|||
{{кол}} |
|||
* [[Пресная вода]], |
|||
* [[Дождевая вода]], |
|||
* [[Морская вода]], |
|||
* [[Подземные воды]], |
|||
* [[Минеральная вода]], |
|||
* [[Солоноватая вода]] ([[:en:Brackish water]]), |
|||
* [[Питьевая вода]] и [[Водопроводная вода]], |
|||
* [[Дистиллированная вода]] и [[деионизированная вода]], |
|||
* [[Сточные воды]], |
|||
* [[Ливневая вода]] или [[поверхностные воды]], |
|||
* [[Апирогенная вода]], |
|||
* [[Поливода]], |
|||
* [[Структурированная вода]] — термин, применяемый в различных [[Псевдонаука|неакадемических теориях]], |
|||
* [[Талая вода]], |
|||
* [[Мёртвая вода]] и [[Живая вода]] — виды воды со [[Сказка|сказочными]] свойствами, |
|||
* [[Святая вода]] — особый вид воды с мистическими свойствами (согласно религиозным учениям). {{конец}} |
|||
== В природе == |
== В природе == |
||
{{См. также|Роль воды в клетке}} |
{{См. также|Роль воды в клетке}} |
||
В [[Атмосфера Земли|атмосфере]] [[Земля|нашей планеты]] вода находится в виде капель малого размера, в [[облако|облаках]] и [[туман]]е, а также в виде [[пар]]а. При [[конденсация|конденсации]] выводится из атмосферы в виде [[атмосферные осадки|атмосферных осадков]] ([[дождь]], [[снег]], [[град]], [[роса]]). В совокупности жидкая водная оболочка Земли называется [[гидросфера|гидросферой]], а твёрдая |
В [[Атмосфера Земли|атмосфере]] [[Земля|нашей планеты]] вода находится в виде капель малого размера, в [[облако|облаках]] и [[туман]]е, а также в виде [[пар]]а. При [[конденсация|конденсации]] выводится из атмосферы в виде [[атмосферные осадки|атмосферных осадков]] ([[дождь]], [[снег]], [[град]], [[роса]]). В совокупности жидкая водная оболочка Земли называется [[гидросфера|гидросферой]], а твёрдая — [[Криосфера|криосферой]]. Вода является важнейшим веществом всех живых организмов на Земле. Предположительно, [[Возникновение жизни|зарождение жизни]] на Земле произошло в водной среде. |
||
Мировой океан содержит более 97,54 % земной воды, |
Мировой океан содержит более 97,54 % земной воды, ледники — 1,81 %, подземные воды — около 0,63 %, реки и озёра — 0,009 %, материковые солёные воды — 0,007 %, атмосфера — 0,001 %<ref name="Mari"/>. |
||
=== Атмосферные осадки === |
=== Атмосферные осадки === |
||
{{ |
{{главная|Атмосферные осадки}}{{Раздел не написан|дата=26.12.2020}} |
||
=== Вода за пределами Земли === |
=== Вода за пределами Земли === |
||
{{ |
{{главная|Внеземная вода}} |
||
Вода — чрезвычайно распространённое вещество в [[Космическое пространство|космосе]], однако из-за высокого внутрижидкостного давления вода не может существовать в жидком состоянии в условиях вакуума космоса, отчего она представлена только в виде пара или льда. |
Вода — чрезвычайно распространённое вещество в [[Космическое пространство|космосе]], однако из-за высокого внутрижидкостного давления вода не может существовать в жидком состоянии в условиях [[Вакуум|вакуума]] космоса, отчего она представлена только в виде пара или льда. |
||
Одним из наиболее важных вопросов, связанных с [[Колонизация космоса|освоением космоса человеком]] и возможности возникновения [[Внеземная жизнь|жизни на других планетах]], является вопрос о наличии воды за пределами Земли в достаточно большой концентрации. Известно, что некоторые [[Комета|кометы]] более, чем на 50 % состоят из водяного льда. Не |
Одним из наиболее важных вопросов, связанных с [[Колонизация космоса|освоением космоса человеком]] и возможности возникновения [[Внеземная жизнь|жизни на других планетах]], является вопрос о наличии воды за пределами Земли в достаточно большой концентрации. Известно, что некоторые [[Комета|кометы]] более, чем на 50 % состоят из водяного льда. Не любая водная среда, однако, пригодна для жизни. |
||
В результате бомбардировки [[Луна|лунного]] [[Ударный кратер|кратера]], проведённой [[9 октября]] [[2009 |
В результате бомбардировки [[Луна|лунного]] [[Ударный кратер|кратера]], проведённой [[9 октября]] [[2009 год]]а [[Национальное управление США по аэронавтике и исследованию космического пространства|НАСА]] с использованием космического аппарата [[Lunar Crater Observation and Sensing Satellite|LCROSS]], впервые были получены достоверные свидетельства наличия на спутнике Земли водяного льда в больших объёмах<ref>{{Cite web |url=https://infuture.ru/article/2535 |title=Вода на Луне: но откуда? |access-date=2020-09-08 |archive-date=2020-09-20 |archive-url=https://web.archive.org/web/20200920144917/https://infuture.ru/article/2535 |deadlink=no }}</ref>. |
||
Вода широко распространена в [[Солнечная система|Солнечной системе]]. Наличие воды (в основном в виде льда) подтверждено на многих спутниках Юпитера и Сатурна: [[Энцелад (спутник)|Энцеладе]]<ref name="NASA-20140403">{{cite web | |
Вода широко распространена в [[Солнечная система|Солнечной системе]]. Наличие воды (в основном в виде льда) подтверждено на многих спутниках Юпитера и Сатурна: [[Энцелад (спутник)|Энцеладе]]<ref name="NASA-20140403">{{cite web |author=Jane Platt, Brian Bell |title=NASA Space Assets Detect Ocean inside Saturn Moon |url=http://www.jpl.nasa.gov/news/news.php?release=2014-103 |date=2014-04-03 |work=[[NASA]] |accessdate=2014-04-03 |archive-date=2014-04-03 |archive-url=https://web.archive.org/web/20140403235224/http://www.jpl.nasa.gov/news/news.php?release=2014-103 |deadlink=no }}</ref><ref name="SCI-20140404">{{статья |заглавие=The Gravity Field and Interior Structure of Enceladus |ссылка=http://www.sciencemag.org/content/344/6179/78 |издание=[[Science]] |том=344 |страницы=78—80 |doi=10.1126/science.1250551 |accessdate=2014-04-03 |язык=en |тип=journal |автор=Iess, L.; Stevenson, D.J.; Parisi, M.; Hemingway, D.; Jacobson, R.A.; Lunine, J.I.; Nimmo, F.; Armstrong, J.w.; Asmar, S.w.; Ducci, M.; Tortora, P. |число=4 |месяц=4 |год=2014 |archivedate=2014-04-06 |archiveurl=https://web.archive.org/web/20140406132256/http://www.sciencemag.org/content/344/6179/78 }}</ref>, [[Тефия (спутник)|Тефии]], [[Европа (спутник)|Европе]], [[Ганимед (спутник)|Ганимеде]] и др. Вода присутствует в составе всех комет и многих астероидов. Учёными предполагается, что многие [[Транснептуновый объект|транснептуновые объекты]] имеют в своём составе воду. |
||
Вода в виде [[водяной пар|паров]] содержится в атмосфере [[Атмосфера Солнца|Солнца]] (следы)<ref name=Solanki1994> |
Вода в виде [[водяной пар|паров]] содержится в атмосфере [[Атмосфера Солнца|Солнца]] (следы)<ref name=Solanki1994> |
||
{{ |
{{статья |заглавие=New Light on the Heart of Darkness of the Solar Chromosphere |издание=[[Science]] |pmid=17748350 |том=263 |номер=5143 |страницы=64—66 |bibcode=1994Sci...263...64S |doi=10.1126/science.263.5143.64 |ref=Solanki |язык=en |тип=journal |автор=Solanki, S. K.; Livingston, W.; Ayres, T. |год=1994}}</ref>, атмосферах [[Атмосфера Меркурия|Меркурия]] (3,4 %, также большие количества воды обнаружены в [[Экзосфера|экзосфере]] Меркурия)<ref name="planetary society">{{cite web|url=http://www.planetary.org/news/2008/0703_MESSENGER_Scientists_Astonished_to.html|title=MESSENGER Scientists 'Astonished' to Find Water in Mercury's Thin Atmosphere|accessdate=2008-07-05|publisher=Planetary Society|date=2008-07-03|archiveurl=https://www.webcitation.org/5mq2XbjDu?url=http://www.planetary.org/news/2008/0703_MESSENGER_Scientists_Astonished_to.html|archivedate=2010-01-17}}</ref>, [[Атмосфера Венеры|Венеры]] (0,002 %)<ref name=Bertaux2007>{{статья |заглавие=A warm layer in Venus' cryosphere and high-altitude measurements of HF, HCl, H<sup>2</sup>O and HDO |издание=Nature |том=450 |страницы=646—649 |doi=10.1038/nature05974 |bibcode=2007Natur.450..646B |pmid=18046397 |номер=7170 |язык=en |тип=journal |автор=Bertaux, Jean-Loup; Vandaele, Ann-Carine; Korablev, Oleg; Villard, E.; Fedorova, A.; Fussen, D.; Quémerais, E.; Belyaev, D.; Mahieux, A. |год=2007}}</ref>, [[Атмосфера Луны|Луны]]<ref name="Sridharan2010"> |
||
{{ |
{{статья |страницы=947 |номер=6 |том=58 |заглавие='Direct' evidence for water in the sunlit lunar ambience from CHACE on MIP of Chandrayaan I |издание=[[Planetary and Space Science]] |doi=10.1016/j.pss.2010.02.013 |bibcode=2010P&SS...58..947S |язык=en |тип=journal |автор=Sridharan, R.; S.M. Ahmed, Tirtha Pratim Dasa, P. Sreelathaa, P. Pradeepkumara, Neha Naika, and Gogulapati Supriya |год=2010}}</ref>, [[Атмосфера Марса|Марса]] (0,03 %)<ref name="Rapp2012">{{Книга |автор=Donald Rapp |заглавие=Use of Extraterrestrial Resources for Human Space Missions to Moon or Mars |ссылка=https://books.google.com/books?id=2xzxhnBRHCMC&pg=PA78 |год=28 November 2012 |издательство=Springer |isbn=978-3-642-32762-9 |pages=78– |archivedate=2016-07-15 |archiveurl=https://web.archive.org/web/20160715154349/https://books.google.com/books?id=2xzxhnBRHCMC&pg=PA78 }}</ref>, [[Атмосфера Юпитера|Юпитера]] (0,0004 %)<ref>{{статья |
||
|doi=10.1007/s11214-005-1951-5 |
|||
}}</ref>, [[Европа (спутник)|Европы]]<ref name="NASA-20131212-EU">{{cite web|last1=Cook |first1=Jia-Rui C.|last2=Gutro|first2=Rob|last3=Brown|first3=Dwayne|last4=Harrington |first4=J.D. |last5=Fohn|first5=Joe|title=Hubble Sees Evidence of Water Vapor at Jupiter Moon|url=http://www.jpl.nasa.gov/news/news.php?release=2013-363|date=December 12, 2013 |work=[[NASA]] |accessdate=December 12, 2013 }}</ref>, [[Атмосфера Сатурна|Сатурна]], [[Атмосфера Урана|Урана]] (следы){{sfn|Encrenaz, 2003|p=92}} и Нептуна<ref name=hubbard>{{cite journal|last=Hubbard|first=W. B.|title=Neptune's Deep Chemistry|journal=Science|year=1997|volume=275|issue=5304|pages=1279–1280|doi=10.1126/science.275.5304.1279|pmid=9064785}}</ref> (найден в нижних слоях атмосферы). |
|||
|заглавие=Coupled Clouds and Chemistry of the Giant Planets — A Case for Multiprobes |
|||
|издание=[[Space Science Reviews]] |
|||
|issn=0032-0633 |
|||
|том=116 |
|||
|страницы=121—136 |
|||
|ссылка=http://www-personal.umich.edu/~atreya/Chapters/2005_JovianCloud_Multiprobes.pdf |
|||
|bibcode=2005SSRv..116..121A |
|||
|ref=Atreya |
|||
|язык=en |
|||
|тип=journal |
|||
|автор=Atreya, Sushil K.; Wong, Ah-San |
|||
|год=2005 |
|||
|издательство=[[Springer Science+Business Media|Springer]] |
|||
|archivedate=2011-07-22 |
|||
|archiveurl=https://web.archive.org/web/20110722074717/http://www-personal.umich.edu/~atreya/Chapters/2005_JovianCloud_Multiprobes.pdf |
|||
}}</ref>, [[Европа (спутник)|Европы]]<ref name="NASA-20131212-EU">{{cite web|author=Jia-Rui C. Cook, Rob Gutro, Dwayne Brown, J. D. Harrington, Joe Fohn|title=Hubble Sees Evidence of Water Vapor at Jupiter Moon|url=http://www.jpl.nasa.gov/news/news.php?release=2013-363|date=2013-12-12|work=[[NASA]]|accessdate=2013-12-12|archive-date=2013-12-15|archive-url=https://web.archive.org/web/20131215053143/http://www.jpl.nasa.gov/news/news.php?release=2013-363|deadlink=yes}}</ref>, [[Сатурн]], [[Атмосфера Урана|Урана]] (следы){{sfn|Encrenaz|2003|p=92}} и Нептуна<ref name=hubbard>{{статья |заглавие=Neptune's Deep Chemistry |издание=Science |том=275 |номер=5304 |страницы=1279—1280 |doi=10.1126/science.275.5304.1279 |pmid=9064785 |язык=en |автор=Hubbard, W. B. |год=1997}}</ref> (найден в нижних слоях атмосферы). |
|||
Содержание водяного пара в [[Атмосфера Земли|атмосфере Земли]] у поверхности колеблется от 3—4 % в тропиках до 2·10<sup>−5</sup>% в Антарктиде<ref>{{Из БСЭ|заглавие=Земля (планета)}}</ref>. |
Содержание водяного пара в [[Атмосфера Земли|атмосфере Земли]] у поверхности колеблется от 3—4 % в тропиках и до 2·10<sup>−5</sup>% в Антарктиде<ref>{{Из БСЭ|заглавие=Земля (планета)}}</ref>. |
||
Кроме того, вода обнаружена на [[экзопланета]]х, например [[HD 189733 A b]]<ref>[ |
Кроме того, вода обнаружена на [[экзопланета]]х, например [[HD 189733 A b]]<ref>[https://time.com/time/health/article/0,8599,1642811,00.html Water Found on Distant Planet] {{Wayback|url=https://time.com/time/health/article/0,8599,1642811,00.html |date=20130824152119 }} 12 July 2007 By Laura Blue, Time''</ref>, [[HD 209458 b]]<ref>{{Cite web |url=http://www.space.com/3673-water-extrasolar-planet-atmosphere.html |title=Water Found in Extrasolar Planet’s Atmosphere |access-date=2014-04-12 |archive-date=2014-03-08 |archive-url=https://web.archive.org/web/20140308014850/http://www.space.com/3673-water-extrasolar-planet-atmosphere.html |deadlink=no }}</ref> и [[GJ 1214 b]]<ref>{{cite web|url=https://news.mail.ru/society/8181784/|title=Атмосфера экзопланеты GJ 1214b переполнена водой|quote=Новые наблюдения транзитов GJ 1214 b, удалённой от Земли на 40 световых лет, показали, что вода должна составлять не менее половины от всей массы атмосферы этой «суперземли»|date=2012-02-24|publisher=Компьюлента|accessdate=2013-07-21|archiveurl=https://www.webcitation.org/6JEOAn4Qk?url=https://news.mail.ru/society/8181784/|archivedate=2013-08-29}}</ref>. |
||
Жидкая вода, предположительно, имеется под поверхностью некоторых [[спутники планет|спутников планет]] |
Жидкая вода, предположительно, имеется под поверхностью некоторых [[спутники планет|спутников планет]] — наиболее вероятно, на [[Европа (спутник Юпитера)|Европе]] — спутнике [[Юпитер (планета)|Юпитера]]. |
||
== Биологическая роль == |
== Биологическая роль == |
||
{{ |
{{главная|Роль воды в клетке}} |
||
[[Файл:2006-02-13 Drop-impact.jpg|thumb|right|250px|Полный стакан с водой]] |
|||
[[Файл:2006-02-13 Drop-impact.jpg|thumb|250px|right|Полный стакан с водой]]Вода играет уникальную роль как [[вещество]], определяющее возможность существования и саму [[жизнь]] всех существ на [[Земля|Земле]]. Она выполняет роль универсального [[Растворитель|растворителя]], в котором происходят основные биохимические процессы живых [[организм]]ов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений. |
|||
Вода играет уникальную роль как [[вещество]], определяющее возможность существования и саму [[жизнь]] всех существ на [[Земля|Земле]]. Она выполняет роль универсального [[Растворитель|растворителя]], в котором происходят основные биохимические процессы живых [[организм]]ов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений. |
|||
Благодаря [[Водородная связь|водородной связи]], вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время. |
Благодаря [[Водородная связь|водородной связи]], вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время. |
||
Поскольку у льда плотность меньше, чем у жидкой воды, вода в водоёмах замерзает сверху, а не снизу. Образовавшийся слой льда препятствует дальнейшему промерзанию водоёма, это позволяет его обитателям выжить. Существует и другая точка зрения: если бы вода не расширялась при замерзании, то не разрушались бы клеточные структуры, соответственно замораживание не наносило бы ущерба живым организмам. Некоторые существа (тритоны) переносят замораживание/оттаивание — считается что этому способствует особый состав клеточной плазмы, не расширяющейся при замораживании. |
Поскольку у льда плотность меньше, чем у жидкой воды, вода в водоёмах замерзает сверху, а не снизу. Образовавшийся слой льда препятствует дальнейшему промерзанию водоёма, это позволяет его обитателям выжить. Существует и другая точка зрения: если бы вода не расширялась при замерзании, то не разрушались бы клеточные структуры, соответственно замораживание не наносило бы ущерба живым организмам. Некоторые существа ([[тритоны]]) переносят замораживание/оттаивание — считается, что этому способствует особый состав клеточной плазмы, не расширяющейся при замораживании. |
||
== Применение == |
== Применение == |
||
;В земледелии |
|||
Выращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды на [[Ирригация|ирригацию]], доходящих до 90 % в некоторых странах. |
|||
=== В [[Земледелие|земледелии]] === |
|||
;Для питья и приготовления пищи |
|||
Выращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды на [[Ирригация|ирригацию]]. |
|||
[[Файл:Fresh Pure Water.jpg|thumb|200px|Бокал чистой [[Питьевая вода|питьевой воды]]]] |
|||
Живое человеческое тело содержит от 50 % до 75 % воды<ref>Watson, P. E. et al. (1980) Total body water volumes for adult males and females estimated from simple anthropometric measurements, The American Journal for Clinical Nutrition, Vol. 33, No 1, pp.27-39.</ref>, в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. В зависимости от температуры и влажности окружающей среды, физической активности и т. д. человеку нужно выпивать разное количество воды. Ведётся много споров о том, сколько воды нужно потреблять для оптимального функционирования организма. |
|||
=== Для питья и приготовления пищи === |
|||
[[Питьевая вода]] представляет собой воду из какого-либо источника, очищенную от [[микроорганизм]]ов и вредных примесей. Пригодность воды для питья при её [[обеззараживание|обеззараживании]] перед подачей в [[водопровод]] оценивается по количеству [[кишечная палочка|кишечных палочек]] на [[литр]] воды, поскольку кишечные палочки распространены и достаточно устойчивы к антибактериальным средствам, и если кишечных палочек будет мало, то будет мало и других [[микроб]]ов. Если кишечных палочек не больше, чем 3 на литр, вода считается пригодной для питья<ref>{{статья|автор=Моргунова Г.С.|заглавие=Вода, которую мы пьём|издание=[[Химия и жизнь]]|год=1965|номер=3|страницы=15—17}}</ref><ref>{{Книга|автор=Sharma B.K.|глава=Escherichia coli - water pollution indicator|заглавие=Water Pollution|год=1994|pages=408-409|ссылка=https://books.google.com/books?id=R8HtwoFsOogC&pg=PT210#v=onepage&q&f=false}}</ref>. |
|||
{{главная|Питьевая вода}} |
|||
[[Файл:Fresh Pure Water.jpg|thumb|right|250x250px|Бокал чистой [[Питьевая вода|питьевой воды]]]] |
|||
Живое человеческое тело содержит от 50 % до 75 % воды<ref>Watson, P. E. et al. (1980) Total body water volumes for adult males and females estimated from simple anthropometric measurements, The American Journal for Clinical Nutrition, Vol. 33, № 1, pp. 27—39.</ref>, в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. В зависимости от температуры и влажности окружающей среды, физической активности и т. д. человеку нужно выпивать разное количество воды; ведётся много споров о том, сколько воды нужно потреблять для оптимального функционирования организма. |
|||
[[Питьевая вода]] представляет собой воду из какого-либо источника, очищенную от [[микроорганизм]]ов и вредных примесей. Пригодность воды для питья при её [[обеззараживание|обеззараживании]] перед подачей в [[водопровод]] оценивается по количеству [[кишечная палочка|кишечных палочек]] на [[литр]] воды, поскольку кишечные палочки распространены и достаточно устойчивы к антибактериальным средствам, и если кишечных палочек будет мало, то будет мало и других [[микроб]]ов. Если кишечных палочек не больше, чем 3 на литр, вода считается пригодной для питья<ref>{{статья|автор=Моргунова Г. С. |заглавие=Вода, которую мы пьём |издание=[[Химия и жизнь]] |год=1965 |номер=3 |страницы=15—17}}</ref><ref>{{Книга |автор=Sharma B. K. |глава=Escherichia coli - water pollution indicator |заглавие=Water Pollution |год=1994 |pages=408—409 |ссылка=https://books.google.com/books?id=R8HtwoFsOogC&pg=PT210 |archivedate=2014-07-10 |archiveurl=https://web.archive.org/web/20140710050752/https://books.google.com/books?id=R8HtwoFsOogC&pg=PT210#v=onepage&q&f=false }}</ref>. |
|||
;Как растворитель |
|||
Вода является [[Растворитель|растворителем]] для многих веществ. Она используется для очистки как самого человека, так и различных объектов человеческой деятельности. Вода используется как растворитель в промышленности. |
|||
[[Файл:PressurizedWaterReactor ru.gif|thumb|250x250px|альт=|Схема работы атомной электростанции на двухконтурном водо-водяном энергетическом реакторе ([[ВВЭР]]]] |
|||
;В качестве теплоносителя |
|||
[[Файл:PressurizedWaterReactor ru.gif|right|thumb|Схема работы атомной электростанции на двухконтурном водо-водяном энергетическом реакторе ([[ВВЭР]])|240x240px]] |
|||
Среди существующих в природе жидкостей вода обладает наибольшей теплоёмкостью. Теплота её испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь [[аммиак]]у. В качестве [[теплоноситель|теплоносителя]] воду используют в [[Тепловая сеть|тепловых сетях]], для передачи тепла по [[теплотрасса]]м от производителей тепла к потребителям. Воду в виде льда используют для охлаждения в системах общественного питания, в медицине. Большинство [[атомная электростанция|атомных электростанций]] используют воду в качестве теплоносителя. |
|||
=== В спорте === |
|||
;Как замедлитель |
|||
Во многих [[ядерный реактор|ядерных реакторах]] вода используется не только в качестве теплоносителя, но и [[Замедление нейтронов|замедлителя нейтронов]] для эффективного протекания [[Цепная ядерная реакция|цепной ядерной реакции]]. Также существуют [[Тяжеловодный ядерный реактор|тяжеловодные реакторы]], в которых в качестве замедлителя используется [[тяжёлая вода]]. |
|||
;Для Пожаротушения |
|||
В [[Пожаротушение|пожаротушении]] вода зачастую используется не только как охлаждающая жидкость, но и для изоляции огня от воздуха в составе [[Пена|пены]], так как горение поддерживается только при достаточном поступлении кислорода. |
|||
;В спорте |
|||
Многими видами спорта занимаются на водных поверхностях, на льду, на снегу и даже под водой. Это [[Подводный спорт|подводное плавание]], [[хоккей]], лодочные виды спорта, [[биатлон]], [[шорт-трек]] и др. |
Многими видами спорта занимаются на водных поверхностях, на льду, на снегу и даже под водой. Это [[Подводный спорт|подводное плавание]], [[хоккей]], лодочные виды спорта, [[биатлон]], [[шорт-трек]] и др. |
||
; |
|||
;В качестве Инструмента |
|||
[[Файл:WaterJetCutter-ru.svg|thumb| |
[[Файл:WaterJetCutter-ru.svg|thumb|520x520px|[[Гидроабразивная резка]]]] |
||
Вода используется как инструмент для разрыхления, раскалывания и даже резки пород и материалов. Она используется в [[добывающая промышленность|добывающей промышленности]], [[Горное дело|горном деле]] и в производстве. |
|||
Достаточно распространены установки по [[Водная резка|резке водой]] различных материалов: от резины до стали. Вода, выходящая под давлением несколько тысяч атмосфер способна разрезать стальную пластину толщиной несколько миллиметров, или более при [[гидроабразивная резка|добавлении]] [[абразив]]ных частиц. |
|||
=== Для смазки === |
|||
Вода применяется как [[смазочный материал]] для смазки [[подшипник]]ов из древесины, пластиков, текстолита, подшипников с резиновыми обкладками и др. Воду также используют в эмульсионных смазках<ref>{{книга |
Вода применяется как [[смазочный материал]] для смазки [[подшипник]]ов из древесины, пластиков, [[Текстолит|текстолита]], [[Подшипник|подшипников]] с резиновыми обкладками и др. Воду также используют в [[Эмульсионные краски|эмульсионных]] смазках<ref>{{книга |
||
|автор |
|автор = Воскресенский В. А., Дьяков В. И. |
||
|часть |
|часть = Глава 2. Смазочные вещества и их физико-химические свойства |
||
|заглавие |
|заглавие = Расчет и проектирование опор скольжения (жидкостная смазка): Справочник |
||
|издание |
|издание = |
||
|место |
|место = М. |
||
|издательство |
|издательство = [[Машиностроение (издательство)|Машиностроение]] |
||
|год |
|год = 1980 |
||
|страницы |
|страницы = 15 |
||
|страниц |
|страниц = |
||
|серия |
|серия = Библиотека конструктора |
||
|isbn |
|isbn = ББК 34.42, УДК 621.81.001.2 (031) |
||
|тираж |
|тираж = |
||
}}</ref>. |
}}</ref>. |
||
| Строка 385: | Строка 528: | ||
=== Происхождение воды на планете === |
=== Происхождение воды на планете === |
||
{{ |
{{главная|Происхождение воды на Земле}} |
||
Происхождение воды на Земле является предметом научных споров. Некоторые учёные считают, что вода была занесена астероидами или кометами на ранней стадии образования Земли, около четырёх миллиардов лет назад, когда планета уже сформировалась в виде шара. В |
Происхождение воды на Земле является предметом научных споров. Некоторые учёные{{кто}} считают, что вода была занесена астероидами или кометами на ранней стадии образования Земли, около четырёх миллиардов лет назад, когда планета уже сформировалась в виде шара. В 2010-е годы было установлено, что вода появилась в мантии Земли не позже 2,7 миллиардов лет назад<ref>{{Cite web|url=https://tass.ru/nauka/3165597|title=Ученые: вода появилась в мантии Земли 2,7 млрд лет назад|publisher=[[ТАСС]]|accessdate=2016-04-26|lang=ru|archive-date=2016-05-04|archive-url=https://web.archive.org/web/20160504072347/http://tass.ru/nauka/3165597|deadlink=no}}</ref>. |
||
=== Гидрология === |
=== Гидрология === |
||
{{ |
{{главная|Гидрология}} |
||
Гидроло́гия — |
Гидроло́гия — наука, изучающая природные воды, их взаимодействие с [[Атмосфера Земли|атмосферой]] и [[литосфера|литосферой]], а также явления и процессы, в них протекающие (испарение, замерзание и т. п.). |
||
Предметом изучения гидрологии являются все виды вод гидросферы в [[океан]]ах, [[море|морях]], [[река]]х, [[озеро|озёрах]], [[водохранилище|водохранилищах]], [[болото|болотах]], почвенных и [[Подземные воды|подземных |
Предметом изучения гидрологии являются все виды вод гидросферы в [[океан]]ах, [[море|морях]], [[река]]х, [[озеро|озёрах]], [[водохранилище|водохранилищах]], [[болото|болотах]], почвенных и [[Подземные воды|подземных водах]]. |
||
Также гидрология исследует [[круговорот воды в природе]], влияние на него деятельности человека и управление режимом водных объектов и водным режимом отдельных территорий; проводит анализ гидрологических элементов для отдельных территорий и Земли в целом; даёт оценку и прогноз состояния и рационального использования водных ресурсов; пользуется методами, применяемыми в географии физике и других науках. |
|||
Данные гидрологии моря используются при плавании и ведении боевых действий [[Военно-морской флот|надводными кораблями]] и [[Подводная лодка|подводными лодками]]. |
|||
Гидрология подразделяется на |
Гидрология подразделяется на океанологию, гидрологию суши и гидрогеологию: |
||
* [[Океанология]] подразделяется на [[биология океана|биологию океана]], химию океана, геологию океана, физическую океанологию, и взаимодействие океана и атмосферы. |
|||
* [[Гидрология суши]] подразделяется на [[гидрология рек|гидрологию рек]] (''речную гидрологию, потамологию''), [[озероведение|озероведение (лимнологию)]], [[болотоведение]], [[гляциология|гляциологию]]. |
|||
Океанология подразделяется на [[биология океана|биологию океана]], [[химия океана|химию океана]], [[геология океана|геологию океана]], [[физическая океанология|физическую океанологию]], и взаимодействие океана и атмосферы. |
|||
* [[Гидрогеология]] — наука, изучающая происхождение, условия залегания, состав и закономерности движений подземных вод. Также изучается взаимодействие подземных вод с горными породами, поверхностными водами и атмосферой. В сферу этой науки входят такие вопросы, как динамика подземных вод, гидрогеохимия, поиск и разведка подземных вод, а также мелиоративная и региональная гидрогеология. <!-- Гидрогеология тесно связана с гидрологией и геологией, в том числе и с инженерной геологией, метеорологией, геохимией, геофизикой и другими науками о Земле. Она опирается на данные математики, физики, химии и широко использует их методы исследования.--> Данные гидрогеологии используются, в частности, для решения вопросов водоснабжения, мелиорации и эксплуатации месторождений. |
|||
Гидрология суши подразделяется на [[гидрология рек|гидрологию рек]] (''речную гидрологию, потамологию''), [[озероведение|озероведение (лимнологию)]], [[болотоведение]], [[гляциология|гляциологию]]. |
|||
=== Гидрогеология === |
|||
{{Основная статья|Гидрогеология}} |
|||
Гидрогеоло́гия (от др.-греч. ὕδωρ «водность» + геология) — наука, изучающая происхождение, условия залегания, состав и закономерности движений подземных вод. Также изучается взаимодействие подземных вод с горными породами, поверхностными водами и атмосферой. |
|||
В сферу этой науки входят такие вопросы, как динамика подземных вод, гидрогеохимия, поиск и разведка подземных вод, а также мелиоративная и региональная гидрогеология. Гидрогеология тесно связана с гидрологией и геологией, в том числе и с инженерной геологией, метеорологией, геохимией, геофизикой и другими науками о Земле. Она опирается на данные математики, физики, химии и широко использует их методы исследования. |
|||
Данные гидрогеологии используются, в частности, для решения вопросов водоснабжения, мелиорации и эксплуатации месторождений. |
|||
== Факты == |
|||
* В среднем в [[организм]]е растений и животных содержится более 50 % воды<ref name="НТ.ЗПВ">[http://n-t.ru/ri/ar/zv01.htm Наука и техника. Книги. Загадки простой воды.]</ref>. |
|||
* В составе мантии Земли воды содержится в 10-12 раз больше, чем в Мировом океане<ref>[http://www.priroda.ru/lib/detail.php?ID=5546 Состав и природа мантии Земли]</ref>. |
|||
* При средней глубине в 3,6 км Мировой океан покрывает около 71 % поверхности планеты и содержит 97,6 % известных мировых запасов свободной воды. |
|||
* Если бы на Земле не было впадин и выпуклостей, вода покрыла бы всю Землю слоем толщиной 3 км<ref>[http://znaniya-sila.narod.ru/solarsis/zemlya/earth_04.htm Биосфера Земли]</ref>. |
|||
* Если бы все ледники растаяли, то уровень воды в земных океанах поднялся бы на 64 м и около 1/8 поверхности суши было бы затоплено водой<ref>[http://n-t.ru/ri/ar/zv01.htm Загадки простой воды]</ref>. |
|||
* Морская вода при обычной её солёности 35 ‰ замерзает при температуре −1,91 °C<ref>[http://www.tetis.ru/?p=uwabout&id=95 Дайвинг: статьи, каталог снаряжения, обучение, магазины, клубы и центры]</ref>. |
|||
* Иногда вода замерзает при положительной температуре<ref>Всеволод Арабаджи. [http://n-t.ru/ri/ar/zv01.htm Загадки простой воды.] 2001</ref>. |
|||
* При определённых условиях (внутри [[Углеродные нанотрубки|нанотрубок]]) молекулы воды образуют новое состояние, при котором они сохраняют способность течь даже при температурах, близких к [[Абсолютный нуль температуры|абсолютному нулю]]<ref>[http://www.sciencedaily.com/releases/2005/06/050605183843.htm Science Daily (англ.)]</ref>. |
|||
* Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света. |
|||
* Синий цвет чистой океанской воды в толстом слое объясняется избирательным поглощением и рассеянием света в воде. |
|||
* С помощью капель воды из кранов можно создать напряжение до 10 киловольт, опыт называется «[[Капельница Кельвина]]». |
|||
* Вода — это одно из немногих веществ в природе, которые расширяются при переходе из жидкой фазы в твёрдую (кроме воды, таким свойством обладают [[сурьма]]<ref name="Slovar2">{{статья|заглавие=Сурьма|издание=[[Энциклопедический словарь (Педагогика)|Энциклопедический словарь]] юного химика. 2-е изд.|ответственный=Сост. В. А. Крицман, В. В. Станцо|место={{М}}|издательство=[[Педагогика (издательство)|Педагогика]]|isbn=5-7155-0292-6|год=1990|страницы=235}}</ref>, [[висмут]], [[галлий]], [[германий]] и некоторые соединения и смеси). |
|||
* Вода и водяной пар горят в атмосфере [[фтор]]а фиолетовым пламенем. Смеси водяного пара со фтором в пределах взрывчатых концентраций взрывоопасны. В результате этой реакции образуются [[фтороводород]] и элементарный [[кислород]]. |
|||
== См. также == |
== См. также == |
||
{{Навигация |
{{Навигация |
||
|Викисловарь =вода |
|Викисловарь = вода |
||
|Викицитатник = Вода |
|Викицитатник = Вода |
||
|Викитека = Вода |
|Викитека = Вода |
||
|Тема = Вода |
|Тема = Вода |
||
}} |
}} |
||
* [[Гидрофобия|Аквафобия]] |
|||
{{кол|3}} |
|||
* [[Бутилированная вода]] |
|||
* [[Активность воды]] |
|||
* [[Гидроэнергетика]] |
|||
* [[Всемирный день водных ресурсов]] |
|||
* [[Горение водорода]] |
|||
* [[Влажность]] |
|||
* [[Жажда]] |
|||
* [[Загрязнение океанов]] |
|||
* [[Энергия волн океана]] |
|||
* [[Загрязнение пресных вод]] |
|||
* [[Эффект Мпембы]] |
|||
* [[Прозрачность воды]] |
|||
* [[Поверхность воды]] |
|||
* [[Очистка сточных вод]] |
|||
* [[Орошение]] |
|||
* [[Дигидрогена монооксид]] |
* [[Дигидрогена монооксид]] |
||
* [[Тяжёлая вода]] |
|||
* [[Роль воды в клетке]] |
|||
* [[Сверхтяжёлая вода|Сверхтяжëлая вода]] |
|||
* [[Кулер (аппарат)|Кулер]] |
|||
* [[Стихия (алхимия)]] |
|||
* [[Фазовая диаграмма воды]] |
|||
* [[Водный мостик (физика)]] |
|||
* [[Novec 1230|«Сухая» вода]] |
|||
* [[Питьевой режим]] {{конец}} |
|||
== Примечания == |
== Примечания == |
||
{{примечания |
{{примечания}} |
||
== Литература == |
== Литература == |
||
{{викифицировать книги}} |
{{викифицировать книги}} |
||
;на русском языке |
|||
* {{ВТ-ЭСБЕ|Вода}} |
|||
* ''Андреев В. Г.'' Влияние протонного обменного взаимодействия на строение молекулы воды и прочность водородной связи // Материалы V Международной конференции «Актуальные проблемы науки в России». — 2008. — Т. 3. — С. 58—62. |
|||
* {{Книга|заглавие=Вода|автор=Лосев К. С.|издательство=[[Гидрометеоиздат]]|год=1989|место=Л.|страниц=272}} |
|||
* {{Книга|заглавие=Загадки простой воды: в мире воды и льда |автор=[[Арабаджи, Всеволод Исидорович|Арабаджи В. И.]] |место=М. |издательство=[[Знание (издательство, Москва)|Знание]] |год=1973 |страниц=96 |ссылка=http://n-t.ru/ri/ar/zv.htm}} |
|||
* Гидробионты в самоочищении вод и биогенной миграции элементов. — М.: МАКС-Пресс. 2008. 200 с. Предисловие члена-корр. РАН [[Малахов, Владимир Васильевич|В. В. Малахова]]. (Серия: Наука. Образование. Инновации. Выпуск 9). ISBN 978-5-317-02625-7. |
|||
* Гидробионты в самоочищении вод и биогенной миграции элементов. — М.: МАКС-Пресс. 2008. — 200 с. — ISBN 978-5-317-02625-7. |
|||
* О некоторых вопросах поддержания качества воды и её самоочищения // [[Водные ресурсы]]. 2005. т. 32. № 3. С. 337—347. |
|||
* {{книга|автор=[[Кульский, Леонид Адольфович|Кульский Л. А.]], Даль В. В., Ленчина Л. Г. |заглавие=Вода знакомая и загадочная |место=Киев |издательство=Радянська школа |год=1982 |страниц=120 |ссылка=http://n-t.ru/ri/kl/vz.htm}} |
|||
* Андреев В. Г. Влияние протонного обменного взаимодействия на строение молекулы воды и прочность водородной связи. Материалы V Международной конференции «Актуальные проблемы науки в России». — Кузнецк 2008, т.3 С. 58-62. |
|||
* {{книга |автор=[[Лосев, Ким Семёнович|Лосев К. С.]] |часть= |ссылка часть= |заглавие=Вода |оригинал= |ссылка=https://search.rsl.ru/ru/record/01001477133 |ответственный=Рец. А. А. Соколов |издание= |место=Л. |издательство=[[Гидрометеоиздат]] |год=1989 |страниц=272 |серия= |isbn=5-286-00161-0 |тираж=113000 |ref=Лосев}} |
|||
<!-- ; Дополнительное чтение--> |
|||
* {{статья|автор=[[Мельник, Александр Гаврилович|Мельник А. Г.]]|ссылка=https://www.academia.edu/36592682|заглавие=Вода в христианских сакральных практиках Древней Руси конца X-XVII веков|издание=Святая вода в иеротопии и иконографии христианского мира / ред.-сост. А.М. Лидов|издательство=ООО "Феория"||год=2017|место=М.|страницы=496—520|isbn=978-5-91796-061-6}} |
|||
* {{Книга|заглавие=Загадки простой воды : в мире воды и льда|автор=В. И. Арабаджи|место=М.|издательство=[[Знание (издательство, Москва)|Знание]]|год=1973|страниц=96|ссылка=http://n-t.ru/ri/ar/zv.htm}} |
|||
* О некоторых вопросах поддержания качества воды и её самоочищения // [[Водные ресурсы]]. — 2005. — Т. 32. — № 3. — С. 337—347. |
|||
* {{книга|автор=Л. А. Кульский, В. В. Даль, Л. Г. Ленчина|заглавие=Вода знакомая и загадочная|место=Киев|издательство=Радянська школа|год=1982|страниц=120|ссылка=http://n-t.ru/ri/kl/vz.htm}} |
|||
* {{книга|автор = |заглавие =Рекомендации по межгосударственной стандартизации РМГ 75-2014. Государственная система обеспечения единства измерений. Измерения влажности веществ. Термины и определения |ссылка= http://files.stroyinf.ru/Data2/1/4293768/4293768559.pdf |издание = |издательство =Стандартинформ |год =2015 |место =М. |страниц =iv + 16 |isbn = |ref =rmg}} |
|||
* * {{cite journal| doi = 10.1016/S0032-0633(02)00145-9| last = Encrenaz, Thérèse| date=February 2003 | title = ISO observations of the giant planets and Titan: what have we learnt?| journal = Planetary and Space Science| volume = 51| issue = 2| pages = 89–103| bibcode = 2003P&SS...51...89E| ref = Encrenaz, 2003}} |
|||
* {{книга |автор=Черняев А.М.|заглавие=Самый удивительный минерал. Что мы знаем о воде|nodot= |язык=ru |ответственный= |ссылка= |место=Свердловск|издательство=Средне-Уральское книжное издательство|год=1980|том= |страниц=192|страницы= |isbn= |ref=Черняев}} |
|||
* {{ВТ-ЭСБЕ|Вода|[[Яковлев, Владимир Анатольевич (химик)|Яковлев В. А.]]}} |
|||
== Ссылки == |
|||
;на других языках |
|||
* [http://www.priroda.su/item/324 Водные ресурсы России и мира.] |
|||
* {{cite book |last1=Ball |first1=Philip |title=Life's matrix : a biography of water |url=https://archive.org/details/lifesmatrixbiogr0000ball |date=2001 |publisher=Farrar, Straus, and Giroux |isbn=978-0-520-23008-8 |edition=}} |
|||
* [http://www.membrana.ru/particle/13641 Впервые созданы пятиугольные кристаллы льда.] // [[Мембрана (веб-сайт)|Мембрана]] |
|||
* {{cite book |last1=Franks |first1=Felix |title=Water : a matrix of life |date=2007 |publisher=Royal Society of Chemistry |isbn=978-1-84755-234-1 |edition=2nd}} |
|||
* [http://www.dpva.ru/Guide/GuideMedias/GuideWater/ Вода, лед и снег — физические, химические свойства.] |
|||
* {{Cite book|url=https://books.google.com/books?id=kTnxSi2B2FcC|title=CRC Handbook of Chemistry and Physics|edition=84th|last=Lide|first=David R.|date=2003|series=[[CRC Handbook]]|publisher=CRC Press|isbn=978-0-8493-0484-2|language=en|access-date=2023-12-14|archive-date=2024-02-04|archive-url=https://web.archive.org/web/20240204075307/https://books.google.com/books?id=kTnxSi2B2FcC|url-status=live}} |
|||
* {{cite book|first1=Hermann|last1=Weingärtner|first2=Ilka|last2=Teermann|first3=Ulrich|last3=Borchers|first4=Peter|last4=Balsaa|first5=Holger V.|last5=Lutze|first6=Torsten C.|last6=Schmidt|first7=Ernst Ulrich|last7=Franck|first8=Gabriele|last8=Wiegand|first9=Nicolaus|last9=Dahmen|first10=Georg|last10=Schwedt|first11=Fritz H.|last11=Frimmel|first12=Birgit C.|last12=Gordalla|chapter=Water, 1. Properties, Analysis, and Hydrological Cycle|title = Ullmann's Encyclopedia of Industrial Chemistry|publisher=Wiley-VCH Verlag GmbH & Co. KGaA|isbn=978-3-527-30673-2|doi=10.1002/14356007.a28_001.pub3|year = 2016|ref = {{harvid|Weingärtner et al.|2016}}|title-link=Ullmann's Encyclopedia of Industrial Chemistry}} |
|||
;Справочные материалы |
|||
* {{статья|issn=|doi=10.1016/S0032-0633(02)00145-9|заглавие=ISO observations of the giant planets and Titan: what have we learnt?|издание=[[Planetary and Space Science]]|число=|том=51|номер=2|страницы=89—103|bibcode=2003P&SS...51...89E|ссылка=|ref=Encrenaz|язык=en|тип=journal|автор=Encrenaz, Thérèse|месяц=2|год=2003|nodot=1}} |
|||
* [http://twt.mpei.ac.ru/ochkov/WSPHB/index.html Теплофизические свойства воды и водяного пара.] |
|||
* [http://www.lsbu.ac.uk/water/phase.html Диаграмма фазовых состояний.]{{ref-en}} |
|||
* [http://nospe.ucoz.ru/index/0-86 Основы геологии.] — Геологическая работа текучих вод. |
|||
{{Снег и лёд}} |
|||
{{ВС}} |
{{ВС}} |
||
{{Вода}} |
|||
{{Бинарные соединения водорода}} |
|||
[[Категория:Вода| ]] |
[[Категория:Вода| ]] |
||
| Строка 485: | Строка 598: | ||
[[Категория:Оксиды]] |
[[Категория:Оксиды]] |
||
[[Категория:Соединения кислорода]] |
[[Категория:Соединения кислорода]] |
||
[[Категория:Халькогеноводороды]] |
|||
Текущая версия от 09:30, 13 декабря 2024
| Вода | ||||
|---|---|---|---|---|
| ||||
| ||||
| Общие | ||||
| Систематическое наименование |
Оксид водорода Вода[1] |
|||
| Традиционные названия | вода | |||
| Хим. формула | H2O | |||
| Физические свойства | ||||
| Состояние | жидкость | |||
| Молярная масса | 18,01528 г/моль | |||
| Плотность | 1 г/см3[2] | |||
| Твёрдость | 1,5[6] | |||
| Динамическая вязкость | 0,00101 Па·с | |||
| Кинематическая вязкость |
0,01012 см²/с (при 20 °C) |
|||
| Энергия ионизации | 12,61 эВ[7] | |||
| Скорость звука в веществе |
(дистиллированная вода) 1348 м/с |
|||
| Термические свойства | ||||
| Температура | ||||
| • плавления | 273,1 K (0 ° C) | |||
| • кипения | 373,1 K; 99,974 °C | |||
| • разложения | при 2200 °C разлагаются 3% молекул | |||
| Тройная точка | 273,2 K (0,01 ° C), 611,72 Па | |||
| Критическая точка | 647,1 K (374 ° C), 22,064 МПа | |||
| Мол. теплоёмк. | 75,37 Дж/(моль·К) | |||
| Теплопроводность | 0,56 Вт/(м·K) | |||
| Энтальпия | ||||
| • образования | −285,83 кДж/моль | |||
| • кипения | 40,656 кДж/моль[3] и 40 655,928 Дж/моль[4] | |||
| Удельная теплота испарения | 2256,2 кДж/кг[5] | |||
| Удельная теплота плавления | 332,4 кДж/кг[5] | |||
| Химические свойства | ||||
| Константа диссоциации кислоты | 15,74 | |||
| Диэлектрическая проницаемость |
80,4 (20 ° C) 78,5 (25 ° C) |
|||
| Оптические свойства | ||||
| Показатель преломления | 1,3945, 1,33432, 1,32612, 1,39336, 1,33298 и 1,32524 | |||
| Структура | ||||
| Дипольный момент | 6,2E−30 Кл·м[7] | |||
| Классификация | ||||
| Рег. номер CAS | 7732-18-5 | |||
| PubChem | 962 и 22247451 | |||
| Рег. номер EINECS | 231-791-2 | |||
| SMILES | ||||
| InChI | ||||
| RTECS | ZC0110000 | |||
| ChEBI | 15377 | |||
| ChemSpider | 937 | |||
| Безопасность | ||||
| NFPA 704 | ||||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||||
Вода́ (в химии — монооксид водорода, гидроксид водорода; химическая формула — H2O) — химическое вещество, представляющее собой бинарное неорганическое соединение, молекула которого состоит из двух атомов водорода и одного атома кислорода, соединённых между собой ковалентной связью. Вода является продуктом горения (окисления) водорода при реакции с кислородом, но также может выступать конечным результатом и иных химических реакций, таких как горение углеводородов и других органических соединений.
При нормальных условиях вода представляет собой прозрачную жидкость, не имеющую цвета (при малой толщине слоя), запаха и вкуса. При переходе в твёрдое агрегатное состояние вода преобразуется в лёд (кристаллы льда могут образовывать снег или иней), а в газообразное — в водяной пар. Вода также может существовать в виде жидких кристаллов (на гидрофильных поверхностях)[8][9]. Она совершенно не токсична и безопасна для здоровья человека по причине стабильности вещества и негорючести воды (невосприимчивость к горению, наподобие углекислого газа).
Вода является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Исключительно важна роль воды в глобальном кругообороте вещества и энергии[10], возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Она является важнейшим веществом для всех живых существ на Земле[11]. В среднем, в организме растений и животных содержится более 50 % воды[12].
Всего на Земле около 1400 млн км³ воды; она покрывает 71 % поверхности земного шара (океаны, моря, озёра, реки, льды — 361,13 млн км²[13][14]). Бо́льшая часть земной воды (97,54 %) принадлежит Мировому океану — это солёная вода, непригодная для сельского хозяйства и питья. Пресная же вода находится в основном в ледниках (1,81 %) и подземных водах (около 0,63 %), и лишь небольшая часть (0,009 %) — в реках и озёрах. Материковые солёные воды составляют 0,007 %, в атмосфере содержится 0,001 % от всей воды планеты Земля[15][16]. В составе мантии Земли воды содержится в 10—12 раз больше, чем в Мировом океане[17].
Вода — это одно из немногих веществ в природе, которые расширяются при переходе из жидкой фазы в твёрдую (кроме воды, таким свойством обладают сурьма[18], висмут, галлий, германий и некоторые соединения и смеси).
Этимология
[править | править код]В письменных источниках слово «вода» встречается ещё в «Изборнике Святослава» (1076 год)[19].
Слово происходит от др.-русск. вода, далее — от праславянского *voda[20] (ср. ст.-слав. вода, болг. вода́, сербохорв. во̀да, словен. vóda, чеш. voda, слвц. voda, польск. woda, в.-луж., н.-луж. woda), затем — от праиндоевропейского *wed-, родственного лит. vanduõ, жем. unduo, д.-в.-н. waʒʒar «вода», гот. watō, англ. water, греч. ὕδωρ, ὕδατος, арм. գետ «река», фриг. βέδυ, др.-инд. udakám, uda-, udán- «вода», unátti «бить ключом», «орошать», ṓdman- «поток», алб. uj «вода»[21][22]. Русские слова «ведро», «выдра» имеют тот же корень.
В рамках необщепринятой гипотезы о существовании некогда праностратического языка слово может сравниваться с гипотетическим прауральским *wete (ср., например, фин. vesi, эст. vesi, коми va, венг. víz), а также с предполагаемыми праалтайскими, прадравидийским и прочими словами, и реконструироваться как *wetV для праязыка[23].
Химические названия
[править | править код]С формальной точки зрения вода имеет несколько различных корректных химических названий:
- оксид водорода: бинарное соединение водорода с атомом кислорода в степени окисления −2, встречается также устаревшее название «окись водорода»;
- гидроксид водорода: соединение гидроксильной группы OH− и катиона (H+);
- гидроксильная кислота: воду можно рассматривать как соединение катиона H+, который может быть замещён металлом, и «гидроксильного остатка» OH−;
- монооксид дигидрогена;
- дигидромонооксид,
Свойства
[править | править код]Физические свойства
[править | править код]Вода при нормальных условиях находится в жидком состоянии, тогда как аналогичные водородные соединения других элементов являются газами (H2S, CH4, HF). Атомы водорода присоединены к атому кислорода, образуя угол 104,45° (104°27′). Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По этой причине молекула воды обладает большим дипольным моментом (p = 1,84 Д, уступает только синильной кислоте и диметилсульфоксиду). Каждая молекула воды образует до четырёх водородных связей — две из них образует атом кислорода и две — атомы водорода[24]. Количество водородных связей и их разветвлённая структура определяют высокую температуру кипения воды и её удельную теплоту парообразования[24]. Если бы не было водородных связей, вода, на основании места кислорода в таблице Менделеева и температур кипения гидридов аналогичных кислороду элементов (серы, селена, теллура), кипела бы при −80 °C, а замерзала при −100 °C[25].
При переходе в твёрдое состояние молекулы воды упорядочиваются, при этом объёмы пустот между молекулами увеличиваются, и общая плотность воды падает, что и объясняет меньшую плотность (больший объём) воды в фазе льда. При испарении, напротив, все водородные связи рвутся. Разрыв связей требует много энергии, отчего у воды самая большая удельная теплоёмкость среди прочих жидкостей и твёрдых веществ. Для того чтобы нагреть один килограмм воды на один градус, требуется затратить 4,1868 кДж энергии. Благодаря этому свойству вода нередко используется как теплоноситель.
Помимо большой удельной теплоёмкости, вода также имеет большие значения удельной теплоты плавления (333,55 кДж/кг при 0 °C) и парообразования (2250 кДж/кг).
| Температура, °С | Удельная теплоёмкость воды, кДж/(кг*К) |
|---|---|
| −60 (лёд) | 1,64 |
| −20 (лёд) | 2,01 |
| −10 (лёд) | 2,22 |
| 0 (лёд) | 2,11 |
| 0 (чистая вода) | 4,218 |
| 10 | 4,192 |
| 20 | 4,182 |
| 40 | 4,178 |
| 60 | 4,184 |
| 80 | 4,196 |
| 100 | 4,216 |
Физические свойства разных изотопных модификаций воды при различных температурах[26]:
| Модификация воды | Максимальная плотность при температуре, °С | Тройная точка при температуре, °С |
|---|---|---|
| Н2O | 3,9834 | 0,01 |
| D2O | 11,2 | 3,82 |
| T2O | 13,4 | 4,49 |
| Н218O | 4,3 | 0,31 |
Вода является хорошим растворителем веществ с молекулами, обладающими электрическим дипольным моментом. При растворении молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды важно для живых существ. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде[27]. Вода необходима для жизни всех без исключения живых существ на Земле.
Вода обладает отрицательным электрическим потенциалом поверхности[уточнить].

Чистая вода — хороший изолятор. При нормальных условиях вода слабо диссоциирована на ионы и концентрация протонов (точнее, ионов гидроксония H3O+) и гидроксильных ионов OH− составляет 10−7 моль/л. Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные вещества, например, соли, то есть в растворе присутствуют другие положительные и отрицательные ионы. Поэтому обычная вода хорошо проводит электрический ток. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, чем обусловлен нагрев пищевых продуктов в микроволновой печи.
Агрегатные состояния
[править | править код]
По состоянию различают:
- «твёрдое» — лёд
- «жидкое» — вода
- «газообразное» — водяной пар

При нормальном атмосферном давлении (760 мм рт. ст., 101 325 Па) вода переходит в твёрдое состояние при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C (значения 0 °C и 100 °C были выбраны как соответствующие температурам таяния льда и кипения воды при создании температурной шкалы «по Цельсию»). При снижении давления температура таяния (плавления) льда медленно растёт, а температура кипения воды — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такие давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки (сублимации) льда падает со снижением давления. При высоком давлении существуют модификации льда с температурами плавления выше комнатной.
С ростом давления температура кипения воды растёт[28]:
| Давление, атм. | Температура кипения (Ткип), °C |
|---|---|
| 0,987 (105 Па — нормальные условия) | 99,63 |
| 1 | 100 |
| 2 | 120 |
| 6 | 158 |
| 218,5 | 374,1 |
При росте давления плотность насыщенного водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении и/или температуре исчезает разница между жидкой водой и водяным паром. Такое агрегатное состояние называют «сверхкритическая жидкость».
Вода может находиться в метастабильных состояниях — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, можно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Также вода может существовать в виде двух разных жидкостей («вторая вода» возникает при температуре около −70 °C и давлении в тысячи атмосфер), которые при определённых условиях даже не смешиваются друг с другом; гипотеза, что вода может существовать в двух различных жидких состояниях, была предложена примерно 30 лет назад на основе результатов компьютерного моделирования и экспериментально проверена только в 2020 г[29].
Удельная теплоёмкость
[править | править код]| t, °С | 0 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 | 55 | 60 | 65 | 70 | 75 | 80 | 85 | 90 | 95 | 100 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Cp, Дж/(кг·град) | 4217 | 4191 | 4187 | 4183 | 4179 | 4174 | 4174 | 4174 | 4177 | 4181 | 4182 | 4182 | 4185 | 4187 | 4191 | 4195 | 4202 | 4208 | 4214 | 4220 |
Эти данные можно аппроксимировать эмпирической формулой:
- [31].

Статическая (для постоянного электростатического поля) диэлектрическая проницаемость воды при разной абсолютной температуре при давлении 1 бар в диапазоне температур −13…100 °C выражается эмпирической формулой[33]:
Результаты вычислений по этой формуле[34]:
| T, K | 260 | 273 | 283 | 293 | 298 | 303 | 313 | 323 | 333 | 343 | 353 | 363 | 373 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| −13 | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 | |
| 93,41 | 87,99 | 84,08 | 80,32 | 78,5 | 76,71 | 73,25 | 69,94 | 66,78 | 63,78 | 60,92 | 58,21 | 55,66 |
Оптические свойства
[править | править код]Они оцениваются по прозрачности воды, которая, в свою очередь, зависит от длины волны излучения, проходящего через воду. Вследствие поглощения оранжевых и красных компонентов света вода приобретает голубоватую окраску. Вода прозрачна только для видимого света и сильно поглощает инфракрасное излучение, поэтому на инфракрасных фотографиях водная поверхность всегда получается чёрной. Ультрафиолетовые лучи легко проходят через воду, поэтому растительные организмы способны развиваться в толще воды и на дне водоёмов, инфракрасные лучи проникают только в поверхностный слой. Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света[35][36].
Изотопные модификации
[править | править код]И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов водорода, входящих в молекулу, выделяют следующие виды воды:
- лёгкая вода (основная составляющая привычной людям воды) ;
- тяжёлая вода (дейтериевая) ;
- сверхтяжёлая вода (тритиевая) ;
- тритий-дейтериевая вода ;
- тритий-протиевая вода ;
- дейтерий-протиевая вода .
Последние три вида возможны, так как молекула воды содержит два атома водорода. Протий — самый лёгкий изотоп водорода, дейтерий имеет атомную массу 2,0141017778 а. е. м., тритий — самый тяжёлый, атомная масса 3,0160492777 а. е. м. В воде из-под крана тяжелокислородной воды ( и ) содержится больше, чем воды : их содержание, соответственно, 1,8 кг и 0,15 кг на тонну[25].
Хотя тяжёлая вода часто считается мёртвой водой, так как живые организмы в ней жить не могут, некоторые микроорганизмы могут быть приучены к существованию в ней[25].
По стабильным изотопам кислорода , и существуют три разновидности молекул воды. Таким образом, по изотопному составу существуют 18 разновидностей молекул воды. В действительности природная вода содержит все разновидности молекул.
Химические свойства
[править | править код]Вода является наиболее распространённым растворителем на планете Земля, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ.
Воду иногда рассматривают как амфолит — и кислоту и основание одновременно (катион H+ анион OH−). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa = p(1,8⋅10−16) ≈ 15,74. Вода — химически активное вещество. Сильно полярные молекулы воды сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.
Воду можно получать:
- В ходе реакций —
- В ходе реакций нейтрализации —
- Восстановлением водородом оксидов металлов —
Под воздействием очень высоких температур или электрического тока (при электролизе)[37], а также под воздействием ионизирующего излучения, как установил в 1902 году[38] Фридрих Гизель[англ.] при исследовании водного раствора бромида радия[39], вода разлагается на молекулярный кислород и молекулярный водород:
Вода реагирует при комнатной температуре:
- со фтором и межгалоидными соединениями
- (при низких температурах)
- с солями, образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз
- с ангидридами и галогенангидридами карбоновых и неорганических кислот
- с активными металлорганическими соединениями (диэтилцинк, реактивы Гриньяра, метилнатрий и т. д.)
- с карбидами, нитридами, фосфидами, силицидами, гидридами активных металлов (кальция, натрия, лития и др.)
- со многими солями, образуя гидраты
- с боранами, силанами
- с кетенами, недоокисью углерода
- с фторидами благородных газов
Вода реагирует при нагревании:
- с углём, метаном
- с некоторыми алкилгалогенидами
Вода реагирует в присутствии катализатора:
- с амидами, эфирами карбоновых кислот
- с ацетиленом и другими алкинами
- с алкенами
- с нитрилами
Волновая функция основного состояния воды
[править | править код]В разделе не хватает ссылок на источники (см. рекомендации по поиску). |
В валентном приближении электронная конфигурация молекулы в основном состоянии: Молекула имеет замкнутую оболочку, неспаренных электронов нет. Заняты электронами четыре молекулярные орбитали (МО) — по два электрона на каждой МО , один со спином , другой со спином , или 8 спин-орбиталей . Волновая функция молекулы, , представленная единственным детерминантом Слэтера Ф, имеет вид
Симметрия этой волновой функции определяется прямым произведением НП, по которым преобразуются все занятые спин-орбитали
Принимая во внимание, что прямое произведение невырожденного НП самого на себя является полносимметричным НП и прямое произведение любого невырожденного представления Г на полносимметричное есть Г, получаем:

Виды
[править | править код]Вода на Земле может существовать в трёх основных состояниях:
- твёрдом
- жидком
- газообразном
Вода может приобретать различные формы, которые могут одновременно соседствовать и взаимодействовать друг с другом:
- водяной пар и облака в небе;
- морская вода и айсберги;
- ледники и реки на поверхности земли;
- водоносные слои в земле.
Вода способна растворять в себе множество органических и неорганических веществ. Из-за важности воды как источника жизни, её нередко подразделяют на типы по различным принципам.
Виды воды по особенностям происхождения, состава или применения.
- По содержанию катионов кальция и магния:
- По изотопам водорода в молекуле:
- лёгкая вода (по составу почти соответствует обычной)
- тяжёлая вода (дейтериевая)
- сверхтяжёлая вода (тритиевая)
- Другие виды:
- пресная вода
- дождевая вода
- морская вода
- подземные воды
- минеральная вода
- солоноватая вода
- питьевая вода и водопроводная вода
- дистиллированная вода и деионизированная вода
- сточные воды
- ливневая вода или поверхностные воды
- апирогенная вода
- поливода
- структурированная вода — термин, применяемый в неакадемических теориях
- талая вода
- мёртвая вода и живая вода — виды воды со сказочными свойствами
Вода, входящая в состав другого вещества и связанная с ним физическими связями, называется влагой. В зависимости от вида связи, выделяют:
- сорбционную, капиллярную и осмотическую влагу в твёрдых веществах,
- растворённую и эмульсионную влагу в жидкостях,
- водяной пар или туман в газах.
Вещество, содержащее влагу, называют влажным веществом. Влажное вещество, не способное более сорбировать (поглощать) влагу, — насыщенное влагой вещество.
Вещество, в котором содержание влаги пренебрежимо мало при данном конкретном применении, называют сухим веществом. Гипотетическое вещество, совершенно не содержащее влагу, — абсолютно сухое вещество. Сухое вещество, составляющее основу данного влажного вещества, называют сухой частью влажного вещества.
Смесь газа с водяным паром носит название влажный газ (парогазовая смесь — устаревшее название)[40].

В природе
[править | править код]В атмосфере нашей планеты вода находится в виде капель малого размера, в облаках и тумане, а также в виде пара. При конденсации выводится из атмосферы в виде атмосферных осадков (дождь, снег, град, роса). В совокупности жидкая водная оболочка Земли называется гидросферой, а твёрдая — криосферой. Вода является важнейшим веществом всех живых организмов на Земле. Предположительно, зарождение жизни на Земле произошло в водной среде.
Мировой океан содержит более 97,54 % земной воды, ледники — 1,81 %, подземные воды — около 0,63 %, реки и озёра — 0,009 %, материковые солёные воды — 0,007 %, атмосфера — 0,001 %[14].
Атмосферные осадки
[править | править код]Этот раздел статьи ещё не написан. |
Вода за пределами Земли
[править | править код]Вода — чрезвычайно распространённое вещество в космосе, однако из-за высокого внутрижидкостного давления вода не может существовать в жидком состоянии в условиях вакуума космоса, отчего она представлена только в виде пара или льда.
Одним из наиболее важных вопросов, связанных с освоением космоса человеком и возможности возникновения жизни на других планетах, является вопрос о наличии воды за пределами Земли в достаточно большой концентрации. Известно, что некоторые кометы более, чем на 50 % состоят из водяного льда. Не любая водная среда, однако, пригодна для жизни.
В результате бомбардировки лунного кратера, проведённой 9 октября 2009 года НАСА с использованием космического аппарата LCROSS, впервые были получены достоверные свидетельства наличия на спутнике Земли водяного льда в больших объёмах[42].
Вода широко распространена в Солнечной системе. Наличие воды (в основном в виде льда) подтверждено на многих спутниках Юпитера и Сатурна: Энцеладе[43][44], Тефии, Европе, Ганимеде и др. Вода присутствует в составе всех комет и многих астероидов. Учёными предполагается, что многие транснептуновые объекты имеют в своём составе воду.
Вода в виде паров содержится в атмосфере Солнца (следы)[45], атмосферах Меркурия (3,4 %, также большие количества воды обнаружены в экзосфере Меркурия)[46], Венеры (0,002 %)[47], Луны[48], Марса (0,03 %)[49], Юпитера (0,0004 %)[50], Европы[51], Сатурн, Урана (следы)[52] и Нептуна[53] (найден в нижних слоях атмосферы).
Содержание водяного пара в атмосфере Земли у поверхности колеблется от 3—4 % в тропиках и до 2·10−5% в Антарктиде[54].
Кроме того, вода обнаружена на экзопланетах, например HD 189733 A b[55], HD 209458 b[56] и GJ 1214 b[57].
Жидкая вода, предположительно, имеется под поверхностью некоторых спутников планет — наиболее вероятно, на Европе — спутнике Юпитера.
Биологическая роль
[править | править код]
Вода играет уникальную роль как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений.
Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.
Поскольку у льда плотность меньше, чем у жидкой воды, вода в водоёмах замерзает сверху, а не снизу. Образовавшийся слой льда препятствует дальнейшему промерзанию водоёма, это позволяет его обитателям выжить. Существует и другая точка зрения: если бы вода не расширялась при замерзании, то не разрушались бы клеточные структуры, соответственно замораживание не наносило бы ущерба живым организмам. Некоторые существа (тритоны) переносят замораживание/оттаивание — считается, что этому способствует особый состав клеточной плазмы, не расширяющейся при замораживании.
Применение
[править | править код]В земледелии
[править | править код]Выращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды на ирригацию.
Для питья и приготовления пищи
[править | править код]
Живое человеческое тело содержит от 50 % до 75 % воды[58], в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. В зависимости от температуры и влажности окружающей среды, физической активности и т. д. человеку нужно выпивать разное количество воды; ведётся много споров о том, сколько воды нужно потреблять для оптимального функционирования организма.
Питьевая вода представляет собой воду из какого-либо источника, очищенную от микроорганизмов и вредных примесей. Пригодность воды для питья при её обеззараживании перед подачей в водопровод оценивается по количеству кишечных палочек на литр воды, поскольку кишечные палочки распространены и достаточно устойчивы к антибактериальным средствам, и если кишечных палочек будет мало, то будет мало и других микробов. Если кишечных палочек не больше, чем 3 на литр, вода считается пригодной для питья[59][60].

В спорте
[править | править код]Многими видами спорта занимаются на водных поверхностях, на льду, на снегу и даже под водой. Это подводное плавание, хоккей, лодочные виды спорта, биатлон, шорт-трек и др.

Для смазки
[править | править код]Вода применяется как смазочный материал для смазки подшипников из древесины, пластиков, текстолита, подшипников с резиновыми обкладками и др. Воду также используют в эмульсионных смазках[61].
Исследования
[править | править код]Происхождение воды на планете
[править | править код]Происхождение воды на Земле является предметом научных споров. Некоторые учёные[кто?] считают, что вода была занесена астероидами или кометами на ранней стадии образования Земли, около четырёх миллиардов лет назад, когда планета уже сформировалась в виде шара. В 2010-е годы было установлено, что вода появилась в мантии Земли не позже 2,7 миллиардов лет назад[62].
Гидрология
[править | править код]Гидроло́гия — наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.).
Предметом изучения гидрологии являются все виды вод гидросферы в океанах, морях, реках, озёрах, водохранилищах, болотах, почвенных и подземных водах.
Также гидрология исследует круговорот воды в природе, влияние на него деятельности человека и управление режимом водных объектов и водным режимом отдельных территорий; проводит анализ гидрологических элементов для отдельных территорий и Земли в целом; даёт оценку и прогноз состояния и рационального использования водных ресурсов; пользуется методами, применяемыми в географии физике и других науках. Данные гидрологии моря используются при плавании и ведении боевых действий надводными кораблями и подводными лодками.
Гидрология подразделяется на океанологию, гидрологию суши и гидрогеологию:
- Океанология подразделяется на биологию океана, химию океана, геологию океана, физическую океанологию, и взаимодействие океана и атмосферы.
- Гидрология суши подразделяется на гидрологию рек (речную гидрологию, потамологию), озероведение (лимнологию), болотоведение, гляциологию.
- Гидрогеология — наука, изучающая происхождение, условия залегания, состав и закономерности движений подземных вод. Также изучается взаимодействие подземных вод с горными породами, поверхностными водами и атмосферой. В сферу этой науки входят такие вопросы, как динамика подземных вод, гидрогеохимия, поиск и разведка подземных вод, а также мелиоративная и региональная гидрогеология. Данные гидрогеологии используются, в частности, для решения вопросов водоснабжения, мелиорации и эксплуатации месторождений.
См. также
[править | править код]- Аквафобия
- Бутилированная вода
- Гидроэнергетика
- Горение водорода
- Жажда
- Энергия волн океана
- Эффект Мпембы
- Дигидрогена монооксид
- Тяжёлая вода
- Сверхтяжëлая вода
Примечания
[править | править код]- ↑ англ. International Union of Pure and Applied Chemistry. Nomenclature of Inorganic Chemistry. IUPAC RECOMMENDATIONS 2005. RSC Publishing, 2005. — p. 306.
- ↑ Riddick, John (1970). Organic Solvents Physical Properties and Methods of Purification. Techniques of Chemistry. Wiley-Interscience. ISBN 0471927260.
- ↑ Atmospheric Thermodynamics: Elementary Physics and Chemistry — Издательство Кембриджского университета, 2009. — С. 64. — ISBN 9780521899635
- ↑ PubChem (англ.)
- ↑ 1 2 Маленков Г. Г. Вода // Физическая энциклопедия. — М.: Советская энциклопедия, 1988. — Т. I. Ааронова — Бома эффект — Длинные линии. — С. 294—297. Архивировано 18 августа 2016 года.
- ↑ Петрушевский Ф. Ф., Гершун А. Л. Лед, в физике // Энциклопедический словарь — СПб.: Брокгауз — Ефрон, 1896. — Т. XVII. — С. 471—473.
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Henniker, J. C. The Depth of the Surface Zone of a Liquid (англ.) // Reviews of Modern Physics : journal. — Reviews of Modern Physics, 1949. — Vol. 21, no. 2. — P. 322—341. — ISSN 0034-6861. — doi:10.1103/RevModPhys.21.322.
- ↑ Pollack, Gerald. Water Science. University of Washington, Pollack Laboratory. — «Water has three phases – gas, liquid, and solid; but recent findings from our laboratory imply the presence of a surprisingly extensive fourth phase that occurs at interfaces.» Дата обращения: 5 февраля 2011. Архивировано 15 февраля 2013 года.
- ↑ Криволуцкий А. Е. Голубая планета. Земля среди планет. Географический аспект. — М.: Мысль, 1985. — С. 212.
- ↑ [[United Nations]]. Un.org (22 марта 2005). Дата обращения: 25 июля 2010. Архивировано 15 февраля 2013 года.
- ↑ Наука и техника. Книги. Загадки простой воды. Дата обращения: 27 августа 2008. Архивировано 22 января 2009 года.
- ↑ CIA- The world fact book. Central Intelligence Agency. Дата обращения: 20 декабря 2008. Архивировано из оригинала 5 января 2010 года.
- ↑ 1 2 Marine Science: An Illustrated Guide to Science
- ↑ Gleick, P.H. Water in Crisis: A Guide to the World's Freshwater Resources (англ.). — Oxford University Press, 1993. Архивировано 5 марта 2016 года.
- ↑ Water Vapor in the Climate System (англ.). American Geophysical Union. Дата обращения: 13 февраля 2013. Архивировано 15 февраля 2013 года.
- ↑ Состав и природа мантии Земли. Дата обращения: 6 апреля 2011. Архивировано 2 ноября 2011 года.
- ↑ Сурьма // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. — С. 235. — ISBN 5-7155-0292-6.
- ↑ Вода // Словарь русского языка XI—XVII веков. Вып. 2 / Академия наук СССР, Институт русского языка; ред. колл., гл. ред. С. Г. Бархударов. — М.: Наука, 1975. — С. 249. — 16 500 экз. Архивировано 16 февраля 2023 года.
- ↑ Derksen, Rick. Etymological Dictionary of the Slavic Inherited Lexicon
- ↑ М. Фасмер. Этимологический словарь русского языка. Вода
- ↑ Online Etymology Dictionary. Water. Дата обращения: 9 ноября 2019. Архивировано 9 июля 2019 года.
- ↑ «Ностратическая этимология» (база данных). Дата обращения: 8 сентября 2020. Архивировано 18 января 2021 года.
- ↑ 1 2 Ларионов А. К. Занимательная гидрогеология. — Москва: Недра, 1979. — С. 5—12. — 157 с.
- ↑ 1 2 3 Петрянов И.В. Самое необыкновенное вещество // Химия и жизнь. — 1965. — № 3. — С. 2—14.
- ↑ Physics of Ice (15 страница)
- ↑ Молекулярные преобразователи энергии в живой клетке (Тихонов А. Н., 1997). Дата обращения: 24 ноября 2007. Архивировано 23 января 2009 года.
- ↑ Воскресенский П. И. Техника лабораторных работ. 9-е изд. — Л.: «Химия», 1970. — С. 696—697
- ↑ Невероятно: у воды есть два жидких состояния Архивная копия от 27 ноября 2020 на Wayback Machine // Вести.ру, 21 ноября 2020
- ↑ Thermalinfo ruАвтор11 11 2016 в 15:06. Удельная теплоемкость воды: таблицы при различных температуре и давлении. Thermalinfo.ru. Дата обращения: 30 мая 2022. Архивировано 23 ноября 2021 года.
- ↑ Теплоёмкость воды desmos. Desmos. Дата обращения: 30 мая 2022.
- ↑ График теплоёмкости онлайн. Desmos. Дата обращения: 3 июня 2022. Архивировано 6 июня 2022 года.
- ↑ аппроксимация диэлектрической проницаемости. Дата обращения: 16 ноября 2021. Архивировано 16 ноября 2021 года.
- ↑ look at page 1162. Дата обращения: 16 ноября 2021. Архивировано 16 ноября 2021 года.
- ↑ Оптика океана. Большая российская энциклопедия (7 июня 2023). Дата обращения: 14 апреля 2024.
- ↑ University of Maine System. Optical properties of water (англ.).
- ↑ Ходаков Ю. В., Эпштейн Д. А., Глориозов П. А. § 7. Атомы // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 15—18. — 240 с. — 1 630 000 экз.
- ↑ Радиационная химия // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. — С. 200. — ISBN 5-7155-0292-6.
- ↑ Le Caër S. Water Radiolysis: Influence of Oxide Surfaces on H2 Production under Ionizing Radiation (англ.) // Water : journal. — 2011. — Vol. 3. — P. 236. Архивировано 23 марта 2014 года.
- ↑ rmg, 2015, с. 2.
- ↑ Перевод тут близок к первому: Земля людей (Перевод Горация Велле). VII. В сердце пустыни // Антуан де Сент-Экзюпери. Земля людей / Пер. с фр. под ред. Е. Зониной. — М.: Государственное издательство художественной литературы, 1957. — С. 181. — (Зарубежный роман XX века). — 165 000 экз.
- ↑ Вода на Луне: но откуда? Дата обращения: 8 сентября 2020. Архивировано 20 сентября 2020 года.
- ↑ Jane Platt, Brian Bell. NASA Space Assets Detect Ocean inside Saturn Moon. NASA (3 апреля 2014). Дата обращения: 3 апреля 2014. Архивировано 3 апреля 2014 года.
- ↑ Iess, L.; Stevenson, D.J.; Parisi, M.; Hemingway, D.; Jacobson, R.A.; Lunine, J.I.; Nimmo, F.; Armstrong, J.w.; Asmar, S.w.; Ducci, M.; Tortora, P. The Gravity Field and Interior Structure of Enceladus (англ.) // Science : journal. — 2014. — 4 April (vol. 344). — P. 78—80. — doi:10.1126/science.1250551. Архивировано 6 апреля 2014 года.
- ↑ Solanki, S. K.; Livingston, W.; Ayres, T. New Light on the Heart of Darkness of the Solar Chromosphere (англ.) // Science : journal. — 1994. — Vol. 263, no. 5143. — P. 64—66. — doi:10.1126/science.263.5143.64. — . — PMID 17748350.
- ↑ MESSENGER Scientists 'Astonished' to Find Water in Mercury's Thin Atmosphere. Planetary Society (3 июля 2008). Дата обращения: 5 июля 2008. Архивировано 17 января 2010 года.
- ↑ Bertaux, Jean-Loup; Vandaele, Ann-Carine; Korablev, Oleg; Villard, E.; Fedorova, A.; Fussen, D.; Quémerais, E.; Belyaev, D.; Mahieux, A. A warm layer in Venus' cryosphere and high-altitude measurements of HF, HCl, H2O and HDO (англ.) // Nature : journal. — 2007. — Vol. 450, no. 7170. — P. 646—649. — doi:10.1038/nature05974. — . — PMID 18046397.
- ↑ Sridharan, R.; S.M. Ahmed, Tirtha Pratim Dasa, P. Sreelathaa, P. Pradeepkumara, Neha Naika, and Gogulapati Supriya. 'Direct' evidence for water in the sunlit lunar ambience from CHACE on MIP of Chandrayaan I (англ.) // Planetary and Space Science : journal. — 2010. — Vol. 58, no. 6. — P. 947. — doi:10.1016/j.pss.2010.02.013. — .
- ↑ Donald Rapp. Use of Extraterrestrial Resources for Human Space Missions to Moon or Mars. — Springer, 28 November 2012. — P. 78–. — ISBN 978-3-642-32762-9. Архивировано 15 июля 2016 года.
- ↑ Atreya, Sushil K.; Wong, Ah-San. Coupled Clouds and Chemistry of the Giant Planets — A Case for Multiprobes (англ.) // Space Science Reviews : journal. — Springer, 2005. — Vol. 116. — P. 121—136. — ISSN 0032-0633. — doi:10.1007/s11214-005-1951-5. — . Архивировано 22 июля 2011 года.
- ↑ Jia-Rui C. Cook, Rob Gutro, Dwayne Brown, J. D. Harrington, Joe Fohn. Hubble Sees Evidence of Water Vapor at Jupiter Moon. NASA (12 декабря 2013). Дата обращения: 12 декабря 2013. Архивировано из оригинала 15 декабря 2013 года.
- ↑ Encrenaz, 2003, p. 92.
- ↑ Hubbard, W. B. Neptune's Deep Chemistry (англ.) // Science. — 1997. — Vol. 275, no. 5304. — P. 1279—1280. — doi:10.1126/science.275.5304.1279. — PMID 9064785.
- ↑ Земля (планета) — статья из Большой советской энциклопедии.
- ↑ Water Found on Distant Planet Архивная копия от 24 августа 2013 на Wayback Machine 12 July 2007 By Laura Blue, Time
- ↑ Water Found in Extrasolar Planet’s Atmosphere. Дата обращения: 12 апреля 2014. Архивировано 8 марта 2014 года.
- ↑ Атмосфера экзопланеты GJ 1214b переполнена водой. Компьюлента (24 февраля 2012). — «Новые наблюдения транзитов GJ 1214 b, удалённой от Земли на 40 световых лет, показали, что вода должна составлять не менее половины от всей массы атмосферы этой «суперземли»». Дата обращения: 21 июля 2013. Архивировано 29 августа 2013 года.
- ↑ Watson, P. E. et al. (1980) Total body water volumes for adult males and females estimated from simple anthropometric measurements, The American Journal for Clinical Nutrition, Vol. 33, № 1, pp. 27—39.
- ↑ Моргунова Г. С. Вода, которую мы пьём // Химия и жизнь. — 1965. — № 3. — С. 15—17.
- ↑ Sharma B. K. Water Pollution. — 1994. — P. 408—409. Архивировано 10 июля 2014 года.
- ↑ Воскресенский В. А., Дьяков В. И. Глава 2. Смазочные вещества и их физико-химические свойства // Расчет и проектирование опор скольжения (жидкостная смазка): Справочник. — М.: Машиностроение, 1980. — С. 15. — (Библиотека конструктора). — ISBN ББК 34.42, УДК 621.81.001.2 (031).
- ↑ Ученые: вода появилась в мантии Земли 2,7 млрд лет назад. ТАСС. Дата обращения: 26 апреля 2016. Архивировано 4 мая 2016 года.
Литература
[править | править код]- на русском языке
- Андреев В. Г. Влияние протонного обменного взаимодействия на строение молекулы воды и прочность водородной связи // Материалы V Международной конференции «Актуальные проблемы науки в России». — 2008. — Т. 3. — С. 58—62.
- Арабаджи В. И. Загадки простой воды: в мире воды и льда. — М.: Знание, 1973. — 96 с.
- Гидробионты в самоочищении вод и биогенной миграции элементов. — М.: МАКС-Пресс. 2008. — 200 с. — ISBN 978-5-317-02625-7.
- Кульский Л. А., Даль В. В., Ленчина Л. Г. Вода знакомая и загадочная. — Киев: Радянська школа, 1982. — 120 с.
- Лосев К. С. Вода / Рец. А. А. Соколов. — Л.: Гидрометеоиздат, 1989. — 272 с. — 113 000 экз. — ISBN 5-286-00161-0.
- Мельник А. Г. Вода в христианских сакральных практиках Древней Руси конца X-XVII веков // Святая вода в иеротопии и иконографии христианского мира / ред.-сост. А.М. Лидов. — М.: ООО "Феория", 2017. — С. 496—520. — ISBN 978-5-91796-061-6.
- О некоторых вопросах поддержания качества воды и её самоочищения // Водные ресурсы. — 2005. — Т. 32. — № 3. — С. 337—347.
- Рекомендации по межгосударственной стандартизации РМГ 75-2014. Государственная система обеспечения единства измерений. Измерения влажности веществ. Термины и определения. — М.: Стандартинформ, 2015. — iv + 16 с.
- Черняев А.М. Самый удивительный минерал. Что мы знаем о воде. — Свердловск: Средне-Уральское книжное издательство, 1980. — 192 с.
- Яковлев В. А. Вода // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- на других языках
- Ball, Philip. Life's matrix : a biography of water. — Farrar, Straus, and Giroux, 2001. — ISBN 978-0-520-23008-8.
- Franks, Felix. Water : a matrix of life. — 2nd. — Royal Society of Chemistry, 2007. — ISBN 978-1-84755-234-1.
- Lide, David R. CRC Handbook of Chemistry and Physics : [англ.]. — 84th. — CRC Press, 2003. — ISBN 978-0-8493-0484-2.
- Weingärtner, Hermann. Water, 1. Properties, Analysis, and Hydrological Cycle // Ullmann's Encyclopedia of Industrial Chemistry / Hermann Weingärtner, Ilka Teermann, Ulrich Borchers … [и др.]. — Wiley-VCH Verlag GmbH & Co. KGaA, 2016. — ISBN 978-3-527-30673-2. — doi:10.1002/14356007.a28_001.pub3.
- Encrenaz, Thérèse. ISO observations of the giant planets and Titan: what have we learnt? (англ.) // Planetary and Space Science : journal. — 2003. — February (vol. 51, no. 2). — P. 89—103. — doi:10.1016/S0032-0633(02)00145-9. — .