Вирус иммунодефицита человека: различия между версиями
| [отпатрулированная версия] | [непроверенная версия] |
Victoria (обсуждение | вклад) м оформление |
SA 1524 (обсуждение | вклад) м пожалуйста, смотрите мою страницу обсуждений |
||
| Строка 630: | Строка 630: | ||
|isbn = 978-5-9502-0378-7 |
|isbn = 978-5-9502-0378-7 |
||
}} |
}} |
||
| ⚫ | |||
| ⚫ | |||
== См. также == |
== См. также == |
||
| ⚫ | |||
* [[СПИД]] |
|||
* [[Анализ на ВИЧ]] |
* [[Анализ на ВИЧ]] |
||
* [[Высокоактивная антиретровирусная терапия]] |
* [[Высокоактивная антиретровирусная терапия]] |
||
| Строка 639: | Строка 640: | ||
* [[Движение по отрицанию ВИЧ/СПИДа]] |
* [[Движение по отрицанию ВИЧ/СПИДа]] |
||
* [[ACET]] — международная организация, занимающаяся профилактикой ВИЧ-инфекции |
* [[ACET]] — международная организация, занимающаяся профилактикой ВИЧ-инфекции |
||
== Ссылки == |
|||
| ⚫ | |||
{{ЗППП}} |
{{ЗППП}} |
||
Версия от 12:37, 17 сентября 2011
| Вирус иммунодефицита человека | ||||||
|---|---|---|---|---|---|---|
 Стилизованное изображение сечения ВИЧ | ||||||
| Научная классификация | ||||||
|
Реалм: Царство: Pararnavirae Тип: Artverviricota Класс: Порядок: Семейство: Подсемейство: Род: Группа: Primate lentivirus group |
||||||
| Международное научное название | ||||||
| Primate lentivirus group | ||||||
| Виды | ||||||
|
||||||
| Группа по Балтимору | ||||||
| VI: оцРНК-ОТ-вирусы | ||||||
| ||||||
ВИЧ — вирус иммунодефицита человека, вызывающий заболевание — ВИЧ-инфекцию, последняя стадия которой известна как синдром приобретённого иммунодефицита (СПИД) — в отличие от врождённого иммунодефицита.
Распространение ВИЧ-инфекции связано, главным образом, с незащищенными половыми контактами, использованием зараженных вирусом шприцев, игл и других медицинских и парамедицинских инструментов, передачей вируса от инфицированной матери ребенку во время родов или при грудном вскармливании. В развитых странах обязательная проверка донорской крови в значительной степени сократила возможность передачи вируса при её использовании.
ВИЧ заражает прежде всего клетки иммунной системы (CD4+ Т-лимфоциты, макрофаги и дендритные клетки), а также некоторые другие типы клеток. Инфицированные ВИЧ CD4+ Т-лимфоциты постепенно гибнут. Их гибель обусловлена главным образом тремя факторами
- непосредственным разрушением клеток вирусом
- запрограммированной клеточной смертью
- убийством инфицированных клеток CD8+ Т-лимфоцитами. Постепенно субпопуляция CD4+ Т-лимфоцитов сокращается, в результате чего клеточный иммунитет снижается, и при достижении критического уровня количества CD4+ Т-лимфоцитов организм становится восприимчивым к оппортунистическим (условно-патогенным) инфекциям.
Своевременно начатое лечение антиретровирусными препаратами (ВААРТ) останавливает прогрессию ВИЧ-инфекции и снижает риск развития СПИД до 0,8-1,7 %[2][3][4][5]. Однако антиретровирусные препараты широко доступны только в развитых и некоторых развивающихся (Бразилия) странах по причине их высокой цены.
По оценке Объединённой программы ООН по ВИЧ/СПИД (ЮНЭЙДС) и Всемирной организации здравоохранения (ВОЗ), с 1981 по 2006 от болезней, связанных с ВИЧ-инфекцией и СПИД умерли 25 миллионов человек. Таким образом, пандемия ВИЧ-инфекции является одной из наиболее губительных эпидемий в истории человечества. Только в 2006 году ВИЧ-инфекция стала причиной смерти около 2,9 миллиона человек. К началу 2007 года во всем мире около 40 миллионов человек (0,66 % населения Земли) являлись носителями ВИЧ[6]. Две трети из общего числа ВИЧ-инфицированных живут в странах Африки к югу от пустыни Сахары. В наиболее пострадавших от пандемии ВИЧ-инфекции и СПИД странах эпидемия препятствует экономическому росту и увеличивает бедность населения[7].
История открытия

Вирус иммунодефицита человека был открыт в 1983 году в результате исследования этиологии СПИД. Первыми официальными научными сообщениями о СПИД стали две статьи о необычных случаях развития пневмоцистной пневмонии и саркомы Капоши у мужчин-гомосексуалов, опубликованные в 1981[8][9]. В июле 1982 впервые для обозначения новой болезни был предложен термин СПИД (AIDS) [10]. В сентябре того же года на основе ряда оппортунистических инфекций, диагностированных у (1) мужчин-гомосексуалов, (2) наркопотребителей, (3) больных гемофилией A и (4) гаитян, СПИД впервые было дано полноценное определение как болезни[11]. В период с 1981 по 1984 год вышло несколько работ, связывающих опасность развития СПИД с анальным сексом или с влиянием наркотиков[12][13][14][15][16][17]. Параллельно велись работы над гипотезой о возможной инфекционной природе СПИД. Вирус иммунодефицита человека независимо открыли в 1983 году в двух лабораториях:
- в Институте Пастера во Франции под руководством Люка Монтанье (фр. Luc Montagnier).
- в Национальном институте рака в США под руководством Роберта Галло (англ. Robert C. Gallo).
Результаты исследований, в которых из тканей пациентов впервые удалось выделить новый ретровирус, были опубликованы 20 мая 1983 в журнале Science [18][19]. В этих статьях сообщалось об обнаружении нового вируса, принадлежащего к группе HTLV вирусов [20]. Исследователи выдвигали предположение, что выделенные ими вирусы могут вызывать СПИД.
4 мая 1984 исследователи сообщили о выделении вируса, носившего на тот момент название HTLV-III, из лимфоцитов 26 из 72 обследованных больных СПИД и 18 из 21 больных с пре-СПИД состоянием. Ни у кого из 115 здоровых гетеросексуальных индивидов контрольной группы вирус обнаружить не удалось. Исследователи отметили, что малый процент выделения вируса из крови больных СПИД вызван малым количеством Т4 лимфоцитов, клеток, в которых, предположительно, размножается ВИЧ.[21].
Кроме того, ученые сообщили об обнаружении антител к вирусу [22], об идентификации ранее описанных у других вирусов и прежде неизвестных антигенов HTLV-III [23] и о наблюдении размножения вируса в популяции лимфоцитов [24].
В 1986 было обнаружено, что вирусы, открытые в 1983 французскими и американскими исследователями, генетически идентичны. Первоначальные названия вирусов были упразднены и предложено одно общее название — ВИЧ [25].
В 2008 году Люк Монтанье и Франсуаза Барре-Синусси были удостоены Нобелевской премии в области физиологии и медицины «за открытие вируса иммунодефицита человека».
Биология ВИЧ
Попадая в организм человека, ВИЧ заражает CD4+ лимфоциты, макрофаги и некоторые другие типы клеток. Проникнув же в указанные типы клеток, вирус начинает активно в них размножаться. Это в конечном счёте приводит к разрушению и гибели зараженных клеток. Присутствие ВИЧ со временем вызывает нарушение иммунной системы из-за избирательного уничтожения им иммунокомпетентных клеток и подавления их субпопуляции. Вышедшие из клетки вирусы внедряются в новые, и цикл повторяется. Постепенно число CD4+ лимфоцитов снижается настолько, что организм уже не может противостоять возбудителям оппортунистических инфекций, которые не опасны или мало опасны для здоровых людей с нормальной иммунной системой.
Классификация
Вирус иммунодефицита человека относят к семейству ретровирусов (Retroviridae), роду лентивирусов (Lentivirus). Название Lentivirus происходит от латинского слова lente — медленный. Такое название отражает одну из особенностей вирусов этой группы, а именно — медленную и неодинаковую скорость развития инфекционного процесса в макроорганизме. Для лентивирусов также характерен длительный инкубационный период.
Родственные вирусы
В роде Lentivirus выделяют следующие виды (по данным на 2008 год)[26][27].
| Аббревиатура | Английское название | Русское название |
|---|---|---|
| EIAV | Equine infectious anemia virus | Вирус инфекционной анемии лошадей |
| OOP | Ovine Progressive Pneumonia | Вирус меди-висна овец |
| CAEV | Caprine-ovine arthritis-encephalitis virus | Вирус артрита-энцефалита коз и овец |
| BIV | Bovine immunodeficiency virus | Вирус иммунодефицита крупного рогатого скота |
| FIV | Feline immunodefitiency virus | Вирус иммунодефицита кошек |
| PLV | Puma lentivirus | Лентивирус пум |
| SIV | Simian immunedeficiency virus | Вирус иммунодефицита обезьян. Известно несколько штаммов этого вируса. Каждый штамм характерен для одного вида приматов: SIV-agm, SIV-cpz, SIV-mnd, SIV-mne, SIV-mac, SIV-sm, SIV-stm |
| HIV-1 | Human immunodeficiency virus-1 | Вирус иммунодефицита человека |
| HIV-2 | Human immunodeficiency virus-2 | Вирус иммунодефицита человека-2 |
Наиболее хорошо изученным является ВИЧ.
Разновидности ВИЧ
Для вируса иммунодефицита человека характерна высокая частота генетических изменений, возникающих в процессе самовоспроизведения. Частота возникновения ошибок у ВИЧ составляет 10−3 — 10−4 ошибок / (геном * цикл репликации), что на несколько порядков больше аналогичной величины у эукариот. Длина генома ВИЧ составляет примерно 104 нуклеотидов. Из этого следует, что практически каждый вирус хотя бы на один нуклеотид отличается от своего предшественника. В природе ВИЧ существует в виде множества квази-видов, являясь при этом одной таксономической единицей. В процессе исследования ВИЧ все-таки были обнаружены разновидности, которые значительно отличались друг от друга по нескольким признакам, в частности различной структурой генома. Разновидности ВИЧ обозначаются арабскими цифрами. На сегодняшний день известны ВИЧ-1, ВИЧ-2, ВИЧ-3, ВИЧ-4.
- ВИЧ-1 — первый представитель группы, открытый в 1983 году. Является наиболее распространенной формой.
- ВИЧ-2 — вид вируса иммунодефицита человека, идентифицированный в 1986 году [28]. По сравнению с ВИЧ-1, ВИЧ-2 изучен в значительно меньшей степени. ВИЧ-2 отличается от ВИЧ-1 в структуре генома. Известно, что ВИЧ-2 менее патогенен и передается с меньшей вероятностью, чем ВИЧ-1. Отмечено, что люди, инфицированные ВИЧ-2, обладают слабым иммунитетом к ВИЧ-1.
- ВИЧ-3 — редкая разновидность, об открытии которой было сообщено в 1988[29]. Обнаруженный вирус не реагировал с антителами других известных групп, а также обладал значительными отличиями в структуре генома. Более распространенное наименование для этой разновидности — ВИЧ-1 подтип O[30].
- ВИЧ-4 — редкая разновидность вируса, обнаруженная в 1986 году[31].
Глобальная эпидемия ВИЧ-инфекции главным образом обусловлена распространением ВИЧ-1. ВИЧ-2 распространен преимущественно в Западной Африке. ВИЧ-3 и ВИЧ-4 не играют заметной роли в распространении эпидемии.
В подавляющем большинстве случаев, если не оговорено иначе, под ВИЧ подразумевается ВИЧ-1.
Строение вириона
Вирионы ВИЧ имеют вид сферических частиц, диаметр которых составляет около 100—120 нанометров. Это приблизительно в 60 раз меньше диаметра эритроцита.
Капсид зрелого вириона имеет форму усеченного конуса. Иногда встречаются «многоядерные» вирионы, содержащие 2 или более нуклеоидов.
В состав зрелых вирионов входит несколько тысяч белковых молекул различных типов.
Названия и функции основных структурных белков ВИЧ-1.
| Сокращение | Описание | Функции |
|---|---|---|
| gp41 (TM, transmembrane) | трансмембранный гликопротеин массой 41 кДа | Располагается во внешнем слое липидной мембраны. Играет роль «якоря», удерживающего молекулы другого белка — gp120 |
| gp120 (SU, surface) | гликопротеин массой 120 кДа | Наружный белок вириона. Нековалентно связан с трансмембранным белком gp41. С одной молекулой gp41 связаны 3 — 5 молекул gp120. Способен связываться с CD4 рецептором. Играет важную роль в процессе проникновения вируса в клетку. |
| p24 (CA, capsid) | белок массой 24 кДа | белок, образующий оболочку нуклеоида (капсида) вируса |
| p17 (MA, matrix) | Матриксный белок массой 17 кДа | Около двух тысяч молекул этого белка образуют слой толщиной 5 — 7 нм, располагающийся между внешней оболочкой и нуклеоидом вируса. |
| p7 (NC, nucleocapsid) | Нуклеокапсидный белок массой 7 кДа | Белок, входящий в состав нуклеоида вируса. Образует комплекс с вирусной РНК. |

Внутри капсида ВИЧ находится белковонуклеиновый комплекс: две нити вирусной РНК, вирусные ферменты (обратная транскриптаза, протеаза, интеграза) и белок p7. С капсидом также ассоциированы белки Nef и Vif (7-20 молекул Vif на вирион). Внутри вириона (и, вероятнее всего, за пределами капсида) обнаружен белок Vpr[32]. Сам капсид образован ~2,000 копий вирусного белка p24. Стехиометрическое соотношение p24:gp120 в вирионе составляет 60-100:1, а p24:Pol примерно 10-20:1[33]. Кроме того, с капсидом ВИЧ-1 (но не ВИЧ-2) связываются ~200 копий клеточного циклофилина А, который вирус заимствует у зараженной клетки [34].
Капсид ВИЧ окружен матриксной оболочкой, образованной ~2,000 копий матриксного белка p17. Матриксная оболочка в свою очередь окружена двуслойной липидной мембраной, являющейся наружной оболочкой вируса. Она образована молекулами, захваченными вирусом во время его отпочковывания из клетки, в которой он сформировался. В липидную мембрану встроены 72 гликопротеиновых комплекса, каждый из которых образован тремя молекулами трансмембранного гликопротеина (gp41 или TM), служащими «якорем» комплекса, и тремя молекулами поверхностного гликопротеина (gp120 или SU) [34]. С помощью gp120 вирус присоединяется к CD4 рецептору и корецептору, находящимся на поверхности мембраны клеток. gp41 и в особенности gp120 интенсивно изучаются как цели для разработки лекарств и вакцины против ВИЧ. В липидной мембране вируса также находятся мембранные белки клеток, в том числе человеческие лейкоцитарные антигены (HLA) классов I, II и молекулы адгезии [35].
Геном ВИЧ-1 и кодируемые им белки

Генетический материал ВИЧ представлен двумя не связанными нитями положительно-смысловой (positive-sense, или (+)) РНК [34]. Геном ВИЧ-1 имеет длину 9,000 нуклеотидов. Концы генома представлены длинными концевыми повторами (LTR), которые управляют продукцией новых вирусов и могут активироваться и белками вируса, и белками инфицированной клетки.
9 генов ВИЧ-1 кодируют, по крайней мере, 15 белков [36].
- pol — кодирует ферменты: обратную транскриптазу (RT), интегразу (IN) и протеазу (PR).
- gag — кодирует полипротеин Gag/p55, расщепляемый вирусной протеазой (PR) до структурных белков p6, p7, p17, p24.
- env — кодирует белок gp160, расщепляемый клеточной эндопротеазой фурином на структурные белки gp41 и gp120[37].
Другие шесть генов — tat, rev, nef, vif, vpr, vpu (vpx у ВИЧ-2) — кодируют белки, отвечающие за способность ВИЧ-1 инфицировать клетки и производить новые копии вируса.
Репликация ВИЧ-1 in vitro возможна без генов nef, vif, vpr, vpu [35]. Однако данные белки необходимы для полноценной инфекции in vivo[38][39][40].
Gag
Полипротеин-предшественник Gag/p55 синтезируется с полноразмерной геномной РНК (которая в данном случае служит в качестве мРНК) в процессе стандартной кэп-зависимой трансляции, но синтез возможен и с помощью IRES, расположенного в 5'-нетранслируемой области мРНК. Локализация отдельных белков Gag, на которые расщепляется Gag/p55, следующая: p17...p24...p2...p7...p1...p6[41]. (р1 и р2 - соединительные пептиды; другие продукты расщепления Gag/p55 описаны выше.) Нерасщеплённый протеазой Gag/p55 содержит три основных домена: домен мембранной локализации (М, membrane targeting), домен взаимодействия (I, interaction) и "поздний" домен (L, late). Домен М, расположенный внутри области p17/МА, миристилируется и направляет Gag/p55 к плазматической мембране. Домен I, находящийся внутри области p7/NC, отвечает за межмолекулярные взаимодействия отдельных мономеров Gag/p55. Домен L, также локализованный в области p7/NC, опосредует отпочковывание (budding) дочерних вирионов от плазматической мембраны; в этом процессе участвует также р6 область полипротеина Gag/p55[41].
Vpu
Двумя важными функциями белка Vpu являются: 1) деградация (разрушение) клеточного рецептора CD4 в эндоплазматическом ретикулуме путём привлечения убиквитин-лигазных комплексов, и 2) стимуляция выделения дочерних вирионов из клетки, путём инактивации интерферон-индуцируемого трансмембранного белка CD317/BST-2, получившего также название «tetherin» за его способность подавлять выделение вновь образовавшихся дочерних вирионов посредством их удержания на поверхности клетки[38][39][42][43][44][45].
Vpr
Vif
Nef
Tat
Rev
ВИЧ-инфекция
| Вирус иммунодефицита человека | |
|---|---|
 | |
| МКБ-11 | XN487 |
| МКБ-10 | B20, B21, B22, B23, B24 |
| МКБ-9 | 042-044 |
| MeSH | D006678 |
ВИЧ-инфекция — вирусное заболевание, вызываемое вирусом иммунодефицита человека. Последней стадией заболевания является СПИД.
Период от инфицирования вирусом иммунодефицита человека до развития СПИД длится в среднем 9 — 11 лет [46]. Статистические данные многочисленных исследований, проведённых в различных странах за период времени более двух десятилетий, подтверждают это заключение. Эти цифры справедливы лишь для случаев, когда ВИЧ-инфекция не подвергается никакой терапии.
Группы риска
В разделе не хватает ссылок на источники (см. рекомендации по поиску). |
- лица, употребляющие инъекционные наркотики, использующие общую посуду для приготовления наркотика (распространение вируса через иглу шприца и общую посуду для растворов наркотиков); а также их половые партнёры[47].
- лица (независимо от сексуальной ориентации), практикующие незащищённый анальный секс[48] (в частности, примерно 25 % случаев незащищённого анального секса среди серопозитивных геев составляют так называемые «barebackers» [составляющие около 14 % всех геев в исследованной выборке] — лица, сознательно избегающие использования презервативов, несмотря на свою осведомлённость о возможности заражения ВИЧ[49][50][51][52]; небольшую долю среди barebackers составляют «bug chasers» — лица, целенаправленно стремящиеся заразиться ВИЧ и выбирающие в качестве партнёров для секса ВИЧ-позитивных или потенциально позитивных индивидуумов, называемых «gift-givers»[53][54])
- лица, практикующие незащищённый вагинальный секс[48][55] (в частности, этот путь заражения является преобладающим в Африке[56]; в 2007 году в Восточной Европе 42 % новых ВИЧ-инфекций было обусловлено гетеросексуальными контактами[57])
- лица, которым сделали переливание непроверенной донорской крови[58];
- врачи[59];
- больные другими венерическими заболеваниями[60];
- коммерческие секс-работники и их клиенты [61]
Патогенез
Основа патогенеза ВИЧ до сих пор не очень ясна. Последние данные говорят о том, что гиперактивация иммунной системы в ответ на инфекцию является основным фактором патогенеза ВИЧ. Одной из черт патогенеза является гибель CD4+ Т-клеток (Т-хелперов), концентрация которых медленно, но неуклонно снижается. Также снижается количество дендритных клеток, профессиональных антиген-презентирующих клеток, которые в основном и начинают иммунный ответ к патогену, что по важности последствий для иммунной системы является может даже более сильным фактором, нежели гибель Т-хелперов. Причины гибели дендритных клеток остаются неясными.
Некоторые причины гибели хелперов:
- Взрывная репродукция вируса.
- Слияние мембран заражённых и незаражённых хелперов с образованием нежизнеспособных симпластов (хелперы становятся липкими). Симпласты были обнаружены только в лабораторных условиях в условиях культур клеток.
- Атака заражённых клеток цитотоксичными лимфоцитами.
- Адсорбция свободного gp120 на CD4+ незаражённых хелперах с их последующей атакой цитотоксических лимфоцитов.
Основной причиной гибели Т-клеток при ВИЧ-инфекции является программируемая клеточная гибель (апоптоз). Даже на стадии СПИД уровень инфицированности Т4-клеток составляет 1:1000, что говорит о том, что вирус сам по себе не способен убить такое количество клеток, которое погибает при ВИЧ-инфекции. Также не объяснить столь массовую гибель Т-клеток и цитотоксическим действием других клеток.
Нарушения в работе иммунной системы со временем нарастают вплоть до полной неспособности осуществлять свою основную функцию — защиту организма от болезнетворных организмов. На фоне гиперактивации часто возникают лейкозы, что в совокупности приводит к тому, что факультативные паразиты, которые сосуществуют в здоровом организме под контролем иммунной системы, выходят из под контроля, становясь гибельными для организма.
Основной резервуар ВИЧ в организме — макрофаги и моноциты:
- В них не происходит взрывающей репродукции.
- Выход происходит через комплекс Гольджи.
Стадии инфекционного процесса
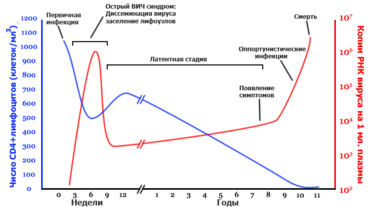
Число копий РНК вируса на мл. плазмы
Общая продолжительность составляет в среднем 10 лет. В течение всего этого времени наблюдается постоянное снижение количества лимфоцитов в крови больного, что в конечном итоге становится причиной смерти.
Инкубационный период (период сероконверсии — до появления детектируемых антител к ВИЧ) — от 3-х недель до 3 месяцев.
Продромальный период — стадия первичного инфицирования, до 1 месяца. Клинические проявления: субфебрильная температура, крапивница, стоматит, воспаление лимфатических узлов — они становятся увеличенными, мягкими и болезненными (проходит под маской инфекционного мононуклеоза). Максимальная концентрация вируса, антител появляется только в самом конце продромального периода.
Латентный период — 5-10 лет, единственное проявление — стойкое увеличение лимфатических узлов (плотные, безболезненные) — лимфоаденопатия.
ПреСПИД — продолжительность 1-2 года — начало угнетения клеточного иммунитета. Часто рецидивирующий герпес — долго не заживающие изъязвления слизистой рта, половых органов, стоматит. Лейкоплакия языка (разрастание сосочкового слоя- «волокнистый язык»). Кандидоз — слизистой рта, половых органов.
Терминальная стадия — СПИД — 1-2 года.
Генерализация оппортунистических инфекций и опухолей.
- заболевание туберкулёзом (в том числе и птичьим)
- сальмонеллы — переход в генерализованную форму, энцефалит, менингит.
- Legionella pneumophyla
- все вирусы гриппа, вирус простого герпеса.
- простейшие — криптоспоригии, токсоплазма(менингоэнцефалит с летальным исходом)
- грибы — кандида, гистоплазма, криптококк, плесневые грибы.
- злокачественные опухоли.
- саркома Капоши.
- лимфомы.
- пневмоцистная пневмония
Диагностика
Течение ВИЧ-инфекции характеризуется длительным отсутствием существенных симптомов болезни [62]. Диагноз ВИЧ-инфекции ставится на основании лабораторных данных: при выявлении в крови антител к ВИЧ. Антитела к ВИЧ в период острой фазы, как правило, не обнаруживают. В первые 3 мес. после заражения антитела к ВИЧ выявляются у 96-97 % пациентов, через 6 мес. — у остальных 2-3 %, а в более поздние сроки — только у 0,5-1 % (источник Centers for Disease Control and Prevention USA, 2009г). В стадии СПИД регистрируют существенное снижение содержания антител в крови. Первые недели после инфицирования представляют собой «период серонегативного окна», когда антитела к ВИЧ не выявляются. Поэтому отрицательный результат тестирования на ВИЧ в этот период не означает, что человек не инфицирован ВИЧ и не может заразить других.
Для диагностики поражения слизистой оболочки рта у ВИЧ-инфицированных больных принята рабочая классификация, утверждённая в Лондоне, в сентябре 1992 года. Все поражения разделены на 3 группы:
- 1 группа — поражения, чётко связанные с ВИЧ-инфекцией. В эту группу включены следующие нозологические формы:
- кандидозы (эритематозный, псевдомембранозный, гиперпластический, атрофический);
- волосистая лейкоплакия;
- маргинальный гингивит;
- язвенно-некротический гингивит;
- деструктивный пародонтит;
- саркома Капоши;
- неходжкинская лимфома.
- 2 группа — поражения, менее чётко связанные с ВИЧ-инфекцией:
- бактериальные инфекции;
- болезни слюнных желёз;
- вирусные инфекции;
- тромбоцитопеническая пурпура.
- 3 группа — поражения, которые могут быть при ВИЧ-инфекции, но не связанные с нею.
Наибольший интерес вызывают и наиболее часто встречаются поражения, относящиеся к 1 группе.
В России при постановке диагноза ВИЧ-инфекция проводится дотестовое и послетестовое консультирование пациента, разъяснение основных фактов о заболевании. Пациенту предлагается встать на учет в территориальный центр профилактики и борьбы со СПИД для бесплатного диспансерного наблюдения врачом-инфекционистом. Приблизительно раз в полгода рекомендуется сдавать анализы (на иммунный статус и на вирусную нагрузку) для контроля состояния здоровья. В случае значительного ухудшения этих показателей рекомендуется прием антиретровирусных препаратов (терапия бесплатна, доступна практически во всех регионах).
Терапия
До настоящего времени не разработано лечения ВИЧ-инфекции, которое могло бы устранить ВИЧ из организма.
Современный способ лечения ВИЧ-инфекции (т. н. высокоактивная антиретровирусная терапия) замедляет и практически останавливает прогрессирование ВИЧ-инфекции и её переход в стадию СПИД, позволяя ВИЧ-инфицированному человеку жить полноценной жизнью. При использовании лечения и при условии, что эффективность лекарств сохраняется, продолжительность жизни человека ограничивается не ВИЧ, а лишь естественными процессами старения. Однако после длительного использования одной и той же схемы терапии, через несколько лет, вирус мутирует, приобретая резистентность к применяемым препаратам, и для дальнейшего контроля над прогрессированием ВИЧ-инфекции необходимо применять новые схемы лечения с другими препаратами. Поэтому любая существующая на сегодняшний день схема лечения ВИЧ-инфекции рано или поздно становится неэффективной. Также, во многих случаях, пациент не может принимать отдельные препараты по причине индивидуальной непереносимости. Поэтому грамотное применение терапии отсрочивает развитие СПИД на неопределенное время. На сегодняшний день появление новых классов препаратов в основном нацелено на уменьшение побочных эффектов от приема терапии, поскольку продолжительность жизни ВИЧ-положительных людей, принимающих терапию, практически сравнялась с продолжительностью жизни ВИЧ-отрицательного населения. В период более позднего развития ВААРТ (2000—2005 гг.) выживаемость ВИЧ-инфицированных больных при исключении больных с гепатитом С достигает 38,9 лет (37,8 — для мужчин и 40,1 — для женщин).[71][72]
Важное значение придается поддержанию здоровья ВИЧ-положительного немедикаментозными средствами (правильное питание, здоровый сон, избегание сильных стрессов и длительного нахождения на солнце, здоровый образ жизни), а также регулярный (2-4 раза в год) мониторинг состояния здоровья у врачей-специалистов по ВИЧ.
Устойчивость (иммунитет) к ВИЧ
Несколько лет назад был описан генотип человека, устойчивый к ВИЧ. Проникновение вируса в иммунную клетку связано с его взаимодействием с поверхностным рецептором: белком CCR5. Но делеция (утеря участка гена) CCR5-дельта32 приводит к невосприимчивости её носителя к ВИЧ. Предполагается, что эта мутация возникла примерно две с половиной тысячи лет назад и со временем распространилась в Европе.
Сейчас к ВИЧ фактически устойчив в среднем 1 % европейцев, 10-15 % европейцев имеют частичную сопротивляемость к ВИЧ [3].
Учёные Ливерпульского университета объясняют такую неравномерность тем, что мутация CCR5 увеличивает сопротивляемость к бубонной чуме. Поэтому после эпидемий «чёрной смерти» 1347 года (а в Скандинавии ещё и 1711 года) доля этого генотипа выросла.
Мутация в гене CCR2 также уменьшает шанс проникновения ВИЧ в клетку и приводит к задержке развития СПИД.
Существует небольшой процент людей (около 10 % всех ВИЧ-положительных), в крови которых присутствует вирус, однако СПИД у них не развивается в течение долгого времени (т. н. непрогрессоры).
Обнаружено, что одним из главных элементов антивирусной защиты человека и других приматов является белок TRIM5a, способный распознавать капсид вирусных частиц и препятствовать размножению вируса в клетке. Данный белок у человека и других приматов имеет различия, которые обуславливают врожденную устойчивость шимпанзе к ВИЧ и родственным ему вирусам, а у человека — врожденную устойчивость к вирусу PtERV1 [63].
Другой важный элемент антивирусной защиты — интерферон-индуцируемый трансмембранный белок CD317/BST-2 (bone marrow stromal antigen 2), получивший также название «tetherin» за его способность подавлять выделение вновь образовавшихся дочерних вирионов посредством их удержания на поверхности клетки[42][43][64]. CD317 — трансмембранный белок 2го типа с необычной топологией — трансмембранный домен рядом с N-концом и гликозилфосфатидилинозитол (GPI) на С-конце; между ними расположен внеклеточный домен[65]. Показано, что CD317 непосредственно взаимодействует со зрелыми дочерними вирионами, «привязывая» их к поверхности клетки[66]. Для объяснения механизма такого «привязывания» предложено четыре альтернативных модели, согласно которым две молекулы CD317 формируют параллельный гомодимер; один или два гомодимера связываются одновременно с одним вирионом и клеточной мембраной. При этом с мембраной вириона взаимодействуют либо оба мембранных «якоря» (трансмембранный домен и GPI) одной из молекул CD317, либо один из них[66]. Спектр активности CD317 включает, по крайней мере, четыре семейства вирусов: ретровирусы, филовирусы, аренавирусы и герпесвирусы[64]. Активность данного клеточного фактора ингибируется белками Vpu ВИЧ-1, Env ВИЧ-2 и SIV, Nef SIV, гликопротеином оболочки вируса Эбола и белком К5 герпесвируса саркомы Капоши[38][39][44][45][64][67][68][69]. Обнаружен кофактор белка CD317 — клеточный белок ВСА2 (Breast cancer-associated gene 2; Rabring7, ZNF364, RNF115) — Е3 убиквитин-лигаза класса RING. BCA2 усиливает интернализацию вирионов ВИЧ-1, «привязанных» белком CD317 к клеточной поверхности, в CD63+ внутриклеточные везикулы с их последующим разрушением в лизосомах[70].
Эпидемиология
Краткие глобальные данные об эпидемии ВИЧ-инфекции и СПИД
Согласно докладу «Объединённой программы ООН по ВИЧ/СПИД» декабрь 2006 г.[6].
- Количество людей, живущих с ВИЧ, в 2006 г.
- Всего — 39,5 миллиона (34,1 — 47,1 миллиона)
- Взрослых — 37,2 миллиона (32,1 — 44,5 миллиона)
- Женщин — 17,7 миллиона (15,1 — 20,9 миллиона)
- Детей моложе 15 лет — 2,3 миллиона (1,7 — 3,5 миллиона)
- Количество людей, заразившихся ВИЧ в 2006 г.
- Всего — 4,3 миллиона (3,6 — 6,6 миллиона)
- Взрослых — 3,8 миллиона (3,2 — 5,7 миллиона)
- Детей моложе 15 лет — 530,000 (410,000 — 660,000)
- Количество смертей от СПИД в 2006 г.
- Всего — 2,9 миллиона (2,5 — 3,5 миллиона)
- Взрослых — 2,6 миллиона (2,2 — 3,0 миллиона)
- Детей моложе 15 лет — 380,000 (290,000 — 500,000)

При этом, из общего числа инфицированных, две трети (63 % — 24,7 млн.[21,8 — 27,7 млн.]) всех взрослых и детей с ВИЧ в мире живут в странах Африки к югу от пустыни Сахары, в основном в южной части Африки. Одна треть (32 %) всех людей с ВИЧ в мире живёт в этом субрегионе, и здесь же произошли 34 % всех смертей в связи со СПИД в 2006 году.
Обзор глобальной эпидемиологии ВИЧ-инфекции/СПИД
Всего в мире около 40 миллионов человек живут с ВИЧ-инфекцией. Более двух третей из них населяют Африку к югу от пустыни Сахары. Эпидемия началась здесь в конце 1970-х — начале 1980-х. Центром считается полоса, протянувшаяся от Западной Африки до Индийского океана. Затем ВИЧ перекинулся южнее. Больше всего носителей ВИЧ в ЮАР — около 5 миллионов. Но в пересчёте на душу населения этот показатель выше в Ботсване и Свазиленде. В Свазиленде инфицирован каждый третий взрослый.
За исключением стран Африки быстрее всего ВИЧ распространяется сегодня в Центральной Азии и Восточной Европе. С 1999 по 2002 годы количество инфицированных здесь почти утроилось. Эти регионы сдерживали эпидемию до конца 1990-х, а затем количество заражённых стало резко увеличиваться — в основном за счёт наркоманов.
ВИЧ-инфекция в России
Первый случай ВИЧ инфекции в СССР был обнаружен в 1986 году. С этого момента начинается так называемый период зарождения эпидемии. Первые случаи ВИЧ-инфекции среди граждан СССР, как правило, происходили вследствие незащищенных половых контактов с африканскими студентами в конце 70-х годов XX века. Дальнейшие эпидемиологические мероприятия по изучению распространенности ВИЧ-инфекции в различных группах, проживающих на территории СССР, показали, что наибольший процент инфицирования приходился на тот момент на студентов из африканских стран, в частности из Эфиопии. Распад СССР привел к развалу единой эпидемиологической службы СССР, но не единого эпидемиологического пространства. Короткая вспышка ВИЧ-инфекции в начале 90-х годов среди мужчин, практикующих секс с мужчинами, не получила дальнейшего распространения. В целом данный период эпидемии отличался чрезвычайно низким уровнем инфицированности (на весь СССР меньше 1000 выявленных случаев) населения, короткими эпидемическими цепочками от заражающего к зараженному, спорадическими заносами ВИЧ-инфекции и вследствие этого широким генетическим разнообразием выявляемых вирусов. На тот момент в западных странах эпидемия уже являлась значимой причиной смертности в возрастной группе от 20 до 40 лет.
Данная благополучная эпидемическая обстановка привела к самоуспокоенности в некоторых теперь уже независимых странах бывшего СССР, которая выразилась в том числе и в свертывании некоторых широких противоэпидемических программ, как несоответствующих моменту и чрезвычайно дорогих. Все это привело к тому, что в 1993-95 годах эпидемиологическая служба Украины оказалась неспособна вовремя локализовать две вспышки ВИЧ-инфекции, произошедшие среди потребителей инъекционных наркотиков (ПИН) в Николаеве и Одессе. Как оказалось впоследствии, эти вспышки были независимо вызваны разными вирусами относящимися к разным субтипам ВИЧ-1. Более того, перемещение ВИЧ-инфицированных заключенных из Одессы в Донецк, где они вышли на свободу, только способствовало распространению ВИЧ-инфекции. Чрезвычайно способствовала распространению ВИЧ-инфекции маргинализация ПИН и нежелание властей проводить среди них какие-либо действенные профилактические мероприятия. Только за два года (1994-95) в Одессе и Николаеве было выявлено несколько тысяч ВИЧ-инфицированных, в 90% случаев — ПИН. С этого момента на территории бывшего СССР начинается следующая стадия эпидемии ВИЧ-инфекции, так называемая концентрированная стадия, которая продолжается по настоящее время (2007 год). Данная стадия характеризуется уровнем ВИЧ инфекции 5 и более процентов в определенной группе риска (в случае Украины и России это ПИН). В 1995 происходит вспышка ВИЧ-инфекции среди ПИН в Калининграде, затем последовательно в Москве и Петербурге, далее вспышки среди ПИН шли одна за другой по всей России в направлении с запада на восток. Направление движения концентрированной эпидемии и молекулярно-эпидемиологический анализ показали, что 95% всех изученных случаев ВИЧ-инфекции в России имеют свое происхождение от изначальных вспышек в Николаеве и Одессе. В целом, данная стадия ВИЧ-инфекции характеризуется концентрацией ВИЧ-инфекции среди ПИН, низким генетическим разнообразием вируса, постепенным переходом эпидемии из группы риска в другие популяции.
К концу 2006 года в Российской Федерации было официально зарегистрировано около 370,000 ВИЧ-инфицированных. Однако реальное число носителей инфекции, по оценке на конец 2005, составляет ~940,000 [560,000 — 1,6 млн.]. Показатель распространенности ВИЧ-инфекции среди взрослых достиг значения ~1,1 %.[6] От болезней, связанных с ВИЧ и СПИД умерли ок. 16,000 человек, среди них 208 детей [71].
Около 60% случаев ВИЧ-инфицирования среди россиян приходится на 11 из 86 российских регионов (Иркутская,Саратовская обл. Калининградская, Ленинградская, Московская, Оренбургская, Самарская, Свердловская и Ульяновская области, Санкт-Петербург и Ханты-Мансийский автономный округ).
| Год | Выявленные случаи заражений | Суммарное количество ВИЧ-инфицированных |
| 1995 | 203 | 1 090 |
| 1996 | 1 513 | 2 603 |
| 1997 | 4 315 | 6 918 |
| 1998 | 3 971 | 10 889 |
| 1999 | 19 758 | 30 647 |
| 2000 | 59 261 | 89 908 |
| 2001 | 87 671 | 177 579 |
| 2002 | 49 923 | 227 502 |
| 2003 | 36 396 | 263 898 |
| 2004 | 32 147 | 296 045 |
| 2005 | 35 554 | 331 599 |
| 2006 | 39 589 | 374 411 |
| 2007[73][74] | 42 770 | 416 113 |
| 2008[75] | 54 046 | 471 380 |
| 2009[76] | 58 448 | 529 828 |
К сентябрю 2005 года в учреждениях, входящих в Федеральную службу исполнения наказаний РФ, было зарегистрировано более 31 тысячи ВИЧ-инфицированных, что на тысячу человек больше, чем показатель 2004 года[77].
Передача вируса
ВИЧ может содержаться практически во всех биологических жидкостях организма. Однако достаточное для заражения количество вируса присутствует только в крови, сперме, влагалищном секрете, предсемeнной жидкости, лимфе и грудном молоке (грудное молоко опасно только для младенцев — в их желудке ещё не вырабатывается желудочный сок, который убивает ВИЧ). Заражение может произойти при попадании опасных биожидкостей непосредственно в крово- или лимфоток человека, а также на повреждённые слизистые оболочки (что обусловливается всасывающей функцией слизистых). Если кровь ВИЧ-инфицированного попадает на открытую рану другого человека, из которой кровь течет, заражения, как правило, не происходит.
ВИЧ является нестойким — вне среды организма при высыхании крови (спермы, лимфы и влагалищного секрета) он погибает. Бытовым путём заражения не происходит. ВИЧ практически моментально погибает при температуре выше 56 градусов Цельсия.
Однако при внутривенных инъекциях вероятность передачи вируса очень велика — до 95 %. Чтобы снизить вероятность передачи ВИЧ (до долей процента) в таких случаях, врачам назначают четырёхнедельный курс высокоактивной антиретровирусной терапии. Химиопрофилактика может быть назначена и другим лицам, подвергшимся риску инфицирования. Химиотерапия назначается не позднее чем через 72 часа после вероятного проникновения вируса.
Многократное использование шприцев и игл наркопотребителями с большой вероятностью приводит к передаче ВИЧ. Для предотвращения этого создаются специальные благотворительные пункты, в которых наркопотребители могут получить бесплатно чистые шприцы в обмен на использованные. К тому же молодые наркопотребители почти всегда сексуально активны и склонны к незащищённым половым контактам, что создаёт дополнительные предпосылки для распространения вируса.
Данные о передаче ВИЧ при незащищённом половом контакте по различным источникам сильно отличаются. Риск передачи в значительной степени зависит от типа контакта (вагинальный, анальный, оральный и т. д.) и роли партнёра (вводящая сторона/принимающая сторона).
| для вводящего партнёра при фелляции | 0,5 |
| для принимающего партнёра при фелляции | 1 |
| для вводящего партнёра при вагинальном сексе | 5 |
| для принимающего партнёра при вагинальном сексе | 10 |
| для вводящего партнёра при анальном сексе | 6,5 |
| для принимающего партнёра при анальном сексе | 50 |
Защищённый половой акт, при котором произошёл разрыв презерватива или была нарушена его целостность, считается незащищённым. Чтобы свести к минимуму такие случаи, необходимо исполнять правила пользования презервативами, а также использовать надёжные презервативы.
Возможен также вертикальный путь передачи от матери к ребёнку. При профилактике с помощью ВААРТ риск вертикальной передачи вируса может быть снижен до 1,2 % [79][80].
Содержание вируса в других биологических жидкостях — слюне, слезе — ничтожно мало; нет информации о случаях заражения через слюну, слёзы, пот. Грудное вскармливание может стать причиной заражения, так как грудное молоко содержит ВИЧ, поэтому ВИЧ-положительным матерям не рекомендуют кормить детей грудью.

ВИЧ НЕ передаётся через:
- укусы комаров и прочих насекомых,
- воздух,
- рукопожатие (при отсутствии открытых повреждений кожи),
- поцелуй (любой, но при отсутствии кровоточащих повреждений и трещин на губах и в полости рта),
- посуду,
- одежду,
- пользование ванной, туалетом, плавательным бассейном и т. п.[81].
Анти-ВИЧ-кремы и гели
The Times, ссылаясь на выводы ученых из Миннесотского университета, сообщает, что «монолаурат глицерина» или «лауриновый эфир» используемый в качестве пищевой добавки, входящий в состав косметических средств вероятно, препятствует сигнальным процессам в иммунной системе обезьян, блокируя вирус на ключевой стадии потенциального инфицирования". При попадании вируса в организм, он захватывает Т-клетки и распространяется по кровеносным сосудам, а лауриновый эфир действует так, что воспалительная реакция не развивается...[82]
Люди, живущие с ВИЧ
Термин «Люди, живущие с ВИЧ» (ЛЖВ, либо «Люди, живущие с ВИЧ/СПИД» — ЛЖВС) рекомендуется[кем?] использовать в отношении человека или группы людей, имеющих ВИЧ-положительный статус, так как он отражает тот факт, что люди могут жить с ВИЧ десятилетиями, ведя активный и продуктивный образ жизни. Крайне некорректным является выражение «жертвы СПИДа» (это подразумевает беспомощность и отсутствие контроля), в том числе некорректно называть детей с ВИЧ «невинными жертвами СПИДа» (это подразумевает, что кто-то из ЛЖВ «сам виноват» в своем ВИЧ-статусе или «заслужил» его). Выражение «больной СПИДом» допустимо только в медицинском контексте, поскольку ЛЖВ не проводят свою жизнь на больничной койке[83].
Права ВИЧ-инфицированных ничем не отличаются от прав иных категорий граждан: они также имеют право на оказание медицинской помощи, на свободу труда, на получение образования, на личную и семейную тайну и так далее[84].
Юридические последствия заражения другого человека ВИЧ-инфекцией
За заражение другого человека ВИЧ-инфекцией или поставление его в опасность заражения ВИЧ-инфекцией в значительном числе государств предусматривается уголовная ответственность. В России соответствующие меры наказания предусматриваются статьёй 122 УК РФ.
Источники информации
- ↑ Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV).
- ↑ Emery S, Neuhaus JA, Phillips AN et al. Major clinical outcomes in antiretroviral therapy (ART)-naive participants and in those not receiving ART at baseline in the SMART Study. J Infect Dis 2008; 197: 1133—1144.
- ↑ Katzenstein DA, Hammer SM, Hughes MD et al. The relation of virologic and immunologic markers to clinical outcomes after nucleoside therapy in HIV-infected adults with 200 to 500 CD4 cells per cubic millimeter. N Engl J Med 1996; 335: 1091—1098.
- ↑ Sterne JA, Herna´ n MA, Ledergerber B et al. Long-term effectiveness of potent antiretroviral therapy in preventing AIDS and death: a prospective cohort study. Lancet 2005; 366: 378—384.
- ↑ [1]. Файл PDF, 388 KB
- ↑ 1 2 3 UNAIDS/WHO AIDS Epidemic Update: December 2006. Файл PDF, 2,7 MB
- ↑ Greener, R. «AIDS and macroeconomic impact», in S, Forsyth (ed.): State of The Art: AIDS and Economics, IAEN, — 2002, p. 49-55.
- ↑ Centers for Disease Control. Kaposi’s sarcoma and Pneumocystis pneumonia among homosexual men--New York City and California. Morbidity and Mortality Weekly Report, 1981, v. 30, p. 305. (англ.)
- ↑ Centers for Disease Control. Pneumocystis Pneumonia--Los Angeles. Morbidity and Mortality Weekly Report, 1981, v. 30, p. 250. (англ.)
- ↑ The history of AIDS 1981—1986 (англ.)
- ↑ Centers for Disease Control. Current trends update on acquired immune deficiency syndrome (AIDS) --United States. Morbidity and Mortality Weekly Report, 1982, v. 31, p. 507. (англ.)
- ↑ Gottlieb et al. Pneumocystis carinii pneumonia and mucosal candidiasis in previously healthy homosexual men: evidence of a new acquired cellular immunodeficiency; N. Engl. J. Med. 1981, 305 1425—1431 (англ.)
- ↑ Durack D. T. Opportunistic infections and Kaposi’s sarcoma in homosexual men; N. Engl. J. Med.1981, 305 1465—1467 (англ.)
- ↑ Goedert et al. Amyl nitrite may alter T lymphocytes in homosexual men; Lancet 1982, 1 412—416 (англ.)
- ↑ Jaffe et al. National case-control study of Kaposi’s sarcoma and Pneumocystis carinii pneumonia in homosexual men: Part 1, Epidemiologic results; Ann. Int. Med. 1983, 99 145—151 (англ.)
- ↑ Mathur-Wagh et al. Longitudinal study of persistent generalized lymphadenopathy in homosexual men: Relation to acquired immunodeficiency syndrome; Lancet 1984, 1, 1033—1038 (англ.)
- ↑ Newell et al. Toxicity, immunosupprressive effects, and carcinogenic potential of volatile nitrites: possible relationship to Kaposi’s sarcoma; Pharmacotherapy, 1984, 4, 284—291 (англ.)
- ↑ Barre-Sinoussi F. et al. Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS). Science 1983, v. 220, p. 868. (англ.)
- ↑ Gallo R. et al. Isolation of human T-cell leukemia virus in acquired immune deficiency syndrome (AIDS). Science 1983, v. 220, p. 865. (англ.)
- ↑ Вирусы T-клеточной лейкемии человека.
- ↑ Gallo R. et al. Frequent detection and isolation of cytopathic retroviruses (HTLV-III) from patients with AIDS and at risk for AIDS. Science 1984, v. 224, p. 500
- ↑ Sarngadharan M. et al. Antibodies reactive with human T-lymphotropic retroviruses (HTLV-III) in the serum of patients with AIDS. Science, 1984, v. 220, p. 506
- ↑ Schupbach J. et al. Serological analysis of a subgroup of human T-lymphotropic retroviruses (HTLV-III) associated with AIDS. Science, 1984, v. 220, p. 503
- ↑ Popovic M. et al. Detection, isolation, and continuous production of cytopathic retroviruses (HTLV-III) from patients with AIDS and pre-AIDS. Science, 1984, v. 220, p. 497
- ↑ Coffin J. et al. What to call the AIDS virus? Nature, 1986 v. 321, p. 10
- ↑ Gelderblom H.R., Ozel M., Pauli G. (1989). "Morphogenesis and morphology of HIV. Structure relations". Arch. Virol. 106: 1—13.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Virus databases online
- ↑ Clavel, F. et al. Isolation of a new human retrovirus from West African patients with AIDS. Science, 1986, v. 233, p. 343—346.
- ↑ Marx J.L. (1988). "Tracking variation in the AIDS virus family". Science. 241: 659—660.
- ↑ Ask the Doc
- ↑ Molbak K., Lauritzen E., Fernandes D. (1986). "Antibodies to HTLV-IV associated with chronic fatal illnes resembling "slim" didease". Lancet. 8517: 1214—1215.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Levy J.A. HIV and the pathogenesis of AIDS. — USA: American Society for Microbiology, 2007, p. 8-11
- ↑ Levy J.A. HIV and the pathogenesis of AIDS. — USA: American Society for Microbiology, 2007, p. 11
- ↑ 1 2 3 Turner B.G. et al. Structural biology of HIV. J. Mol. Biol., 1999 v. 285, p. 1-32.
- ↑ 1 2 http://www.eurasiahealth.org/attaches/82169/HIVMedicine2005_rus%20final.pdf Лечение ВИЧ-инфекции 2005 год
- ↑ Fauci A. S. HIV and AIDS: 20 years of science. Nature Medicine, 2003, v. 9, p. 839—843
- ↑ Levy J.A. HIV and the pathogenesis of AIDS. — USA: American Society for Microbiology, 2007, p. 8-12
- ↑ 1 2 3 Guatelli J.C. (2010) «Interactions of Viral protein U (Vpu) with Cellular Factors», Current Topics in Microbiology and Immunology 339, 27-45
- ↑ 1 2 3 Nomaguchi M., Fujita M., Adachi A. (2008) «Role of HIV-1 Vpu protein for virus spread and pathogenesis», Microbes and Infection 10, 960—967
- ↑ Malim M.H., Emerman M. (2008) «HIV-1 accessory proteins — ensuring viral survival in a hostile environment», Cell Host and Microbe 3, 388—398
- ↑ 1 2 Levy J.A. HIV and the pathogenesis of AIDS. — USA: American Society for Microbiology, 2007, p. 8
- ↑ 1 2 Neil S.J., Zang T. and Bieniaz P.D. (2008) «Tetherin inhibits retrovirus release and is antagonized by HIV-1 Vpu», Nature 451, 424—430
- ↑ 1 2 Van Damme N., Goff D., Katsura C., Jorgensen R.L., Mitchell R., Johnon M.C., Stephens E.B. and Guatelli J. (2008) «The interferon-induced protein BST-2 restricts HIV-1 release and is downregulated from the cell surface by the viral Vpu protein», Cel Host and Microbe 3, 245—252
- ↑ 1 2 Dube M, Bego MG, Paquay C, Cohen EA (2010) «Modulation of HIV-1-host interaction: role of the Vpu accessory protein», Retrovirology 7(1):114
- ↑ 1 2 Ruiz A, Guatelli JC, Stephens EB (2010) «The Vpu protein: new concepts in virus release and CD4 down-modulation», Current HIV Research 8, 240-252
- ↑ Steinbrook R. The AIDS Epidemic in 2004. The New England journal of medicine, 2004, v. 351(2), p.115-117.
- ↑ Малый В. П. «ВИЧ. СПИД. Новейший медицинский справочник». — М.: Эксмо, 2009. — с. 39-40 — ISBN 978-5-699-31017-3
- ↑ 1 2 Levy J.A. HIV and the pathogenesis of AIDS. — USA: American Society for Microbiology, 2007, p. 40-49
- ↑ Berg R.C. (2009) «Barebacking: a review of the literature», Archives of Sexual Behaviour 38, 754—764
- ↑ Bauermeister J.A., Carballo-Dieduez A., Ventuneac A. and Dolezal C. (2009) «Assessing motivations to engage in intentional condomless anal intercourse in HIV risk contexts („bareback sex“) among men who have sex with men», AIDS education and prevention 21, 156—168
- ↑ Blackwell C.W. (2008) «Men who have sex with men and recruit bareback sex partners on the internet: implications for STI and HIV prevention and client education», American Journal of Men’s Health 2, 306—313
- ↑ Dean T (2009) «Unlimited intimacy: Reflections on the subculture of barebacking», 237 pp., The University of Chicago Press: Chicago and London
- ↑ Moskowitz D.A. and Roloff M.E. (2007) «The existence of a bug chasing subculture», Culture, Health and Sexuality 9, 347—357
- ↑ Moskowitz D.A. and Roloff M.E. (2007) «The ultimate high: sexual addiction and the bug chasing phenomenon», Sexual Addiction and Compulsivity 14, 21-40
- ↑ Малый В. П. «ВИЧ. СПИД. Новейший медицинский справочник». — М.: Эксмо, 2009. — с. 32-33 — ISBN 978-5-699-31017-3
- ↑ Малый В. П. «ВИЧ. СПИД. Новейший медицинский справочник». — М.: Эксмо, 2009. — с. 44 — ISBN 978-5-699-31017-3
- ↑ UNAIDS: The Joint United Nations Programme on HIV/AIDS
- ↑ Малый В. П. «ВИЧ. СПИД. Новейший медицинский справочник». — М.: Эксмо, 2009. — с. 40-42 — ISBN 978-5-699-31017-3
- ↑ Малый В. П. «ВИЧ. СПИД. Новейший медицинский справочник». — М.: Эксмо, 2009. — с. 43 — ISBN 978-5-699-31017-3
- ↑ Малый В. П. «ВИЧ. СПИД. Новейший медицинский справочник». — М.: Эксмо, 2009. — с. 77-83 — ISBN 978-5-699-31017-3
- ↑ Малый В. П. «ВИЧ. СПИД. Новейший медицинский справочник». — М.: Эксмо, 2009. — с. 42-43 — ISBN 978-5-699-31017-3
- ↑ Buchbinder S. P., Katz M. H., Hessol N. A., O’Malley P. M., Holmberg S. D. Long-term HIV-1 infection without immunologic progression. AIDS, 1994, v. 8, p. 1123—1128.
- ↑ Kaiser, Shariser (2007). "Restriction of an Extinct Retrovirus by the Human TRIM5α Antiviral Protein". Science. 316 (5832): 1756—1758.
{{cite journal}}: Неизвестный параметр|day=игнорируется (справка); Неизвестный параметр|month=игнорируется (справка) - ↑ 1 2 3 Tokarev A., Skasko M., Fitzpatrick K. and Guatelli J. (2009) «Antiviral activity of the interferon-induced cellular protein BST-2/tetherin», AIDS Research and Human Retroviruses 25, 1197—1210
- ↑ Kupzig S., Korolchuk V., Rolason R., Sugden A., Wilde A. and Banting G. (2003) «Bst2/HM1.24 is a raft-associated apical membrane protein with an unusual topology», Traffic 4, 694—709
- ↑ 1 2 Perez-Caballero D., Zang T., Ebrahimi A., McNatt M.W., Gregory D.A., Johnson M.C. and Bieniasz P.D. (2009) «Tetherin inhibits HIV-1 release by directly tethering virions to cells», Cell 139, 499—511
- ↑ Douglas JL, Gustin JK, Viswanathan K, Mansouri M, Moses AV, Früh K (2010) «The great escape: viral strategies to counter BST-2/tetherin», PLoS Pathogens 6(5):e1000913
- ↑ Kirchhoff F (2010) «Immune evasion and counteraction of restriction factors by HIV-1 and other primate lentiviruses», Cell Host and Microbe 8, 55-67
- ↑ Evans DT, Serra-Moreno R, Singh RK, Guatelli JC (2010) "BST-2/tetherin: a new component of the innate immune response to enveloped viruses ", Trends in Microbiology 18, 388—396
- ↑ Miyakawa K., Ryo A., Murakami T., Ohba K., Yamaoka S., Fukuda M., Guatelli J. and Yamamoto N. (2009) «BCA2/Rabring promotes tetherin-dependent HIV-1 restriction», PLoS Pathogens 5, e10000700
- ↑ Количество ВИЧ-инфицированных в России за 2006 год — Статистика — Федеральный Центр по профилактике и борьбе со СПИДом
- ↑ Центр профилактики и борьбы со СПИД — InfoSpid.Ru — Эпидситуация в РФ
- ↑ О состоянии эпидемии ВИЧ-инфекции в Российской Федерации
- ↑ Информационный бюллетень Федерального научно-методического центра профилактики и борьбы со СПИД и Федеральной службы государственной статистики
- ↑ День борьбы со СПИДом Россия встречает печальной статистикой. РИА Новости (1 декабря 2008). Дата обращения: 13 августа 2010. Архивировано 21 августа 2011 года.
- ↑ сновные статистические показатели в связи с ВИЧ-инфекцией в РФ (по итогам 2009 года)] (31 января 2011). Дата обращения: 31 января 2011. Архивировано 21 августа 2011 года.
- ↑ Светлана Бахмина в интервью «Арест был довольно спонтанный» вспоминала следующее о контингенте в исправительных учреждениях: «Много девочек, больных ВИЧ, почти все молодые, красивые и неглупые. Много из Москвы. Все наркоманки со стажем.»
- ↑ [2]
- ↑ Cooper ER, Charurat M, Mofenson L, Hanson IC, Pitt J, Diaz C, Hayani K, Handelsman E, Smeriglio V, Hoff R, Blattner W; Women and Infants' Transmission Study Group. Combination antiretroviral strategies for the treatment of pregnant HIV-1-infected women and prevention of perinatal HIV-1 transmission.
- ↑ AIDSinfo.nih.gov Recommendations for Use of Antiretroviral Drugs in Pregnant HIV-1-Infected Women for Maternal Health and Interventions to Reduce Perinatal HIV-1 Transmission in the United States October 12, 2006
- ↑ Малый В.П. ВИЧ. СПИД. Новейший медицинский справочник. — М.: Эксмо, 2009, c. 28
- ↑ Ученые: Широко распространенный химикат предохраняет обезьян от ВИЧ 1
- ↑ OPRC — Glossary
- ↑ http://www.ansar-nn.ru/poryadok-i-usloviya-okazaniya-yuridicheskoj-pomoshhi/
Литература
- Хаитов, Р.М. СПИД. — М.: Издательство Народной академии культуры и общечеловеческих ценностей, 1992. — ISBN 5-87416-012-4.
- Щелкунов С.Н. (1999). "Эпидемия СПИДа". Соросовский образовательный журнал. 11: 22—28.
- Малый В.П. ВИЧ. СПИД. Новейший медицинский справочник. — М.: Эксмо, 2009. — 672 с. — ISBN 978-5-699-31017-3.
- Levy J.A. HIV and the pathogenesis of AIDS. — USA: American Society for Microbiology, 2007. — 752 с. — ISBN 9781555813932.
- Денисов Б. П. (редактор-составитель). Демография ВИЧ. — МГУ. — Москва: МАКС Пресс, 2005. — 125 с. — ISBN 5-317-01450-6.
- Денисов Б. П. (редактор-составитель). Демография ВИЧ. — МГУ. — Москва: МАКС Пресс, 2009. — Т. вып. 2. — 130 с. — ISBN 978-5-317-02956-2.
- Федеральный Закон О предупреждении распространения в Российской Федерации заболевания, вызываемого вирусом иммунодефицита человека (ВИЧ-инфекции) (30 марта 1995). Дата обращения: 21 января 2011. Архивировано 21 августа 2011 года.
- Супотницкий М.В. Эволюционная патология. К вопросу о месте ВИЧ-инфекции и ВИЧ/СПИД-пандемии среди других инфекционных, эпидемических и пандемических процессов. — Москва: Вузовская книга, 2009. — 400 с. — ISBN 978-5-9502-0378-7.
См. также
- ТБ/ВИЧ: Клиническое руководство
- СПИД
- Анализ на ВИЧ
- Высокоактивная антиретровирусная терапия
- Объединённая программа Организации Объединённых Наций по ВИЧ/СПИД
- Фонд «Гуманитарное действие»
- Движение по отрицанию ВИЧ/СПИДа
- ACET — международная организация, занимающаяся профилактикой ВИЧ-инфекции
Ссылки
- ВИЧ-инфекция и СПИД в научном исследовании «Основы сексологии», проведённом основоположниками этой науки: У. Мастерс, В. Джонсон, Р. Колодни. Пер. с англ. - М.: Мир, 1998. - х + 692 с., ил. ISBN 5-03-003223-1.