Глиоксаль: различия между версиями
| [отпатрулированная версия] | [отпатрулированная версия] |
MSBOT (обсуждение | вклад) м r2.7.3) (робот добавил: fa:گلیوکسال |
|||
| Строка 112: | Строка 112: | ||
[[de:Glyoxal]] |
[[de:Glyoxal]] |
||
[[en:Glyoxal]] |
[[en:Glyoxal]] |
||
[[fa:گلیوکسال]] |
|||
[[fr:Éthanedial]] |
[[fr:Éthanedial]] |
||
[[hu:Glioxál]] |
[[hu:Glioxál]] |
||
Версия от 13:59, 15 апреля 2012
| Глиоксаль | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
этандиаль | ||
| Традиционные названия | щавелевый альдегид | ||
| Хим. формула | OCHCHO | ||
| Физические свойства | |||
| Состояние | жидкость | ||
| Молярная масса | 58,04 г/моль | ||
| Плотность | 1,27 г/см³ | ||
| Энергия ионизации | 10,1 эВ[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 15 °C | ||
| • кипения | 51 °C | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 600 г/100 мл | ||
| Оптические свойства | |||
| Показатель преломления | 1,3826 | ||
| Классификация | |||
| Рег. номер CAS | 107-22-2 | ||
| PubChem | 7860 | ||
| Рег. номер EINECS | 203-474-9 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 34779 | ||
| ChemSpider | 7572 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
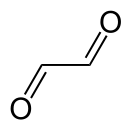
Глиоксаль — органическое соединение с формулой OCHCHO. Имеет вид желтой жидкости с запахом формалина. Является простейшим диальдегидом — веществом, содержащим две альдегидные группы.
Производство
В лаборатории глиоксаль получают окислением ацетальдегида селенистой кислотой.[2]
В промышленности глиоксаль получают двумя путями. Либо окислением в газовой фазе этиленгликоля в присутствии серебряного или медного катализатора, либо окислением в жидкой фазе ацетальдегида азотной кислотой. Более распространенным является окисление в газовой фазе.
Объем ежегодного производства составляет ~220,000 тонн.
Первое коммерческое производство началось в Lamotte, Франция, в 1960 и сейчас принадлежит Clariant. Единый большой производитель - BASF в Людвигсхафен-на-Рейне, Германия, с производительностью 60,000 тонн/год. Только два производства глиоксаля есть в Америке (Geismer, LA and Charlotte, NC). Значительное производство недавно началось в Китае. Коммерческий глиоксаль поставляется в виде 40% раствора. Единственное производство глиоксаля в России расположено в Томске на заводе "Новохим".
Получение безводного глиоксаля включает нагревание твёрдых глиоксаль гидратов с фосфора пентаоксидом и конденсация паров в охлаждаемой ловушке.
Химические свойства
Карбонильные группы глиоксаля обладают ярко выраженными электрофильными свойствами. С водой глиоксаль образует дигидрат, становясь из желтого бесцветным.
Под действием щелочи глиоксаль претерпевает внутримолекулярную реакцию Канниццаро, превращаясь в натриевую соль гликолевой кислоты.
В присутствии поташа на воздухе окисляется до родизоновой кислоты
Кислым раствором перманганата калия или перекисью водорода окисляется до муравьиной кислоты. Щелочным раствором перманганата калия до щавелевой кислоты. Гидрирование на палладии (Pd/C) даёт этиленгликоль. Со спиртами в присутствии кислоты получается моно- или диацетали. С мочевиной образует 4,5-дигидроксиимидазол (1) и глиоксальуреид(2).
Применение
Он используется для придания растворимости и как агент кросс-сочетания в химии полимеров:
- белков (процесс дубления кожи)
- коллаген
- производные целлюлозы (текстиль)
- гидроколлоиды
- крахмал (мелование бумаги)
Глиоксаль-текстильно-вспомогательное вещество, придающее несминаемость хлопчато-бумажным и вискозным материалам; гидрофобизирующий компонент составов для пропитки бумаги и кожи. Глиоксаль и глиоксальсульфат используются для получения кубовых красителей.[3]
Глиоксаль ценный строительный блок в органическом синтезе, особенно в синтезе гетероциклов таких как имидазол. Обычная форма этого реагента используемого в лабораториях - бис-полуацеталь с этиленгликолем 1,4-диоксан-2,3-диол. Он доступен коммерчески.
Поведение в растворе
Глиоксаль типично поставляется в виде 40% водного раствора. Как и другие младшие альдегиды, глиоксаль образует гидраты. Более того, гидраты конденсируются образуя серии олигомеров, структуры которых остаются неизвестными. Для большинства применений точное знание об этих олигомерах не имеет значения. По крайней два типа гидратов доступны коммерчески и являются твёрдыми веществами.
- глиоксаль димер, дигидрат: [(CHO)2]2(H2O)2, 1,4-диоксан-транс-2,3-diol (CAS# 4845-50-5, т.пл. 91-95 C)
- глиоксаль тример, дигидрат: [(CHO)2]3(H2O)2 (CAS# 4405-13-4). Не гигроскопичен.
Установлено что, при концентрации меньшей 1М, глиоксаль существует в основном как мономер или его гидрат, OCHCHO, OCHCH(OH)2, or (HO)2CHCH(OH)2.
При концентрации >1М, димер домининрует. Эти димеры скорее всего диоксоланы с формулой [(HO)CH]2O2CHCHO. Димер и тример может выпасть в осадок, из-за низкой растворимости ниже 15 °C.
Безопасность
Беречь от прямых солнечных лучей. Раздражает кожу. Операции проводить в вытяжном шкафу.
Примечания
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Методика в Organic Syntheses
- ↑ Химическая энциклопедия, Т1, 1988, "Сов. энциклопедия", стр. 583
Это заготовка статьи об органическом веществе. Помогите Википедии, дополнив её. |