Убиквитин: различия между версиями
| [непроверенная версия] | [отпатрулированная версия] |
Исправлено правописание Метка: через мобильное приложение |
OpossumK (обсуждение | вклад) викификация, оформление, стилевые правки, уточнение |
||
| Строка 1: | Строка 1: | ||
{{Pfam_box |
{{Pfam_box |
||
| Symbol = ubiquitin |
| Symbol = ubiquitin |
||
| Name = |
| Name = Убиквитин |
||
| image = Ubiquitin cartoon-2-.png |
| image = Ubiquitin cartoon-2-.png |
||
| width = |
| width = |
||
| caption = ''' |
| caption = '''Структура убиквитина'''. Боковые цепи семи остатков [[лизин]]а показаны жёлтым |
||
| Pfam= PF00240 |
| Pfam= PF00240 |
||
| InterPro= IPR000626 |
| InterPro= IPR000626 |
||
| Строка 41: | Строка 41: | ||
{{PDB3|2bf8}}B:25-95 {{PDB3|1l2n}}A:27-96 {{PDB3|1euv}}B:27-96 |
{{PDB3|2bf8}}B:25-95 {{PDB3|1l2n}}A:27-96 {{PDB3|1euv}}B:27-96 |
||
}} |
}} |
||
'''Убиквити́н''' (от {{lang-en|ubiquitous}} — ''вездесущий'') — небольшой (8.5 [[Атомная единица массы| |
'''Убиквити́н''' (от {{lang-en|ubiquitous}} — ''вездесущий'') — небольшой (8.5 [[Атомная единица массы|кДа]]) [[Консервативные последовательности|консервативный]] [[белки|белок]] [[эукариоты|эукариот]], участвующий в [[Регуляторная функция белков|регуляции]] процессов внутриклеточной деградации других белков, а также их функций. Он присутствует почти во всех тканях [[Многоклеточный организм|многоклеточных]] эукариот, а также у [[Одноклеточные организмы|одноклеточных]] эукариотических организмов. Убиквитин был открыт в 1975 году [[Голдштейн, Гидеон|Гидеоном Голдштейном]] с соавторами<ref name="pmid1078892"/> и охарактеризован в 70—80-х годах XX века<ref name="pmid16230621">{{cite journal |author=Wilkinson KD |title=The discovery of ubiquitin-dependent proteolysis |journal=Proc. Natl. Acad. Sci. U.S.A. |volume=102 |issue=43 |pages=15280–2 |date=October 2005 |pmid=16230621 |pmc=1266097 |doi=10.1073/pnas.0504842102 |url=}}</ref>. В [[геном человека|геноме человека]] есть четыре [[ген]]а, кодирующих убиквитин: [[Ubiquitin B|UBB]], [[Ubiquitin C|UBC]], [[Ubiquitin A-52 residue ribosomal protein fusion product 1|UBA52]] и [[RPS27A]]<ref name="pmid20418328"/>. |
||
Убиквитинирование — это [[посттрансляционная модификация|посттрансляционное]] присоединение [[фермент]]ами [[ |
'''''Убиквитинирование''''' — это [[посттрансляционная модификация|посттрансляционное]] присоединение [[фермент]]ами [[убиквитинлигаза]]ми одного или нескольких [[мономер]]ов убиквитина с помощью [[ковалентная связь|ковалентной связи]] к боковым [[аминогруппа]]м белка-мишени. Присоединение убиквитина может оказывать различное воздействие на белки-мишени: оно влияет на [[Внутриклеточная сортировка белков|внутриклеточную локализацию]], оказывает воздействие на их активность, способствует или препятствует [[белок-белковые взаимодействия|белок-белковым взаимодействиям]]<ref name="pmid11917093"/><ref name="pmid17218518"/><ref name="pmid12860974"/>. Однако первой открытой функцией убиквитина стала [[протеолиз|протеолитическая деградация]] белков, помеченных полиубиквитиновыми цепями (в них последующие убиквитиновые звенья присоединяются к боковым аминогруппам предыдущей молекулы убиквитина), с помощью 26S [[протеасома|протеасомы]]. Убиквитин регулирует и такие важные процессы, как [[пролиферация]], развитие и [[дифференцировка клеток]], реакция на [[стресс]] и [[патоген]]ы, [[репарация ДНК]]. |
||
В 2004 |
В 2004 году [[Чехановер, Аарон|Аарон Чехановер]], [[Гершко, Аврам|Аврам Гершко]] и [[Роуз, Ирвин|Ирвин Роуз]] были удостоены [[Нобелевская премия по химии|Нобелевской премии по химии]] «за открытие убиквитин-опосредованной деградации белка»<ref>[http://www.lenta.ru/science/2004/10/06/nobel/ Lenta.ru: Прогресс: Нобелевскую премию по химии получили израильтяне и американец за исследования белков<!-- Заголовок добавлен ботом -->]</ref>. |
||
==История открытия== |
|||
==Идентификация== |
|||
[[Image:Ubiquitin 1UBQ surface.png|thumb|220px|3D-представление поверхности молекулы убиквитина]] |
[[Image:Ubiquitin 1UBQ surface.png|thumb|220px|3D-представление поверхности молекулы убиквитина]] |
||
Убиквитин (первоначально названный '''ubiquitous immunopoietic polypeptide''' |
Убиквитин (первоначально названный '''ubiquitous immunopoietic polypeptide''' — '''повсеместно встречающийся полипептид, ответственный за иммунопоэз''') впервые был идентифицирован в 1975 году<ref name="pmid1078892">{{cite journal |author=Goldstein G, Scheid M, Hammerling U, Schlesinger DH, Niall HD, Boyse EA |title=Isolation of a polypeptide that has lymphocyte-differentiating properties and is probably represented universally in living cells |journal=Proc. Natl. Acad. Sci. U.S.A. |volume=72 |issue=1 |pages=11–5 |date=January 1975 |pmid=1078892 |pmc=432229 |doi= 10.1073/pnas.72.1.11|url=}}</ref> как белок с неизвестной функцией, имеющий массу 8.5 кДа и присутствующий во всех эукариотических клетках. |
||
== Гены убиквитина == |
== Гены убиквитина == |
||
У млекопитающих (в том числе, у человека) есть 4 различных гена, кодирующих убиквитин. Каждый из генов [[Ubiquitin A-52 residue ribosomal protein fusion product 1|UBA52]] и [[RPS27A]] кодирует единичную копию убиквитина |
У млекопитающих (в том числе, у человека) есть 4 различных гена, кодирующих убиквитин. Каждый из генов [[Ubiquitin A-52 residue ribosomal protein fusion product 1|UBA52]] и [[RPS27A]] кодирует единичную копию убиквитина в составе полибелка (полипептида, состоящего из предшественников нескольких белков, которые впоследствии разделяются в результате [[Ограниченный протеолиз|ограниченного протеолиза]] перемычек между ними): продукт гена UBA52 первоначально синтезируется как убиквитин, «пришитый» к [[Рибосома|рибосомному]] белку L40, а продукт гена RPS27A как убиквитин, «пришитый» к S27a. Гены [[Ubiquitin B|UBB]] и [[Ubiquitin C|UBC]] кодируют несколько копий убиквитина в составе полибелков-предшественников<ref name="pmid20418328">{{cite journal| author=Kimura Y, Tanaka K| title=Regulatory mechanisms involved in the control of ubiquitin homeostasis | journal=J Biochem | year= 2010 | volume= 147 | issue= 6 | pages= 793–8 | pmid=20418328 | doi=10.1093/jb/mvq044 }}</ref>. |
||
== Убиквитинирование == |
== Убиквитинирование == |
||
[[Image:Ubiquitylation.svg|thumb|right|300px|Убиквитинирующая ферментная система (на схеме показана лигаза E3, содержащая RING-домен) |
[[Image:Ubiquitylation.svg|thumb|right|300px|Убиквитинирующая ферментная система (на схеме показана лигаза E3, содержащая RING-домен)]] |
||
Убиквитинирование (также известное как убиквитилирование) |
Убиквитинирование (также известное как убиквитилирование) — это ферментативная [[посттрансляционная модификация]] (ПТМ), заключающаяся в присоединении убиквитина к белковому [[Субстрат (биохимия)|субстрату]]. Чаще всего присоединение происходит с образованием изопептидной связи между карбоксильной группой последнего [[Аминокислоты|аминокислотного остатка]] убиквитина ([[глицин]]-76) и аминогруппой боковой цепи остатка [[лизин]]а белка-субстрата. |
||
==Разнообразие убиквитиновых модификаций== |
==Разнообразие убиквитиновых модификаций== |
||
Убиквитинирование |
Убиквитинирование влияет на клеточные процессы, регулируя деградацию белков (через протеасомы и лизосомы), координируя {{не переведено 3|субклеточная локализация|субклеточную локализацию||Subcellular localization}} белков, их активацию и инактивацию и модулируя [[белок-белковые взаимодействия]]<ref name="pmid11917093">{{cite journal|author=Glickman MH, Ciechanover A |title=The ubiquitin-proteasome proteolytic pathway: destruction for the sake of construction |journal=Physiol. Rev. |volume=82 |issue=2 |pages=373–428 |date=April 2002 |pmid=11917093|doi=10.1152/physrev.00027.2001 |url=}}</ref><ref name="pmid17218518">{{cite journal |author=Mukhopadhyay D, Riezman H|title=Proteasome-independent functions of ubiquitin in endocytosis and signaling |journal=Science |volume=315|issue=5809 |pages=201–5 |date=January 2007 |pmid=17218518 |doi=10.1126/science.1127085 |url=}}</ref><ref name="pmid12860974">{{cite journal |author=Schnell JD, Hicke L |title=Non-traditional functions of ubiquitin and ubiquitin-binding proteins |journal=J. Biol. Chem. |volume=278 |issue=38 |pages=35857–60 |date=September 2003|pmid=12860974 |doi=10.1074/jbc.R300018200 |url=}}</ref>. Эти воздействия опосредуются различными типами убиквитинирования белков-субстратов, например, присоединением к субстрату единственной молекулы убиквитина (моноубиквитинирование) или присоединением разнообразных убиквитиновых цепочек (полиубиквитинирование)<ref name="pmid19754430"/>. |
||
===Моноубиквитинирование=== |
===Моноубиквитинирование=== |
||
Моноубиквитинирование |
'''''Моноубиквитинирование''''' — это присоединение одной молекулы убиквитина к белку-субстрату. '''''Множественное моноубиквитинирование''''' (мультиубиквитинирование) — это присоединение нескольких одиночных молекул убиквитина к отдельным остаткам лизина в белке-субстрате. Моноубиквитинирование и полиубиквитинирование одних и тех же белков может иметь для них различные последствия. Считается, что перед образованием полиубиквитиновых цепочек необходимо присоединить единственную молекулу убиквитина<ref name="pmid19754430">{{cite journal |author=Komander D |title=The emerging complexity of protein ubiquitination |journal=Biochem. Soc. Trans. |volume=37 |issue=Pt 5|pages=937–53 |date=October 2009 |pmid=19754430 |doi=10.1042/BST0370937 |url=}}</ref>. |
||
===Полиубиквитинирование=== |
|||
===Полиубиквитиновые цепочки=== |
|||
[[File:diubiquitin-lysine-48.png|thumb|''' |
[[File:diubiquitin-lysine-48.png|thumb|'''Диубиквитин, образованный присоединением C-концевого остатка глицина к остатку лизина-48'''. Оранжевым цветом обозначена связь между двумя убиквитиновыми цепочками]] |
||
[[File:diubiquitin-lysine-63.png|thumb|''' |
[[File:diubiquitin-lysine-63.png|thumb|'''Диубиквитин, образованный присоединением C-концевого остатка глицина к остатку лизина-63'''. Оранжевым цветом обозначена связь между двумя убиквитиновыми цепочками]] |
||
Полиубиквитинирование |
'''''Полиубиквитинирование''''' — это образование полиубиквитиновых цепочек на единственном остатке лизина белка-субстрата. После присоединения самого первого остатка убиквитина к белку-субстрату следующие молекулы убиквитина могут присоединяться к первой; в результате образуется полиубиквитиновая цепочка<ref name="pmid19754430"/>. Эти цепочки формируются посредством образования изопептидной связи между карбоксильной группой С-концевого остатка глицина одной молекулы убиквитина и аминогруппой другой молекулы убиквитина, уже связанной с белком-субстратом. Убиквитин имеет семь остатков лизина и [[N-конец]], которые могут служить точками присоединения последующих молекул убиквитина: это остатки лизина в положениях K6, K11, K27, K29, K33, K48 и K63. |
||
Первыми были идентифицированы и поэтому лучше остальных охарактеризованы полиубиквитиновые цепочки, образованные связями с остатками лизина-48. Цепочки, связанные через лизин-63 также достаточно полно охарактеризованы, в то время как функция цепочек, связанных через другие остатки лизина, смешанных и разветвлённых цепочек, N-терминальных линейных цепочек и гетерологичных цепочек (состоящих из убиквитина вперемежку с другими убиквитин-подобными белками) остаётся не вполне ясной<ref name="pmid19754430"/><ref name="pmid12872131">{{cite journal | author = Peng J, Schwartz D, Elias JE, Thoreen CC, Cheng D, Marsischky G, Roelofs J, Finley D, Gygi SP | title = A proteomics approach to understanding protein ubiquitination | journal = Nat. Biotechnol. | volume = 21 | issue = 8 | pages = 921–6 |date=August 2003 | pmid = 12872131 | doi = 10.1038/nbt849 }}</ref><ref name="pmid18516089"/><ref name="pmid18351785">{{cite journal | author = Xu P, Peng J | title = Characterization of polyubiquitin chain structure by middle-down mass spectrometry | journal = Anal. Chem. | volume = 80 | issue = 9 | pages = 3438–44 |date=May 2008 | pmid = 18351785 | pmc = 2663523 | doi = 10.1021/ac800016w }}</ref><ref name="pmid17006537">{{cite journal | author = Kirisako T, Kamei K, Murata S, Kato M, Fukumoto H, Kanie M, Sano S, Tokunaga F, Tanaka K, Iwai K | title = A ubiquitin ligase complex assembles linear polyubiquitin chains | journal = EMBO J. | volume = 25 | issue = 20 | pages = 4877–87 |date=October 2006 | pmid = 17006537 | pmc = 1618115 | doi = 10.1038/sj.emboj.7601360 }}</ref> |
Первыми были идентифицированы, и поэтому лучше остальных охарактеризованы, полиубиквитиновые цепочки, образованные связями с остатками лизина-48. Цепочки, связанные через лизин-63, также достаточно полно охарактеризованы, в то время как функция цепочек, связанных через другие остатки лизина, смешанных и разветвлённых цепочек, N-терминальных линейных цепочек и гетерологичных цепочек (состоящих из убиквитина вперемежку с другими убиквитин-подобными белками) остаётся не вполне ясной<ref name="pmid19754430"/><ref name="pmid12872131">{{cite journal | author = Peng J, Schwartz D, Elias JE, Thoreen CC, Cheng D, Marsischky G, Roelofs J, Finley D, Gygi SP | title = A proteomics approach to understanding protein ubiquitination | journal = Nat. Biotechnol. | volume = 21 | issue = 8 | pages = 921–6 |date=August 2003 | pmid = 12872131 | doi = 10.1038/nbt849 }}</ref><ref name="pmid18516089"/><ref name="pmid18351785">{{cite journal | author = Xu P, Peng J | title = Characterization of polyubiquitin chain structure by middle-down mass spectrometry | journal = Anal. Chem. | volume = 80 | issue = 9 | pages = 3438–44 |date=May 2008 | pmid = 18351785 | pmc = 2663523 | doi = 10.1021/ac800016w }}</ref><ref name="pmid17006537">{{cite journal | author = Kirisako T, Kamei K, Murata S, Kato M, Fukumoto H, Kanie M, Sano S, Tokunaga F, Tanaka K, Iwai K | title = A ubiquitin ligase complex assembles linear polyubiquitin chains | journal = EMBO J. | volume = 25 | issue = 20 | pages = 4877–87 |date=October 2006 | pmid = 17006537 | pmc = 1618115 | doi = 10.1038/sj.emboj.7601360 }}</ref>. |
||
При помощи полиубиквитиновых цепочек, образованных связью через |
При помощи полиубиквитиновых цепочек, образованных связью через остаток лизина-48, помечаются белки-мишени, подлежащие протеолитическому распаду. |
||
Полиубиквитиновые цепочки, образованные связью через остаток лизина-63, не связаны с протеасомальной деградацией белка-субстрата. Напротив, эти полиубиквитиновые цепочки играют ключевую роль в координации других процессов, таких как [[направленный эндоцитоз]], [[воспаление]], [[трансляция (биология)|трансляция]] и [[репарация ДНК]]<ref name="pmid17609522">{{cite journal |author=Miranda M, Sorkin A|title=Regulation of receptors and transporters by ubiquitination: new insights into surprisingly similar mechanisms|journal=Mol. Interv. |volume=7 |issue=3 |pages=157–67 |date=June 2007 |pmid=17609522 |doi=10.1124/mi.7.3.7|url=}}</ref>. |
Полиубиквитиновые цепочки, образованные связью через остаток лизина-63, не связаны с протеасомальной деградацией белка-субстрата. Напротив, эти полиубиквитиновые цепочки играют ключевую роль в координации других процессов, таких как [[направленный эндоцитоз]], [[воспаление]], [[трансляция (биология)|трансляция]] и [[репарация ДНК]]<ref name="pmid17609522">{{cite journal |author=Miranda M, Sorkin A|title=Regulation of receptors and transporters by ubiquitination: new insights into surprisingly similar mechanisms|journal=Mol. Interv. |volume=7 |issue=3 |pages=157–67 |date=June 2007 |pmid=17609522 |doi=10.1124/mi.7.3.7|url=}}</ref>. |
||
Меньше известно об атипичных полиубиквитиновых цепочках (не связанных через остатки лизина-48), но начато исследование, направленное на изучение их роли в клетках<ref name="pmid18516089">{{cite journal | author = Ikeda F, Dikic I | title = Atypical ubiquitin chains: new molecular signals. 'Protein Modifications: Beyond the Usual Suspects' review series | journal = EMBO Rep. | volume = 9 | issue = 6 | pages = 536–42 |date=June 2008 | pmid = 18516089 | pmc = 2427391 | doi = 10.1038/embor.2008.93 }}</ref>. Имеются свидетельства, подтверждающие, что атипичные цепочки, образованные связью через остатки лизина |
Меньше известно об атипичных полиубиквитиновых цепочках (не связанных через остатки лизина-48), но начато исследование, направленное на изучение их роли в клетках<ref name="pmid18516089">{{cite journal | author = Ikeda F, Dikic I | title = Atypical ubiquitin chains: new molecular signals. 'Protein Modifications: Beyond the Usual Suspects' review series | journal = EMBO Rep. | volume = 9 | issue = 6 | pages = 536–42 |date=June 2008 | pmid = 18516089 | pmc = 2427391 | doi = 10.1038/embor.2008.93 }}</ref>. Имеются свидетельства, подтверждающие, что атипичные цепочки, образованные связью через остатки лизина 6, 11, 27, 29, и [[N-конец|N-терминальные цепочки]] могут индуцировать протеасомальную деградацию белков<ref name="pmid22389393">{{cite journal |author=Kravtsova-Ivantsiv Y, Ciechanover A |title=Non-canonical ubiquitin-based signals for proteasomal degradation |journal=J. Cell. Sci.|volume=125 |issue=Pt 3 |pages=539–48 |date=February 2012 |pmid=22389393 |doi=10.1242/jcs.093567 |url=}}</ref><ref name="pmid20385835"/>. |
||
Известно о существовании разветвлённых полиубиквитиновых цепочек, содержащих связи многих типов<ref name="pmid17426036">{{cite journal | author = Kim HT, Kim KP, Lledias F, Kisselev AF, Scaglione KM, Skowyra D, Gygi SP, Goldberg AL | title = Certain pairs of ubiquitin-conjugating enzymes (E2s) and ubiquitin-protein ligases (E3s) synthesize nondegradable forked ubiquitin chains containing all possible isopeptide linkages | journal = J. Biol. Chem. | volume = 282 | issue = 24 | pages = 17375–86 |date=June 2007 | pmid = 17426036 | doi = 10.1074/jbc.M609659200 }}</ref>. Функция этих цепочек неизвестна<ref name="pmid22524316"/>. |
|||
===Структура полиубиквитиновых цепочек=== |
===Структура полиубиквитиновых цепочек=== |
||
Полиубиквитиновые цепочки, образованные связями различных типов, оказывают специфичное влияние на белки, к которым присоединены |
Полиубиквитиновые цепочки, образованные связями различных типов, оказывают специфичное влияние на белки, к которым они присоединены. Специфика этого влияния обусловлена различиями в конформации белковых цепочек. Полиубиквитиновые цепочки, образованные связями через остатки лизина в положениях 29, 33<ref name="pmid25752577">{{cite journal |author=Michel MA, Elliot PR, Swatek KN, et al. |title=Assembly and Specific Recognition of K29- and K33-Linked Polyubiquitin |journal=Mol Cell |volume=|issue=|pages= |date=|pmid= 25752577 |pmc=|doi=10.1016/j.molcel.2015.01.042 |url=}}</ref>, 63, и N-терминальные цепочки, по большей части, имеют линейную структуру, известную как «цепочки открытой конформации» (open-conformation chains). Цепочки, образованные связями через остатки K6, K11 и K48, образуют закрытую конформацию (closed conformations). Молекулы убиквитина в линейных цепочках не взаимодействуют друг с другом, за исключением соединяющих их ковалентных {{не переведено 3|изопептидная связь|изопептидных связей||isopeptide bond}}. Напротив, цепочки с закрытой конформацией имеют на своей поверхности остатки аминокислот, способные взаимодействовать друг с другом. При изменении конформации полиубиквитиновых цепочек одни части молекул убиквитина выставляются наружу, а другие скрываются внутри глобул, поэтому различные связи распознаются белками, специфичными по отношению к уникальным [[топология]]м, характерным для данных связей. Белки, связывающие убиквитин, имеют [[убиквитинсвязывающие домены]] ({{lang-en|Ubiquitin Binding Domains}}, UBDs). Расстояния между отдельными субъединицами убиквитина в цепочках, образованных связями через лизин-48, и в цепочках, связанных через лизин-63, отличаются друг от друга. Убиквитинсвязывающие белки используют это свойство, чтобы различать разные типы цепочек: более короткие спейсеры между {{не переведено 3|взаимодействующий с убиквитином мотив|мотивами, взаимодействующими с убиквитином, ||ubiquitin-interacting motif}} позволяют связывать лизин-48-связанные (компактные) полиубиквитиновые цепочки, а более длинные — лизин-63-связанные. Существуют механизмы различения линейных цепочек, связанных через лизин-63, и линейных [[N-конец|N-терминальными цепочек]], о чём свидетельствует тот факт, что линейные N-терминальные цепочки могут индуцировать протеасомальную деградацию белков-субстратов<ref name="pmid17609522"/><ref name="pmid20385835">{{cite journal |author=Zhao S, Ulrich HD |title=Distinct consequences of posttranslational modification by linear versus K63-linked polyubiquitin chains |journal=Proc. Natl. Acad. Sci. U.S.A. |volume=107 |issue=17 |pages=7704–9 |date=April 2010 |pmid=20385835 |pmc=2867854 |doi=10.1073/pnas.0908764107 |url=}}</ref><ref name="pmid22524316">{{cite journal |author=Komander D, Rape M |title=The ubiquitin code |journal=Annu. Rev. Biochem. |volume=81 |issue= |pages=203–29 |year=2012 |pmid=22524316|doi=10.1146/annurev-biochem-060310-170328 |url=}}</ref>. |
||
{| cellpadding=10 |
{| cellpadding=10 |
||
Версия от 16:08, 6 мая 2016
| Убиквитин | |
|---|---|
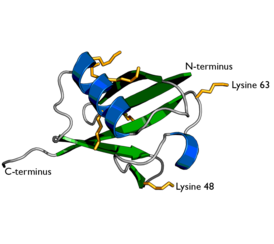 Структура убиквитина. Боковые цепи семи остатков лизина показаны жёлтым | |
| Идентификаторы | |
| Символ | ubiquitin |
| Pfam | PF00240 |
| InterPro | IPR000626 |
| PROSITE | PDOC00271 |
| SCOP | 1aar |
| SUPERFAMILY | 1aar |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
Убиквити́н (от англ. ubiquitous — вездесущий) — небольшой (8.5 кДа) консервативный белок эукариот, участвующий в регуляции процессов внутриклеточной деградации других белков, а также их функций. Он присутствует почти во всех тканях многоклеточных эукариот, а также у одноклеточных эукариотических организмов. Убиквитин был открыт в 1975 году Гидеоном Голдштейном с соавторами[1] и охарактеризован в 70—80-х годах XX века[2]. В геноме человека есть четыре гена, кодирующих убиквитин: UBB, UBC, UBA52 и RPS27A[3].
Убиквитинирование — это посттрансляционное присоединение ферментами убиквитинлигазами одного или нескольких мономеров убиквитина с помощью ковалентной связи к боковым аминогруппам белка-мишени. Присоединение убиквитина может оказывать различное воздействие на белки-мишени: оно влияет на внутриклеточную локализацию, оказывает воздействие на их активность, способствует или препятствует белок-белковым взаимодействиям[4][5][6]. Однако первой открытой функцией убиквитина стала протеолитическая деградация белков, помеченных полиубиквитиновыми цепями (в них последующие убиквитиновые звенья присоединяются к боковым аминогруппам предыдущей молекулы убиквитина), с помощью 26S протеасомы. Убиквитин регулирует и такие важные процессы, как пролиферация, развитие и дифференцировка клеток, реакция на стресс и патогены, репарация ДНК.
В 2004 году Аарон Чехановер, Аврам Гершко и Ирвин Роуз были удостоены Нобелевской премии по химии «за открытие убиквитин-опосредованной деградации белка»[7].
История открытия

Убиквитин (первоначально названный ubiquitous immunopoietic polypeptide — повсеместно встречающийся полипептид, ответственный за иммунопоэз) впервые был идентифицирован в 1975 году[1] как белок с неизвестной функцией, имеющий массу 8.5 кДа и присутствующий во всех эукариотических клетках.
Гены убиквитина
У млекопитающих (в том числе, у человека) есть 4 различных гена, кодирующих убиквитин. Каждый из генов UBA52 и RPS27A кодирует единичную копию убиквитина в составе полибелка (полипептида, состоящего из предшественников нескольких белков, которые впоследствии разделяются в результате ограниченного протеолиза перемычек между ними): продукт гена UBA52 первоначально синтезируется как убиквитин, «пришитый» к рибосомному белку L40, а продукт гена RPS27A как убиквитин, «пришитый» к S27a. Гены UBB и UBC кодируют несколько копий убиквитина в составе полибелков-предшественников[3].
Убиквитинирование

Убиквитинирование (также известное как убиквитилирование) — это ферментативная посттрансляционная модификация (ПТМ), заключающаяся в присоединении убиквитина к белковому субстрату. Чаще всего присоединение происходит с образованием изопептидной связи между карбоксильной группой последнего аминокислотного остатка убиквитина (глицин-76) и аминогруппой боковой цепи остатка лизина белка-субстрата.
Разнообразие убиквитиновых модификаций
Убиквитинирование влияет на клеточные процессы, регулируя деградацию белков (через протеасомы и лизосомы), координируя субклеточную локализацию[англ.] белков, их активацию и инактивацию и модулируя белок-белковые взаимодействия[4][5][6]. Эти воздействия опосредуются различными типами убиквитинирования белков-субстратов, например, присоединением к субстрату единственной молекулы убиквитина (моноубиквитинирование) или присоединением разнообразных убиквитиновых цепочек (полиубиквитинирование)[8].
Моноубиквитинирование
Моноубиквитинирование — это присоединение одной молекулы убиквитина к белку-субстрату. Множественное моноубиквитинирование (мультиубиквитинирование) — это присоединение нескольких одиночных молекул убиквитина к отдельным остаткам лизина в белке-субстрате. Моноубиквитинирование и полиубиквитинирование одних и тех же белков может иметь для них различные последствия. Считается, что перед образованием полиубиквитиновых цепочек необходимо присоединить единственную молекулу убиквитина[8].
Полиубиквитинирование


Полиубиквитинирование — это образование полиубиквитиновых цепочек на единственном остатке лизина белка-субстрата. После присоединения самого первого остатка убиквитина к белку-субстрату следующие молекулы убиквитина могут присоединяться к первой; в результате образуется полиубиквитиновая цепочка[8]. Эти цепочки формируются посредством образования изопептидной связи между карбоксильной группой С-концевого остатка глицина одной молекулы убиквитина и аминогруппой другой молекулы убиквитина, уже связанной с белком-субстратом. Убиквитин имеет семь остатков лизина и N-конец, которые могут служить точками присоединения последующих молекул убиквитина: это остатки лизина в положениях K6, K11, K27, K29, K33, K48 и K63. Первыми были идентифицированы, и поэтому лучше остальных охарактеризованы, полиубиквитиновые цепочки, образованные связями с остатками лизина-48. Цепочки, связанные через лизин-63, также достаточно полно охарактеризованы, в то время как функция цепочек, связанных через другие остатки лизина, смешанных и разветвлённых цепочек, N-терминальных линейных цепочек и гетерологичных цепочек (состоящих из убиквитина вперемежку с другими убиквитин-подобными белками) остаётся не вполне ясной[8][9][10][11][12].
При помощи полиубиквитиновых цепочек, образованных связью через остаток лизина-48, помечаются белки-мишени, подлежащие протеолитическому распаду.
Полиубиквитиновые цепочки, образованные связью через остаток лизина-63, не связаны с протеасомальной деградацией белка-субстрата. Напротив, эти полиубиквитиновые цепочки играют ключевую роль в координации других процессов, таких как направленный эндоцитоз, воспаление, трансляция и репарация ДНК[13].
Меньше известно об атипичных полиубиквитиновых цепочках (не связанных через остатки лизина-48), но начато исследование, направленное на изучение их роли в клетках[10]. Имеются свидетельства, подтверждающие, что атипичные цепочки, образованные связью через остатки лизина 6, 11, 27, 29, и N-терминальные цепочки могут индуцировать протеасомальную деградацию белков[14][15].
Известно о существовании разветвлённых полиубиквитиновых цепочек, содержащих связи многих типов[16]. Функция этих цепочек неизвестна[17].
Структура полиубиквитиновых цепочек
Полиубиквитиновые цепочки, образованные связями различных типов, оказывают специфичное влияние на белки, к которым они присоединены. Специфика этого влияния обусловлена различиями в конформации белковых цепочек. Полиубиквитиновые цепочки, образованные связями через остатки лизина в положениях 29, 33[18], 63, и N-терминальные цепочки, по большей части, имеют линейную структуру, известную как «цепочки открытой конформации» (open-conformation chains). Цепочки, образованные связями через остатки K6, K11 и K48, образуют закрытую конформацию (closed conformations). Молекулы убиквитина в линейных цепочках не взаимодействуют друг с другом, за исключением соединяющих их ковалентных изопептидных связей[англ.]. Напротив, цепочки с закрытой конформацией имеют на своей поверхности остатки аминокислот, способные взаимодействовать друг с другом. При изменении конформации полиубиквитиновых цепочек одни части молекул убиквитина выставляются наружу, а другие скрываются внутри глобул, поэтому различные связи распознаются белками, специфичными по отношению к уникальным топологиям, характерным для данных связей. Белки, связывающие убиквитин, имеют убиквитинсвязывающие домены (англ. Ubiquitin Binding Domains, UBDs). Расстояния между отдельными субъединицами убиквитина в цепочках, образованных связями через лизин-48, и в цепочках, связанных через лизин-63, отличаются друг от друга. Убиквитинсвязывающие белки используют это свойство, чтобы различать разные типы цепочек: более короткие спейсеры между мотивами, взаимодействующими с убиквитином,[англ.] позволяют связывать лизин-48-связанные (компактные) полиубиквитиновые цепочки, а более длинные — лизин-63-связанные. Существуют механизмы различения линейных цепочек, связанных через лизин-63, и линейных N-терминальными цепочек, о чём свидетельствует тот факт, что линейные N-терминальные цепочки могут индуцировать протеасомальную деградацию белков-субстратов[13][15][17].
|
Литература
- Layfield, Rhonda. The Ubiquitin-Proteasome System. — London : Portland Press, 2005. — ISBN 9781855781535.
Примечания
- ↑ 1 2 Goldstein G, Scheid M, Hammerling U, Schlesinger DH, Niall HD, Boyse EA (January 1975). "Isolation of a polypeptide that has lymphocyte-differentiating properties and is probably represented universally in living cells". Proc. Natl. Acad. Sci. U.S.A. 72 (1): 11–5. doi:10.1073/pnas.72.1.11. PMC 432229. PMID 1078892.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Wilkinson KD (October 2005). "The discovery of ubiquitin-dependent proteolysis". Proc. Natl. Acad. Sci. U.S.A. 102 (43): 15280–2. doi:10.1073/pnas.0504842102. PMC 1266097. PMID 16230621.
- ↑ 1 2 Kimura Y, Tanaka K (2010). "Regulatory mechanisms involved in the control of ubiquitin homeostasis". J Biochem. 147 (6): 793–8. doi:10.1093/jb/mvq044. PMID 20418328.
- ↑ 1 2 Glickman MH, Ciechanover A (April 2002). "The ubiquitin-proteasome proteolytic pathway: destruction for the sake of construction". Physiol. Rev. 82 (2): 373–428. doi:10.1152/physrev.00027.2001. PMID 11917093.
- ↑ 1 2 Mukhopadhyay D, Riezman H (January 2007). "Proteasome-independent functions of ubiquitin in endocytosis and signaling". Science. 315 (5809): 201–5. doi:10.1126/science.1127085. PMID 17218518.
- ↑ 1 2 Schnell JD, Hicke L (September 2003). "Non-traditional functions of ubiquitin and ubiquitin-binding proteins". J. Biol. Chem. 278 (38): 35857–60. doi:10.1074/jbc.R300018200. PMID 12860974.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Lenta.ru: Прогресс: Нобелевскую премию по химии получили израильтяне и американец за исследования белков
- ↑ 1 2 3 4 Komander D (October 2009). "The emerging complexity of protein ubiquitination". Biochem. Soc. Trans. 37 (Pt 5): 937–53. doi:10.1042/BST0370937. PMID 19754430.
- ↑ Peng J, Schwartz D, Elias JE, Thoreen CC, Cheng D, Marsischky G, Roelofs J, Finley D, Gygi SP (August 2003). "A proteomics approach to understanding protein ubiquitination". Nat. Biotechnol. 21 (8): 921–6. doi:10.1038/nbt849. PMID 12872131.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ 1 2 Ikeda F, Dikic I (June 2008). "Atypical ubiquitin chains: new molecular signals. 'Protein Modifications: Beyond the Usual Suspects' review series". EMBO Rep. 9 (6): 536–42. doi:10.1038/embor.2008.93. PMC 2427391. PMID 18516089.
- ↑ Xu P, Peng J (May 2008). "Characterization of polyubiquitin chain structure by middle-down mass spectrometry". Anal. Chem. 80 (9): 3438–44. doi:10.1021/ac800016w. PMC 2663523. PMID 18351785.
- ↑ Kirisako T, Kamei K, Murata S, Kato M, Fukumoto H, Kanie M, Sano S, Tokunaga F, Tanaka K, Iwai K (October 2006). "A ubiquitin ligase complex assembles linear polyubiquitin chains". EMBO J. 25 (20): 4877–87. doi:10.1038/sj.emboj.7601360. PMC 1618115. PMID 17006537.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ 1 2 Miranda M, Sorkin A (June 2007). "Regulation of receptors and transporters by ubiquitination: new insights into surprisingly similar mechanisms". Mol. Interv. 7 (3): 157–67. doi:10.1124/mi.7.3.7. PMID 17609522.
- ↑ Kravtsova-Ivantsiv Y, Ciechanover A (February 2012). "Non-canonical ubiquitin-based signals for proteasomal degradation". J. Cell. Sci. 125 (Pt 3): 539–48. doi:10.1242/jcs.093567. PMID 22389393.
- ↑ 1 2 Zhao S, Ulrich HD (April 2010). "Distinct consequences of posttranslational modification by linear versus K63-linked polyubiquitin chains". Proc. Natl. Acad. Sci. U.S.A. 107 (17): 7704–9. doi:10.1073/pnas.0908764107. PMC 2867854. PMID 20385835.
- ↑ Kim HT, Kim KP, Lledias F, Kisselev AF, Scaglione KM, Skowyra D, Gygi SP, Goldberg AL (June 2007). "Certain pairs of ubiquitin-conjugating enzymes (E2s) and ubiquitin-protein ligases (E3s) synthesize nondegradable forked ubiquitin chains containing all possible isopeptide linkages". J. Biol. Chem. 282 (24): 17375–86. doi:10.1074/jbc.M609659200. PMID 17426036.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ 1 2 Komander D, Rape M (2012). "The ubiquitin code". Annu. Rev. Biochem. 81: 203–29. doi:10.1146/annurev-biochem-060310-170328. PMID 22524316.
- ↑ Michel MA, Elliot PR, Swatek KN; et al. "Assembly and Specific Recognition of K29- and K33-Linked Polyubiquitin". Mol Cell. doi:10.1016/j.molcel.2015.01.042. PMID 25752577.
{{cite journal}}: Явное указание et al. в:|author=(справка)Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка)