Имиды карбоновых кислот: различия между версиями
| [отпатрулированная версия] | [отпатрулированная версия] |
Kurgus (обсуждение | вклад) |
Kurgus (обсуждение | вклад) |
||
| Строка 3: | Строка 3: | ||
== Синтез == |
== Синтез == |
||
=== Ацилирование аммиака и аминов === |
|||
Ацилирование первичных аминов, аммиака или солей аммония является классическим и исторически первым методом синтеза циклических имидов из [[Ангидриды карбоновых кислот|ангидридов]] двухосновных кислот. Так, реакция [[Фталевый ангидрид|фталевого ангидрида]] с водным аммиаком ведет через образование аммонийной соли [[Фталевая кислота|фталевой кислоты]] к [[фталимид]]у с выходом 95–97%<ref>{{Cite journal| doi = 10.15227/orgsyn.002.0075| issn = 00786209|eissn = 23333553| volume = 2| pages = 75| title = PHTHALIMIDE| journal = Organic Syntheses| accessdate = 2020-09-11| date = 1922| url = http://orgsyn.org/demo.aspx?prep=CV1P0457}}</ref>: |
Ацилирование первичных аминов, аммиака или солей аммония является классическим и исторически первым методом синтеза циклических имидов из [[Ангидриды карбоновых кислот|ангидридов]] двухосновных кислот. Так, реакция [[Фталевый ангидрид|фталевого ангидрида]] с водным аммиаком ведет через образование аммонийной соли [[Фталевая кислота|фталевой кислоты]] к [[фталимид]]у с выходом 95–97%<ref>{{Cite journal| doi = 10.15227/orgsyn.002.0075| issn = 00786209|eissn = 23333553| volume = 2| pages = 75| title = PHTHALIMIDE| journal = Organic Syntheses| accessdate = 2020-09-11| date = 1922| url = http://orgsyn.org/demo.aspx?prep=CV1P0457}}</ref>: |
||
: [[Файл:Phthalimid Darstellung.svg|400 px]] |
: [[Файл:Phthalimid Darstellung.svg|400 px]] |
||
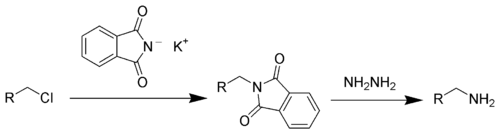
Аналогично синтезируют и [[сукцинимид]] из янтарного ангидрида<ref>{{Cite journal| doi = 10.15227/orgsyn.016.0075| issn = 00786209| issn = 23333553| volume = 16| pages = 75| title = SUCCINIMIDE| journal = Organic Syntheses| accessdate = 2020-09-11| date = 1936| url = http://orgsyn.org/demo.aspx?prep=CV2P0562}}</ref>, и N-алкилфталимиды<ref>{{Cite journal| doi = 10.15227/orgsyn.032.0018| issn = 00786209|eissn = 23333553| volume = 32| pages = 18| title = β-BROMOETHYLPHTHALIMIDE| journal = Organic Syntheses| accessdate = 2020-09-11| date = 1952| url = http://orgsyn.org/demo.aspx?prep=CV4P0106}}</ref>, и N-сукцинимиды<ref>{{Cite journal| doi = 10.1080/00397911.2016.1258479| issn = 0039-7911| volume = 47| issue = 3| pages = 217–223| last1 = Bozdoğan| first1 = Burcu| last2 = Erşatır| first2 = Mehmet| last3 = Demirkol| first3 = Onur| last4 = Akbaşlar| first4 = Dilek| last5 = Giray| first5 = E. Sultan| title = Simple and efficient synthesis of N-alkyl and N-aryl succinimides in hot water| journal = Synthetic Communications| accessdate = 2020-09-12| date = 2017-02-01| url = https://doi.org/10.1080/00397911.2016.1258479}} ([https://www.researchgate.net/publication/309965870_Simple_and_efficient_synthesis_of_N-alkyl_and_N-aryl_succinimides_in_hot_water Full text at ResearchGate)]</ref>. Синтез проходит в достаточно жестких условиях, при температурах 100-200 C на финальных стадиях. |
Аналогично синтезируют и [[сукцинимид]] из янтарного ангидрида<ref>{{Cite journal| doi = 10.15227/orgsyn.016.0075| issn = 00786209| issn = 23333553| volume = 16| pages = 75| title = SUCCINIMIDE| journal = Organic Syntheses| accessdate = 2020-09-11| date = 1936| url = http://orgsyn.org/demo.aspx?prep=CV2P0562}}</ref>, и N-алкилфталимиды<ref>{{Cite journal| doi = 10.15227/orgsyn.032.0018| issn = 00786209|eissn = 23333553| volume = 32| pages = 18| title = β-BROMOETHYLPHTHALIMIDE| journal = Organic Syntheses| accessdate = 2020-09-11| date = 1952| url = http://orgsyn.org/demo.aspx?prep=CV4P0106}}</ref>, и N-сукцинимиды<ref>{{Cite journal| doi = 10.1080/00397911.2016.1258479| issn = 0039-7911| volume = 47| issue = 3| pages = 217–223| last1 = Bozdoğan| first1 = Burcu| last2 = Erşatır| first2 = Mehmet| last3 = Demirkol| first3 = Onur| last4 = Akbaşlar| first4 = Dilek| last5 = Giray| first5 = E. Sultan| title = Simple and efficient synthesis of N-alkyl and N-aryl succinimides in hot water| journal = Synthetic Communications| accessdate = 2020-09-12| date = 2017-02-01| url = https://doi.org/10.1080/00397911.2016.1258479}} ([https://www.researchgate.net/publication/309965870_Simple_and_efficient_synthesis_of_N-alkyl_and_N-aryl_succinimides_in_hot_water Full text at ResearchGate)]</ref>. Синтез проходит в достаточно жестких условиях, при температурах 100-200 C на финальных стадиях. |
||
Для ацилирования аминов ангидридами в более мягких условиях используют катализ [[Кислота Льюиса|кислотами Льюиса]] |
Для ацилирования аминов ангидридами в более мягких условиях используют катализ [[Кислота Льюиса|кислотами Льюиса]]. |
||
=== Ацилирование амидов === |
|||
Амиды могут быть ацилированы до имидов различными ацилирующими агентами - хлорангидридами и ангидридами карбоновых кислот, сложными эфирами [[Енолы|енолов]] <ref>{{Cite journal| doi = 10.1021/jo01026a031| issn = 0022-3263| volume = 29| issue = 3| pages = 646–650| last1 = Rothman| first1 = Edward S.| last2 = Serota| first2 = Samuel| last3 = Swern| first3 = Daniel| title = Enol Esters. II.1a N-Acylation of Amides and Imides| journal = The Journal of Organic Chemistry| accessdate = 2020-09-12| date = 1964-03-01| url = https://doi.org/10.1021/jo01026a031}}</ref>. |
|||
Из-за пониженной нуклеофильности амидного по сравнению с аминным азота прямое ацилирование амидов ангидридами карбоновых кислот идет в жестких условиях (катализ серной кислотой при нагреве <ref>{{Cite web| title = Аненко Д. С., Кодониди И. П., Глушко А. А., Чиряпкин А. С., Смирнова Л. П., Ивч| work = bulletennauki| accessdate = 2020-09-12| url = https://www.bulletennauki.com/50-01}}</ref>), однако использование эфирата бромида магния в качестве активатора позволяет проводить ацилирование в более мягких условиях <ref>{{Cite journal| doi = 10.1016/S0040-4039(01)02208-0| issn = 0040-4039| volume = 43| issue = 4| pages = 647–651| last1 = Yamada| first1 = Shinji| last2 = Yaguchi| first2 = Setsuko| last3 = Matsuda| first3 = Kaori| title = N-Acylation of amides with acid anhydrides by way of dual activation using MgBr2·OEt2| journal = Tetrahedron Letters| accessdate = 2020-09-12| date = 2002-01-21| url = http://www.sciencedirect.com/science/article/pii/S0040403901022080}}</ref> |
|||
== Реакционная способность и химические свойства == |
== Реакционная способность и химические свойства == |
||
Версия от 06:46, 13 сентября 2020

Ими́ды карбо́новых кисло́т — соединения, содержащие группу -CO-NR-CO-, диацилпроизводные аммиака (R = H) или аминов[1]. Ациклические имиды — производные монокарбоновых кислот также называют диациламидами, большое значение в синтетической химии имеют циклические имиды дикарбоновых кислот.
Синтез
Ацилирование аммиака и аминов
Ацилирование первичных аминов, аммиака или солей аммония является классическим и исторически первым методом синтеза циклических имидов из ангидридов двухосновных кислот. Так, реакция фталевого ангидрида с водным аммиаком ведет через образование аммонийной соли фталевой кислоты к фталимиду с выходом 95–97%[2]:
Аналогично синтезируют и сукцинимид из янтарного ангидрида[3], и N-алкилфталимиды[4], и N-сукцинимиды[5]. Синтез проходит в достаточно жестких условиях, при температурах 100-200 C на финальных стадиях.
Для ацилирования аминов ангидридами в более мягких условиях используют катализ кислотами Льюиса.
Ацилирование амидов
Амиды могут быть ацилированы до имидов различными ацилирующими агентами - хлорангидридами и ангидридами карбоновых кислот, сложными эфирами енолов [6].
Из-за пониженной нуклеофильности амидного по сравнению с аминным азота прямое ацилирование амидов ангидридами карбоновых кислот идет в жестких условиях (катализ серной кислотой при нагреве [7]), однако использование эфирата бромида магния в качестве активатора позволяет проводить ацилирование в более мягких условиях [8]
Реакционная способность и химические свойства
Свойства и реакционная способность имидов сходны со свойствами амидов карбоновых кислот. Индуктивный эффект двух ацильных заместителей при атоме азота обуславливает большую кислотность атома водорода NH-группы, снижает нуклеофильность атомов азота и карбонильного кислорода, а также повышает электрофильность карбонильных атомов углерода ацильных групп по сравнению с амидами.
Реакции NH-группы
Имиды образуют соли со щелочными металлами, стабильные в спиртовых растворах, и которые легко алкилируются по атому азота алкилгалогенидами. Алкилирование калиевой соли фталимида алкилгалогенидами с последующим гидролизом образовавшегося N-алкилфталимида является классическим методом синтеза первичных аминов по Габриелю:
Имиды взаимодействуют с альдегидами и кетонами с образованием соответствующих аминокарбинолов:
- R'CONHCOR'' + R'''CHO R’CON(CHR'''OH)COR'
и в присутствии аминов вступают с ними в реакцию Манниха в качестве «кислотных» компонент:
- R’CONHCOR'' + CH2O + (CH3)2NH R'CON(CH2N(CH3)2)COR'
Имиды, подобно амидам, взаимодействуют с галогенами или гипогалогенитами с образованием N-галогенимидов, более стабильных, чем N-галогенамиды. Наиболее стабильны циклические N-галогенимиды, некоторые из которых (например, N-бромсукцинимид) используются в органическом синтезе в качестве источников галогена.
Циклические N-галогенимиды под действием оснований претерпевают перегруппировку Гофмана с образованием изоцианатов. Так, например, реакция фталимида с гипохлоритом в щелочной среде является промышленным методом синтеза антраниловой кислоты:
Реакции по карбонильной группе
Органические имиды широко применяют в синтезе гетероциклических соединений, аминов, аминокислот, пептидов.
Примечания
- ↑ imides // IUPAC Gold Book
- ↑ "PHTHALIMIDE". Organic Syntheses. 2: 75. 1922. doi:10.15227/orgsyn.002.0075. eISSN 2333-3553. ISSN 0078-6209. Дата обращения: 11 сентября 2020.
- ↑ "SUCCINIMIDE". Organic Syntheses. 16: 75. 1936. doi:10.15227/orgsyn.016.0075. ISSN 2333-3553. Дата обращения: 11 сентября 2020.
- ↑ "β-BROMOETHYLPHTHALIMIDE". Organic Syntheses. 32: 18. 1952. doi:10.15227/orgsyn.032.0018. eISSN 2333-3553. ISSN 0078-6209. Дата обращения: 11 сентября 2020.
- ↑ Bozdoğan, Burcu; Erşatır, Mehmet; Demirkol, Onur; Akbaşlar, Dilek; Giray, E. Sultan (2017-02-01). "Simple and efficient synthesis of N-alkyl and N-aryl succinimides in hot water". Synthetic Communications. 47 (3): 217—223. doi:10.1080/00397911.2016.1258479. ISSN 0039-7911. Дата обращения: 12 сентября 2020. (Full text at ResearchGate)
- ↑ Rothman, Edward S.; Serota, Samuel; Swern, Daniel (1964-03-01). "Enol Esters. II.1a N-Acylation of Amides and Imides". The Journal of Organic Chemistry. 29 (3): 646—650. doi:10.1021/jo01026a031. ISSN 0022-3263. Дата обращения: 12 сентября 2020.
- ↑ Аненко Д. С., Кодониди И. П., Глушко А. А., Чиряпкин А. С., Смирнова Л. П., Ивч. bulletennauki. Дата обращения: 12 сентября 2020.
- ↑ Yamada, Shinji; Yaguchi, Setsuko; Matsuda, Kaori (2002-01-21). "N-Acylation of amides with acid anhydrides by way of dual activation using MgBr2·OEt2". Tetrahedron Letters. 43 (4): 647—651. doi:10.1016/S0040-4039(01)02208-0. ISSN 0040-4039. Дата обращения: 12 сентября 2020.
Литература
- Имиды // Малый энциклопедический словарь Брокгауза и Ефрона. — 2-е изд., вновь перераб. и значит. доп. — Т. 1—2. — СПб., 1907—1909.
- Имиды кислот — статья из Большой советской энциклопедии.
Это заготовка статьи по органической химии. Помогите Википедии, дополнив её. |