Простой герпес: различия между версиями
| [непроверенная версия] | [непроверенная версия] |
| Строка 219: | Строка 219: | ||
== Эпидемиология == |
== Эпидемиология == |
||
Мировая распространённость вирусов простого герпеса колеблется между 65 % и 90 %.<ref name=Peds09>{{публикация|статья |заглавие=Herpes simplex |издание=Pediatric in Review |volume=30 |issue=4 |pages=119—129 |pmid=19339385 |doi=10.1542/pir.30-4-119 |язык=en |автор=Chayavichitsilp |автор имя=P. |автор2= Buckwalter |автор2 имя=J. V. |автор3= Krakowski |автор3 имя= A. C. |автор4=Friedlander |автор4 имя=S. F. |месяц=4 |год=2009}}</ref> HSV-1 встречается чаще, чем HSV-2, частота которого значительно увеличивается с возрастом.<ref name=Peds09/> Распространённость и частота возникновения инфекции определяется наличием вирусспецифических |
Мировая распространённость вирусов простого герпеса колеблется между 65 % и 90 %.<ref name=Peds09>{{публикация|статья |заглавие=Herpes simplex |издание=Pediatric in Review |volume=30 |issue=4 |pages=119—129 |pmid=19339385 |doi=10.1542/pir.30-4-119 |язык=en |автор=Chayavichitsilp |автор имя=P. |автор2= Buckwalter |автор2 имя=J. V. |автор3= Krakowski |автор3 имя= A. C. |автор4=Friedlander |автор4 имя=S. F. |месяц=4 |год=2009}}</ref> HSV-1 встречается чаще, чем HSV-2, частота которого значительно увеличивается с возрастом.<ref name=Peds09/> Распространённость и частота возникновения инфекции определяется наличием вирусспецифических антител у восприимчивых организмов.<ref name="pmid12353183">{{статья |заглавие=Age-specific prevalence of infection with herpes simplex virus types 2 and 1: a global review |издание=[[The Journal of Infectious Diseases]] |том=186 Suppl 1 |страницы=S3—28 |pmid=12353183 |ссылка=http://www.journals.uchicago.edu/doi/full/10.1086/343739 |doi=10.1086/343739 |язык=en |тип=journal |автор=Smith J.S., Robinson N.J. |год=2002}}</ref> |
||
К примеру, в [[США]] 57,7 % людей заражено вирусом HSV-1-типа<ref name="JAMA. 2006;296:964-973. ">{{публикация|статья |заглавие=Trends in Herpes Simplex Virus Type 1 and Type 2 Seroprevalence in the United States |издание=Journal of American Medical Association |volume=296 |issue=8 |pmid=16926356 |doi=10.1001/jama.296.8.964 |страницы=964—973 |язык=en |автор имя= Fujie |автор=Xu |автор2 имя=Maya R. |автор2=Sternberg |автор3 имя=Benny J. |автор3=Kottiri |автор4 имя=Geraldine M. |автор4=McQuillan |автор5=Francis K. Lee, Andre J. Nahmias, Stuart M. Berman, Lauri E. Markowitz |число=23 |месяц=10 |год=2006}}</ref> и 16,2 % инфицировано HSV-2. Среди всех HSV-2 серопозитивных, только 18,9 % знают о своей болезни.<ref>{{статья |заглавие=Seroprevalence of Herpes Simplex Virus Type 2 Among Persons Aged 14-49 Years — United States, 2005−2008 |издание=Morbidity and Mortality Weekly Report (MMWR) |volume=59 |issue=15 |pages=456—459 |ссылка=https://www.cdc.gov/mmwr/preview/mmwrhtml/mm5915a3.htm |accessdate=2011-04-12 |язык=en |тип=j |автор=Xu |автор имя=F. |автор2 имя=M.R. |автор2=Sternberg |автор3 имя=S.L. |автор3=Gottlieb |автор4 имя=S.M. |автор4=Berman |автор5=L.E. Markowitz, S. E. Forhan, L. D. Taylor |месяц=04 |год=2010}}</ref> |
К примеру, в [[США]] 57,7 % людей заражено вирусом HSV-1-типа<ref name="JAMA. 2006;296:964-973. ">{{публикация|статья |заглавие=Trends in Herpes Simplex Virus Type 1 and Type 2 Seroprevalence in the United States |издание=Journal of American Medical Association |volume=296 |issue=8 |pmid=16926356 |doi=10.1001/jama.296.8.964 |страницы=964—973 |язык=en |автор имя= Fujie |автор=Xu |автор2 имя=Maya R. |автор2=Sternberg |автор3 имя=Benny J. |автор3=Kottiri |автор4 имя=Geraldine M. |автор4=McQuillan |автор5=Francis K. Lee, Andre J. Nahmias, Stuart M. Berman, Lauri E. Markowitz |число=23 |месяц=10 |год=2006}}</ref> и 16,2 % инфицировано HSV-2. Среди всех HSV-2 серопозитивных, только 18,9 % знают о своей болезни.<ref>{{статья |заглавие=Seroprevalence of Herpes Simplex Virus Type 2 Among Persons Aged 14-49 Years — United States, 2005−2008 |издание=Morbidity and Mortality Weekly Report (MMWR) |volume=59 |issue=15 |pages=456—459 |ссылка=https://www.cdc.gov/mmwr/preview/mmwrhtml/mm5915a3.htm |accessdate=2011-04-12 |язык=en |тип=j |автор=Xu |автор имя=F. |автор2 имя=M.R. |автор2=Sternberg |автор3 имя=S.L. |автор3=Gottlieb |автор4 имя=S.M. |автор4=Berman |автор5=L.E. Markowitz, S. E. Forhan, L. D. Taylor |месяц=04 |год=2010}}</ref> |
||
Версия от 11:52, 19 ноября 2020
Для улучшения этой статьи желательно:
|
| Простой герпес | |
|---|---|
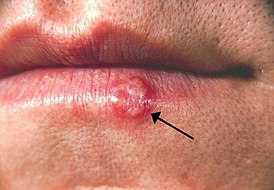 «Простуда» (пузырьки с последующими корочками на их месте) — лабиальное проявление простого герпеса | |
| МКБ-11 | 1F00 |
| МКБ-10 | A60, B00, G05.1, P35.2 |
| МКБ-10-КМ | B00.9 и B00 |
| МКБ-9 | 054.0, 054.1, 054.2, 054.3, 771.2 |
| МКБ-9-КМ | 054[1][2] и 058.89[2] |
| DiseasesDB | 5841 |
| eMedicine | med/1006 |
| MeSH | D006561 |
Простой ге́рпес (др.-греч. ἕρπης, лат. herpes simplex) — ползучая, распространяющаяся кожная болезнь) — вирусное заболевание с характерным высыпанием сгруппированных пузырьков на коже и слизистых оболочках. Вызывается герпесвирусами двух видов: HSV-1 и HSV-2. Наиболее часто встречается лабиальная (губная) форма инфекции. Видимые симптомы лабиальной формы часто называют «простудой», например «простуда на губах»[3] (при этом не следует путать с простудой — как острой респираторной вирусной инфекцией). На втором месте по частоте встречаемости находится генитальный герпес, поражающий преимущественно области половых органов. HSV-1 обычно вызывает инфекции рта, шеи, лица, глаз и ЦНС, в то время как для HSV-2 характерны аногенитальные поражения. Тем не менее, оба типа вируса могут вызывать поражения и той и другой локализации, например после заражения при орогенитальных формах половых контактов. Некоторые виды вирусов герпеса поражают самые разнообразные места.
Также существуют и другие формы вирусных поражений: герпетический панариций, лат. herpes gladiatorum, встречающийся у спортсменов-борцов, глазной герпес (кератит), формы герпетических энцефалитов, менингитов, неонатальный герпес, кроме того, предполагается, что паралич Белла также вызывается этим вирусом.
Следует отметить, что подобную симптоматику вызывают и другие представители семейства Herpesviridae, такие как опоясывающий лишай, вызываемый вирусом ветряной оспы. Кроме того дифференциальная диагностика предполагает рассмотрение также других заболеваний рук, ног, слизистых оболочек рта, характеризующихся схожими повреждениями.
На данный момент не существует лекарства от герпеса. Имеющиеся препараты только подавляют размножение вируса, но не удаляют фрагменты вирусной ДНК из нейроцитов. Поэтому всегда существует вероятность рецидива, особенно при иммунодефицитах (например при ВИЧ-инфекции, опухолях или после трансплантации органов). Через несколько лет рецидивы начинают протекать бессимптомно, хотя человек является заразным для окружающих. Лечение противовирусными средствами позволяет подавить активность вируса и облегчить симптомы. Разрабатываемые вакцины не доказали свою эффективность во время клинических испытаний.
Пути передачи
Вирус простого герпеса легче всего передаётся при прямом контакте с повреждёнными тканями или биологическими жидкостями носителя. Передача может также происходить транскутанно (через кожу) во время периодов бессимптомного вирусоносительства. Барьерные методы являются самыми надёжными и тем не менее, они лишь уменьшают вероятность передачи, не исключая её. Оральный герпес легко диагностируется только при наличии внешних проявлений — ран или язв. На ранних стадиях симптомы заболевания отсутствуют и диагностировать герпес можно только лабораторными методами.
Во внешней среде при комнатной температуре и нормальной влажности вирус простого герпеса сохраняется в течение суток, при температуре 50—52 °С разлагается через 30 мин, а при низких температурах (−70 °С) вирус способен сохранять жизнеспособность в течение 5 суток. На металлических поверхностях (монеты, дверные ручки, водопроводные краны) вирус выживает в течение 2 часов, на влажной стерильной медицинской вате и марле — в течение всего времени их высыхания (до 6 ч)[4].
Симптомы
Вирус простого герпеса (HSV) вызывает несколько идентичных медицинских расстройств. Инфекция кожи, слизистой может вызывать поражения на лице и рте (лабиальный герпес), гениталиях или руках (герпетический панариций). Более серьёзные нарушения происходят, когда вирус поражает глаза (герпетический кератит) или проникает в центральную нервную систему, повреждая головной мозг (герпетический энцефалит). Пациенты — люди с несформированной системой иммунитета (новорождённые) или иммунодефицитами, такие как реципиенты после трансплантации органов, больные СПИДом. С действием вируса также связывают когнитивный дефицит, возникающий у больных биполярным аффективным расстройством и болезнью Альцгеймера, хотя это в первую очередь определяется наследственностью пациента.
После первичного заражения вирус герпеса навсегда встраивается в геном клетки-хозяина и никогда не будет удалён иммунной системой. Он входит в нервные окончания в коже и перемещается по ним в чувствительный нейрон, расположенный в ганглии[5], где переходит в латентную стадию.
Вероятно, антитела, выработанные при заражении HSV-1-типом вируса, облегчают симптомы при последующем заражении HSV-2-типом, однако даже асимптоматический больной всё ещё продолжает быть заразным. Многие отмечают тот факт, что предварительная иммунизация вирусом HSV-2 также облегчает симптоматику у людей, заразившихся вирусом HSV-1-типа. Инфицирование вирусом HSV-2 часто протекает бессимптомно, хотя возможность передачи может сохраняться длительное время. Подробнее см. патогенез.
| Поражение | Замечания | Иллюстрации |
|---|---|---|
| Герпетический гингивостоматит | Герпетический гингивостоматит часто появляется после первичного заражения. В дальнейшем герпес чаще рецидивирует в более легкой лабиальной форме. |  |
| Лабиальный герпес | Рецидив возникает при повторном контакте с поражённой слизистой рта или кожей. |  |
| Генитальный герпес | В случае классической симптоматики, типично проявляется как первичная HSV-1 или HSV-2 генитальная инфекция в виде групп воспаленных сосочков и пузырьков на наружной поверхности гениталий, напоминающее лабиальный герпес. |  |
| Герпетический панариций | Герпетический панариций является болезненной формой инфекции, которая часто поражает фаланги пальцев. Иногда возникает на ногтевом валике. |  |
| Herpes gladiatorum | Люди, занимающиеся контактным спортом, таким как реслинг, регби, и футбол иногда получают заболевание, вызванное HSV-1 известное как herpes gladiatorum, представленное язвами на лице, ушах, шее. Симптомы: жар, головную боль, воспалённое горло и миндалины. Иногда поражаются глаза или веки. | |
| Герпетический кератоконьюктивит | Первичная инфекция обычно представлена припухлостью конъюнктивы, век (конъюнктивит), сопровождающихся маленькими белыми зудящими поражениями на роговице. | |
| Герпетический энцефалит | Герпетическая инфекция мозга, которая, как предполагается, вызывается ретроградной передачей вируса по аксону тройничного нерва в мозг. HSV является наиболее распространённой причиной вирусного энцефалита. Вирус накапливается преимущественно в височных долях.[6] |  |
| Герпетический менингит | Менингит Молларета, чаще всего вызывается HSV-2; один из типов возвратного вирусного менингита. | |
| Неонатальный простой герпес | Неонатальный простой герпес, достаточно редкий, но тяжело переносимый тип инфекции, обычно передаётся от матери к новорождённому. | |
| Герпес на фоне иммунодефицита | У пациентов с ослабленной иммунной системой, герпес способен вызывать необычные поражения кожи. Одними из наиболее частых проявлений являются чистые вытянутые эрозии на кожных складках, похожие на ножевые порезы.[7] | |
| Герпетический сикоз | Герпетический сикоз — это рецидивирующий или первичный герпес, поражающий волосяные фолликулы.[8]:369 | |
| Герпетическая экзема | Герпетическая инфекция у пациентов с хроническим атопическим дерматитом, может вызывать появление похожих на экзему высыпаний.[8]:373 | |
| Герпетический эзофагит | Герпетический эзофагит характеризуется болезненным или затруднённым глотанием. Часто протекает на фоне иммунодефицитов (например ВИЧ/СПИД), или в посттрансплантационном периоде. |
Паралич Белла
Хотя на данный момент точная этиология паралича Белла, как формы паралича лицевого нерва, неизвестна, существует теория, по которой паралич может вызываться реактивацией вируса HSV-1. На данный момент эта теория оспаривается, так как вирусы группы HSV обнаруживаются у множества людей, не имеющих паралича. Кроме того, у пациентов с параличом не выявлено значимого повышения уровня антител к HSV, и противовирусные препараты не улучшают состояние таких больных.
Болезнь Альцгеймера
HSV-1 представляется как один из факторов риска возникновения болезни Альцгеймера. Нервная система людей с определённым генотипом (носители аллеля epsilon4 аполипопротеина-E) сильнее подвержена патогенному действию вируса, что увеличивает риск развития болезни Альцгеймера. Вирус взаимодействует с компонентами и рецепторами липопротеинов. При отсутствии данной генной аллели, вирус HSV-1 заболевания не вызывает.
Вирусная ДНК локализуется в β-амилоидных бляшках, что характерно для синдрома Альцгеймера. Это даёт основания полагать, что вирус является причиной их возникновения и, следовательно, значимым этиологическим фактором для развития этого заболевания.
Впрочем, более позднее исследование с выборкой в несколько тысяч человек в 2008 году показало высокую корреляцию между серопозитивностью к ВПГ и болезнью Альцгеймера, без прямого влияния на этот риск аллеля APOE-epsilon4.[9]
Патогенез
Вирус герпеса не способен проникать через неповреждённый роговой слой кожи, что обусловлено отсутствием на нём специфических рецепторов. Герпес передаётся при прямом контакте повреждённых покровов с поражёнными участками кожи или с биологическими жидкостями инфицированного человека. Передача осуществляется между дискордантными партнёрами: переболевший человек (HSV-серопозитивный) может передать вирус серонегативному здоровому человеку. Вирус HSV-2 типа передаётся исключительно транскутанно (через кожу).
После контакта с источником инфекции, вирусные частицы, попавшие на эпителий, движутся с небольшими перерывами через кожные или слизистые оболочки рта или гениталий. Вирус проникает в клетки через рецепторы, такие как nectin-1, HVEM и 3-O сульфатированный гепарансульфат. Внешняя оболочка вируса сливается с клеточной мембраной. Далее вирусный нуклеокапсид оказывается в нейроплазме, где и происходит высвобождение вирусной ДНК. Далее она транспортируется по дендритам нервных окончаний в тело чувствительного нейрона, находящееся в сенсорном ганглии, где встраиваются в его генетический аппарат навсегда. После проникновения вируса начинается процесс его активного воспроизводства в клетке — персистенция. При лабиальных поражениях характерна персистенция вируса в нейроцитах чувствительных ганглиев тройничного нерва, а при генитальных — поясничных.
У большинства людей воспроизводство и выделение вируса сразу после инфицирования происходит бессимптомно. Это может произойти более чем за неделю до или после появления первых симптомов в 50 % случаев. Возбудитель интенсивно в нём размножается, запуская литический, продуктивный тип инфекции. Происходит очаговая дегенерация эпителия: клетки увеличиваются в размерах, затем погибают, образуя очаги некроза.
Вирусы герпеса имеют циклические периоды активности (в течение 2—21 дней формируются пузырьки, содержащие вирусные частицы) и периоды ремиссии, во время которых язвочки пропадают. Генитальный герпес (HSV-2-типа), чаще протекает бессимптомно, хотя вирус размножается и может передаваться другим людям. Это наиболее характерно для вируса HSV-2-типа. Рецидивы заболевания не определены во времени, хотя выявлены некоторые триггеры заболевания. К таким факторам относится воздействие иммунодепрессантов (см. ниже). При рецидиве вирус, находящийся в латентной стадии, активируется, в результате чего образуется множество инфекционных частиц, движущихся по отросткам нейрона, из которых они в дальнейшем переходят в эпителий кожи и слизистых оболочек. Часто снова возникают пузырьки, сопровождающиеся некротическим повреждением эпителия. Цикл репродукции вируса — 10 часов. С течением времени у организма формируется противовирусный иммунитет и частота и тяжесть рецидивов уменьшается.
Носительство чаще всего продолжается в течение первых 12 месяцев после инфицирования. Продолжительность такого носительства при иммунодефицитах (например при ВИЧ-инфекции) больше. Есть сведения, что у некоторых людей, возможно, носительство укорочено, однако нет достоверных сведений, подтверждающих это. Нет видимого значимого различия в количестве асимптоматичных носителей, при сравнении лиц, имеющих от одного до двенадцати ежегодных рецидивов, с теми, кто рецидивов не имел.
После заражения организм начинает синтезировать антитела против конкретного HSV-типа вируса, предотвращая распространение инфекции. В случае заражения вирусом HSV-1-типа, такая сероконверсия (выработка антител) защитит организм от прочих инфекционных процессов, вызываемых этим вирусом, таких как генитальный герпес, герпетический кератит и панариций.
Антитела, которые вырабатываются после первоначальной герпетической инфекции, предотвращают заражение тем же типом вируса: у людей, перенёсших ротолицевой герпес HSV-1-типа не бывает панариция или генитального герпеса, вызываемого HSV-1.[источник не указан 2061 день]
В моногамном браке, серонегативная женщина имеет риск заражения от серопозитивного мужчины выше 30 % в год. При первой оральной инфекции продукция защитных антител займёт 6 недель, после чего гуморальный иммунитет будет способен защитить организм от повторной генитальной инфекции.
Диагностика
Первичный оролицевой герпес легко диагностируется у людей, которые ранее не болели и не имели контакта с вирусоносителями HSV-1. У таких людей обычно появляется несколько круглых поверхностных папул в углу рта, сопровождающихся острым гингивитом. Взрослые с атипичной симптоматикой труднее поддаются диагностике. Продромальные симптомы, проявляющиеся ещё до появления видимых герпетических поражений, позволят дифференциально диагностировать симптомы инфицирования вирусом HSV-типа от, например, аллергического стоматита. Если заболевание не проявляется внутри рта, первичный орофациальный герпес может быть ошибочно принят за импетиго или бактериальное заражение. Кроме того, язвы во рту (афты) также могут быть похожи на ротовой герпес, но при этом пузырьки не появляются.
Генитальный герпес диагностировать труднее, так как большинство HSV-2 инфицированных не имеют «классических» симптомов. Кроме того, микозы, атопические дерматиты, уретриты имеют подобную симптоматику, что усложняет его диагностику. Лабораторные тесты включают: вирусологические исследования, РИФ, ПЦР. Хотя эти процедуры являются высокоспецифическими и дают высокую точность, они слишком сложны и дороги для постоянного клинического применения.
Серологический метод. Серологический метод с IgM не позволяет различить антитела к HSV-1 и HSV-2 типам вирусов. Тем не менее, новый иммуноточечный гликопротеин G-специфичный HSV-тест даёт более чем 98 % специфичность и позволяет, таким образом, различить HSV-1 и HSV-2 типы герпеса. Некоторые зарубежные клиницисты считают, что в скором времени тест с IgM будет вытеснен новым.
Цитологический метод. В соскобе поражённого участка эпителия, окрашенного по Романовскому — Гимзе, обнаруживают многоядерные клетки с внутриклеточными включениями.
Вирусологический метод. Заражают культуры клеток и выявляют цитопатологическое действие (ЦПД) в виде гигантских многоядерных клеток с включениями, которые разрушаются. Идентификацию осуществляют в реакции нейтрализации ЦПД, РИФ с моноклональными антителами. На хорионаллантоисной мембране куриных эмбрионов через 2—3 суток образуются белые бляшки.
Биологический метод. При нанесении вирусного материала на скарификацию роговицы кролика возникает кератит, а в мозгу новорождённых мышат — энцефалит.
Предупреждение генитального герпеса
Как и к большинству ЗППП, к герпесу женщины восприимчивы больше, чем мужчины. В целом, за год без использования противовирусных препаратов или презервативов риск передачи HSV-2 от мужчины к женщине составляет 8—11 %. Считается, что это связано с повышенной уязвимостью слизистых в местах контакта. Риск передачи от инфицированной женщины к мужчине составляет 4—5 %. Подавляющая противовирусная терапия снижает риск до 50 %. Кроме того, применение противовирусных препаратов позволяет предотвратить симптомы после заражения у 50 % серопозитивных людей. Использование презервативов значительно снижает риск заражения, причём для женщин риск ниже. Комбинированный подход сокращает риск на 75 %.
Следует отметить, что цифры, приведённые выше, получены при клинических исследованиях на субъектах, имеющих часто рецидивирующий генитальный герпес (более шести случаев в год). Лица без симптомов или с низкой частотой рецидивов были исключены из этих исследований. Предшествующее заражение герпесом типа HSV-1 уменьшает риск инфицирования HSV-2 у женщин в три раза.
Бессимптомные носители не знают о протекании заболевания и могут заражать других людей.
В октябре 2011 г. сообщалось, что препарат Tenofovir, препятствующий передаче вируса иммунодефицита человека, при местном применении в качестве вагинального геля предотвращает также и передачу вируса герпеса.
Барьерный метод

Презервативы предоставляют средний уровень защиты против HSV-2 как для мужчин, так и для и женщин. Вирус не проходит через барьер из синтетического материала и, при регулярном применении, риск заражения снижается на 30 %. Женский презерватив обеспечивает более полную защиту, так как, в отличие от мужского, препятствует контакту мужского тела с половыми губами женщины. Однако при этом возможен свободный контакт мошонки, ануса, ягодиц и бёдер — зон, которые могут контактировать с язвами или биологическими жидкостями во время коитуса. Таким образом, повышение уровня механической защиты целесообразно только до некоторого предела, за которым кончается секс.
Презервативы и коффердамы (латексные пластинки для куннилингуса), также эффективны и при оральном сексе.
Параллельное использование противовирусных препаратов обеспечивает дополнительную защиту.
Вакцина
На данный момент[когда?] вакцины проходят клинические исследования. После успешного завершения клинического тестирования они могут быть использованы для предотвращения передачи, профилактики и лечения герпетических инфекций.
Противовирусные препараты
Противовирусные препараты могут уменьшать выделение вируса в острую фазу. Считается, что у лечащихся пациентов фаза выделения вирусных частиц занимает 10 % дней в году, в то время как у не лечащихся 20 %.
Беременность
Риск передачи от матери к ребёнку наиболее высок, если мать заразилась непосредственно перед родами (от 30 до 60 %). Если инфекция рецидивирующая, то риск падает до 3 %. При отсутствии язв, риск менее 1 %.
Для предотвращения неонатальных инфекций, беременным рекомендуется избегать незащищённых орогенитальных контактов с HSV-1-серопозитивным партнёром во время последнего триместра беременности. Серонегативные матери, заразившиеся HSV, имеют 57 % риск передачи в связи с не завершившимся формированием иммунного ответа — синтеза антител, которые передаются ребёнку ещё до рождения и защищают его некоторое время после. Поэтому, женщина, положительная по HSV-1 и HSV-2 передаст инфекцию с вероятностью 1-3 %. Женщины, серопозитивные только по одному из типов вируса имеют вероятность передачи в два раза ниже, по сравнению с серонегативными.
Матерям, инфицированным HSV, следует избегать травматичных процедур при родах (например щипцов, вакуумных экстракторов). В случае высокого риска заражения может быть целесообразно использовать кесарево сечение.
При терапии противовирусными препаратами (начиная с 36 недели), такими как ацикловир, снижается вероятность передачи, а значит и необходимость кесарева сечения. Безопасность использования других противовирусных препаратов во время беременности пока проверяется.
Лечение
На данный момент не существует метода, позволяющего удалить вирус из организма. Антивирусные препараты лишь снижают частоту, продолжительность и тяжесть рецидивов. Анальгетики, например ибупрофен и парацетамол только уменьшают боль и лихорадку. Местные анестетики, такие как прилокаин, лидокаин, бензокаин или тетракаин также снимают зуд и болевые ощущения.
Лечение противовирусными препаратами
Против герпетических инфекций эффективны: ацикловир, валацикловир, фамцикловир, пенцикловир. Ацикловир был открыт первым, существует множество его дженериков.
Доказано, что ацикловир и валацикловир эффективны при лечении лицевого герпеса (на губах), в том числе у раковых больных. Доказательства в поддержку использования ацикловира при терапии первичного герпетического гингивостоматита не.
Местное применение
При местном применении для лечения лицевого герпеса эффективны ацикловир, пенцикловир, докозанол (docosanol). Эти препараты разрешены к продаже без рецепта врача.
Генотерапия
Обнадёживающие результаты продемонстрированы при лечении человеческих клеток линии Vero, а также животных от герпесвирусов типа 1 (вирус простого герпеса, HSV-1), типа 4 (вирус Эпштейна — Барр, EBV) и типа 5 (цитомегаловирус человека, HCMV) методом CRISPR/Cas9. Для некоторых участков их ДНК были созданы направляющие молекулы РНК, благодаря которым нуклеазы Cas9 способны распознавать их в геноме хозяина и разрезать. Эксперименты показали, что разрез в одном участке вирусной ДНК снижает число заражённых клеток примерно вдвое, а два разреза приводят к почти полному удалению вирусов[10][11].
Альтернативные методы лечения
Альтернативные методы действуют опосредованно, обладая лишь общеукрепляющим, противовоспалительным действием. Лизин, являясь незаменимой аминокислотой, представляет собой пластический материал для тканевой регенерации. Цинковые мази, при нанесении на кожные покровы, обладают противовоспалительным, антисептическим и подсушивающим действием, препятствуя проникновению вируса и ускоряя заживление язв. Сюда же стоит отнести экстракт алоэ вера, пихтовое, облепиховое масло и прополис, как природные противовоспалительные средства.
Иммунитет
При первичном инфицировании образуются IgМ-антитела, при рецидивах — IgG и IgА. Вследствие персистенции вируса у инфицированных людей иммунитет является нестерильным и временным — при снижении иммунитета, особенно дефиците естественных киллеров (ЕК), наступает рецидив. Кроме того, вирус герпеса сам способен индуцировать иммунодефицит, одним из механизмов которого является стимуляция синтеза «неэффективных» IgG-антител, которые супрессируют иммунитет, и подавляют ЕК. У людей, резистентных к инфекции, иммунитет осуществляется системой интерферонов, естественных киллеров и Т-киллеров, а также sIgA-антителами. У 80-90 % взрослых имеются IgG-антитела к ВПГ-1. Уровень иммунитета значительно влияет на количество и выраженность рецидивов.
Прогноз
После стадии активной инфекции, вирус остаётся латентно персистировать в чувствительных ганглиях и ганглиях автономной нервной системы. Двухцепочечная нить вирусной ДНК встроена в геном клетки, расположенный в ядре нейроцита. Вирусных частиц в этой фазе не производится. Это контролируется вирусной ДНК, в которой имеется два LAT-транскрипта[англ.] — транскрипты, связанные с латентностью), которые во множестве в ней содержатся.[12] Кодирующий их ген частично перекрывается со сверхранними генами, кодирующими белки типа ICP0, но его транскрипция осуществляется с комплементарной цепи ДНК. С делецией этого участка генома образующиеся мутантные вирусы, которые переходят в латентное состояние, и их способность к реактивации снижена. Таким образом, LAT-транскрипты используются скорее для поддержания латентного состояния, а не для перехода в него. Сами механизмы переходов на данный момент изучены недостаточно, соответственно препаратов, способных управлять активностью вирусов, пока не создано.
У многих инфицированных людей был рецидив в течение первого года после первичной инфекции.[5] Рецидиву предшествует продромальный период, включающий такие симптомы как: покалывание (парестезии), зуд, боли в области чувствительной иннервации кожи пояснично-крестцового нерва. Продромальный период может занимать от нескольких часов до нескольких дней. Противовирусная терапия, начатая в продромальном периоде снижает тяжесть и продолжительность симптоматики. В любом случае, рецидивы проходят значительно легче и прекращаются в течение 5-10 дней даже без проведения специальной терапии.[5] Последующие вспышки, как правило, эпизодические, происходят, в среднем, 4-5 раз в год, в то время когда специальная терапия не проводится.
Как уже было сказано, причины реактивации (рецидива) не известны, но некоторые триггеры задокументированы. Недавние исследования (2009) показали, что белок vmw65[англ.] играет ключевую роль в реактивации вируса.[13] Изменения в иммунной системе перед менструацией также могут стимулировать активацию HSV-1[14][15].
Параллельные инфекции, такие как ОРВИ и другие, вызывающие лихорадку, также могут привести к рецидивам. Вероятно, именно из-за этого и возникло понятие «простуда на губах».
Другие указанные триггеры включают локальные лицевые повреждения губ, глаз или рта, травмы, хирургические вмешательства, последствия лучевой терапии, ветра, воздействия УФ-облучения или солнечного света.[16][17][18][19][20]
Частота и тяжесть вспышек у разных людей варьирует в широких пределах. У одних возникают язвы, не заживающие неделями, у других они проявляются только лишь как незначительный зуд и жжение в течение нескольких дней. Существует ряд доказательств, что наследственность влияет на частоту рецидивов. В области 21 хромосомы существует зона, включающая 6 генов, которую связывают с частотой вспышек.
Иммунитет к вирусу постоянен. Тяжесть вспышек и их частота со временем уменьшается. Через несколько лет некоторые люди не будут иметь вообще каких-либо симптомов, хотя вирус будет выделяться и способен передаваться окружающим. У лиц с дефектами иммунитета вспышки будут тяжелее, дольше и чаще; им показана противовирусная терапия.[21] Вспышки могут происходить в прежних местах или в непосредственной близости от нервных окончаний инфицированных ганглиев. В случае генитального герпеса, сыпь появляется на прежнем месте или у основания позвоночника, ягодиц или задней поверхности бёдер. Лица, инфицированные HSV-2 имеют больший риск заражения ВИЧ при незащищённом сексе с ВИЧ-положительным партнёром,[22] особенно в период реактивации HSV-вируса.[23]
Эпидемиология
Мировая распространённость вирусов простого герпеса колеблется между 65 % и 90 %.[24] HSV-1 встречается чаще, чем HSV-2, частота которого значительно увеличивается с возрастом.[24] Распространённость и частота возникновения инфекции определяется наличием вирусспецифических антител у восприимчивых организмов.[25]
К примеру, в США 57,7 % людей заражено вирусом HSV-1-типа[26] и 16,2 % инфицировано HSV-2. Среди всех HSV-2 серопозитивных, только 18,9 % знают о своей болезни.[27]
Источником инфекции является человек с герпесом в активной стадии. Вирус может передаваться даже при отсутствии видимых симптомов. Пути передачи — контактно-бытовой, воздушно-капельный, половой, трансплацентарный (от матери к плоду). Основной путь — контактный. Вирус содержится в слюне и биологических жидкостях. Заражение происходит через поцелуи, посуду, полотенца, игрушки. Исследования на наличие специфических антител подтверждают, что инфицирование HSV-1 обычно происходит в раннем возрасте, а HSV-2 после начала половой жизни. Контактный путь может реализовываться ятрогенно при использовании нестерильных медицинских инструментов (в стоматологии и офтальмологии). При воздушно-капельном пути передачи, герпетическая инфекция протекает в форме ОРВИ. Контактным и воздушно-капельным путём чаще заражаются дети от 6 месяцев до 3 лет. К герпетической инфекции существует генетическая предрасположенность, часть людей — резистентны. Заболевание нередко носит семейный характер (родители-дети). Причём мать может быть резистентной, а дети заражаются от отца.
История
Герпес известен уже более 2000 лет. Говорят, что император Тиберий на некоторое время запретил целоваться в Риме из-за большого количества заражённых людей. Герпетические пузырьки упоминаются и в произведении XVI века Ромео и Джульетта. В XVIII веке болезнь была так распространена среди проституток, что её называли «профессиональной болезнью женщин».[28]
Термин простой герпес (Herpes Simplex) появился в книге Ричарда Болтона[англ.] в 1713, где появились и другие термины, относящиеся к теме.
Вирус герпеса не могли найти вплоть до 1940 г.[28]
Начало противогерпетической терапии относят к 1960 г, когда были впервые применены препараты, препятствующие репликации вирусной ДНК. Проводилась терапия смертельных или приводящих к инвалидности заболеваний, таких как энцефалит[29] кератит[30] у пациентов со сниженным иммунитетом (реципиентов трансплантатов)[31] или опоясывающим герпесом (herpes zoster).[32] В состав исходного препараты входили: 5-йод-2'-деоксиридин (idoxuridine), IUdR, или (IDU), а также 1-β-D-арабинофуранозилцитозин или ara-C,[33] позже получившие торговые названия «cytosar» или «cytorabine». Позже их стали использовать для местной терапии простого герпеса,[34] zoster, и ветряной оспы.[35] Разные комбинации препаратов приводили к разным результатам[29] Введение 9-β-D-арабинофураноззинаденина (ara-A) или видарабина (vidarabine), оказывает значительно менее токсическое действие чем Ara-C. С середины 1970 его стали регулярно применять для неонатальной противовирусной терапии. Видарабин (Vidarabine) был первым препаратом, терапевтическая доза которого для лечения HSV, угрожающего жизни пациента, была ниже токсической. Внутривенное введение видарабина было лицензировано управлением по контролю качества продуктов и лекарств (FDA) в 1977. Другие экспериментальные противовирусные препараты: гепарин,[36] trifluorothymidine (TFT),[37] Ribivarin,[38] интерферон,[39] Virazole,[40] и 5-метоксиметил-2'-деоксиуридин (MMUdR)[41]. Введение 9-(2-гидроксиэтоксиметил)гуанидина (ацикловира), в конце 1970 г,[42] что было значительным достижением. В 1980 годах проводились специальные исследования, целью которых было сравнить эффективность ацикловира по сравнению с видарабином.[43] Благодаря меньшей токсичности и лёгкости контроля ацикловира он стал препаратом выбора и был лицензирован FDA в 1998.[44] Ещё одним преимуществом нового препарата было снижение заболеваемости и смертности при больших дозах при лечении неонатального герпеса, чего не наблюдалось при использовании видарабина.[44] С другой стороны, ацикловир может ингибировать синтез антител и при его использовании больше, чем при использовании видарабина, замедляется рост титра антител.
Научные исследования
Исследователи из Флоридского университета синтезировали Рибозим типа hammerhead, который специфично расщепляет мРНК основных генов HSV-1. Hammerhead, атакующий мРНК гена UL20, значительно снижает уровень глазных HSV-1-ассоциированных инфекций у кроликов и снижает выброс вирусных частиц in vivo.[45] При таком подходе используются специально синтезированные РНК-ферменты, подавляющие штаммы вируса простого герпеса. Фермент выключает ген, ответственный за синтез белка, участвующего в созревании и высвобождении вирусных частиц из заражённой клетки. Данная методика проявила эффективность в испытании на мышах и кроликах, однако требуются дополнительные исследования, прежде чем его смогут использовать люди.[46]
В университете Дьюка также ведётся разработка средств для лечения данного вируса. При обычном течении патологического процесса, часть вирусов всегда находится в латентном состоянии внутри нервных клеток. Исследователи пытаются выяснить, как одновременно перевести все вирусы хозяина в активную стадию, чтобы можно было убить сразу всю популяцию обычными противовирусными препаратами.
Этой цели может служить класс препаратов, называемый antagomir[англ.]. Это искусственно синтезированные олигонуклеотиды или короткие сегменты РНК, которые комплементарны герпетической мРНК. Они могут быть спроектированы таким образом, что при присоединении к мРНК будут заставлять её «молчать», делая вирус неспособным оставаться латентным.[47] Профессор Каллен считает, что может быть разработан препарат, способный блокировать мРНК, ответственную за удержание вируса в латентной стадии.[48]
Существует также вакцина Herpevac против вируса типа HSV-2, на данный момент проходящая третью фазу клинических исследований в национальных институтах здравоохранения США.[49] В 2010 было объявлено, что через 8 лет изучения у более чем 8000 женщин в США и Канаде, несмотря на ранние благоприятные промежуточные отчеты[49], нет положительных результатов в лечении генитального герпеса.[50]
В лаборатории гарвардской медицинской школы был разработан dl5-29 (сейчас известен как ACAM-529) англ. replication-defective mutant virus, который оказался успешным в предотвращении HSV-2/HSV-1 инфекций, и в борьбе с вирусом у заражённых животных.
Было показано, что вакцина, вызывающая повреждение при репликации, индуцирует сильный HSV-2-специфичный антительный и Т-клеточный иммунный ответ; защищает от заражения диким вирусом HSV-2; значительно уменьшает вероятность рецидивов; защищает от HSV-1, и не позволяет вирусу вернуться в вирулентную или латентную стадию.[51] Вакцина в настоящее время исследуется и разрабатывается Accambis (приобретена Sanofi Pasteur в сентябре 2008), которая должна была представить новый экспериментальный препарат в 2009.[52] Тем не менее, статус препарата ACAM-529 после приобретения не совсем ясен. В соответствии со словами Джима Тартаглии, представителя компании Sanofi Pasteur, ACAM-529 всё ещё находится на стадии разработки, а клинические испытания начнутся только в 2012 году.[53]
Частная компания «BioVex» в марте 2010 г приступила к первой фазе клинических испытаний вакцины ImmunoVEX.[54] В живой вакцине HSV-2 ICP0 ослабленных вирусов HSV-2-типа используется принципиально новый подход, исследованный доктором Вильямом Хелфордом в медицинском университете Южного Иллинойса[англ.][55]
См. также
Примечания
- ↑ Disease Ontology (англ.) — 2016.
- ↑ 1 2 Monarch Disease Ontology release 2018-06-29 — 2018-06-29 — 2018.
- ↑ Вирус простого герпеса. www.who.int. Дата обращения: 27 июля 2019.
- ↑ http://www.rusmg.ru/php/content.php?id=8515&pr=print (недоступная ссылка) Генитальный герпес: современные проблемы и пути их решения
- ↑ 1 2 3 Gupta R., Warren T., Wald A. Genital herpes (англ.) // The Lancet. — Elsevier, 2007. — December (vol. 370, no. 9605). — P. 2127—2137. — doi:10.1016/S0140-6736(07)61908-4. — PMID 18156035.
- ↑ Mahesh R. Patel, MD. James G. Smirniotopoulos: Herpes Encephalitis: eMedicine Radiology. Medscape (25 мая 2011). Дата обращения: 5 мая 2019. Архивировано из оригинала 19 марта 2012 года.
- ↑ Jocelyn A. Lieb, Stacey Brisman, Sara Herman, Jennifer MacGregor, Marc E. Grossman. Linear erosive Herpes Simplex Virus infection in immunocompromised patients: the "Knife-Cut Sign" (англ.) // Clinical Infectious Diseases[англ.] : journal. — 2008. — Vol. 47, no. 11. — P. 1440—1441. — doi:10.1086/592976. — PMID 18937574.
- ↑ 1 2 James, William D.; Berger, Timothy G. Andrews' Diseases of the Skin: clinical Dermatology (англ.). — Saunders Elsevier, 2006. — ISBN 0-7216-2921-0.
- ↑ Letenneur, L; Pérès, K., Fleury, H., Garrigue, I., Barberger-Gateau, P., Helmer, C., Orgogozo, J.M., Gauthier, S., Dartigues, J.F. Seropositivity to herpes simplex virus antibodies and risk of Alzheimer's disease: a population-based cohort study (англ.) // PLoS ONE : journal. — 2008. — Vol. 3, no. 11. — P. e3637. — doi:10.1371/journal.pone.0003637. — PMID 18982063. — PMC 2572852.
- ↑ van Diemen F. R., Kruse E. M., Hooykaas M. J., Bruggeling C. E., Schürch A. C., van Ham P. M., Imhof S. M., Nijhuis M., Wiertz E. J., Lebbink R. J. CRISPR/Cas9-Mediated Genome Editing of Herpesviruses Limits Productive and Latent Infections. (англ.) // PLoS pathogens. — 2016. — Vol. 12, no. 6. — P. e1005701. — doi:10.1371/journal.ppat.1005701. — PMID 27362483.
- ↑ Роман Фишман. Биологи научились очищать клетки от герпесвирусов. nplus1.ru (1 июля 2016). Дата обращения: 4 июля 2016.
- ↑ Stumpf M.P., Laidlaw Z., Jansen V.A. Herpes viruses hedge their bets (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2002. — Vol. 99, no. 23. — P. 15234—15237. — doi:10.1073/pnas.232546899. — PMID 12409612. — PMC 137573.
- ↑ Laura Sanders. How Herpes Re-rears Its Ugly Head. Science News (26 марта 2009). Дата обращения: 5 мая 2019. Архивировано 19 марта 2012 года.
- ↑ Myśliwska J., Trzonkowski P., Bryl E., Lukaszuk K., Myśliwski A. Lower interleukin-2 and higher serum tumor necrosis factor-a levels are associated with perimenstrual, recurrent, facial Herpes simplex infection in young women (англ.) // Eur. Cytokine Netw. : journal. — 2000. — Vol. 11, no. 3. — P. 397—406. — PMID 11022124.
- ↑ Segal A.L., Katcher A.H., Brightman V.J., Miller M.F. Recurrent herpes labialis, recurrent aphthous ulcers, and the menstrual cycle (англ.) // Journal of Dental Research[англ.] : journal. — 1974. — Vol. 53, no. 4. — P. 797—803. — doi:10.1177/00220345740530040501. — PMID 4526372.
- ↑ Chambers A., Perry M. Salivary mediated autoinoculation of herpes simplex virus on the face in the absence of "cold sores," after trauma (англ.) // Journal of Oral and Maxillofacial Surgery[англ.] : journal. — 2008. — Vol. 66, no. 1. — P. 136—138. — doi:10.1016/j.joms.2006.07.019. — PMID 18083428.
- ↑ Perna J.J., Mannix M.L., Rooney J.F., Notkins A.L., Straus S.E. Reactivation of latent herpes simplex virus infection by ultraviolet light: a human model (англ.) // Journal of the American Academy of Dermatology[англ.] : journal. — 1987. — Vol. 17, no. 3. — P. 473—478. — doi:10.1016/S0190-9622(87)70232-1. — PMID 2821086.
- ↑ Rooney JF; Straus SE; Mannix ML; Wohlenberg, CR; Banks, S; Jagannath, S; Brauer, JE; Notkins, A.L. UV light-induced reactivation of herpes simplex virus type 2 and prevention by acyclovir (англ.) // The Journal of Infectious Diseases : journal. — 1992. — Vol. 166, no. 3. — P. 500—506. — doi:10.1093/infdis/166.3.500. — PMID 1323616.
- ↑ Oakley C., Epstein J.B., Sherlock C.H. Reactivation of oral herpes simplex virus: implications for clinical management of herpes simplex virus recurrence during radiotherapy (англ.) // Oral Surg Oral Med Oral Pathol Oral Radiol Endod : journal. — 1997. — Vol. 84, no. 3. — P. 272—278. — doi:10.1016/S1079-2104(97)90342-5. — PMID 9377190.
- ↑ Ichihashi M., Nagai H., Matsunaga K. Sunlight is an important causative factor of recurrent herpes simplex (англ.) // Cutis : journal. — 2004. — Vol. 74, no. 5 Suppl. — P. 14—8. — PMID 15603217.
- ↑ Martinez V., Caumes E., Chosidow O. Treatment to prevent recurrent genital herpes : [англ.] // Current Opinion in Infectious Diseases. — 2008. — Vol. 21, no. 1. — P. 42—48. — doi:10.1097/QCO.0b013e3282f3d9d3. — PMID 18192785.
- ↑ Sobngwi‐Tambekou J; Taljaard D; Lissouba P; Zarca, Kevin; Puren, Adrian; Lagarde, Emmanuel; Auvert, Bertran. Effect of HSV-2 serostatus on acquisition of HIV by young men: results of a longitudinal study in Orange Farm, South Africa : [англ.] // The Journal of Infectious Diseases : j. — 2009. — Vol. 199, no. 7. — P. 958—964. — doi:10.1086/597208. — PMID 19220143. — PMC 2868899.
- ↑ Koelle, D. M. Herpes Simplex : Insights on Pathogenesis and Possible Vaccines : [англ.] / D. M. Koelle, L. Corey // Annual Reviews : j. — 2008. — Vol. 59. — P. 381—395. — doi:10.1146/annurev.med.59.061606.095540. — PMID 18186706.
- ↑ 1 2 Chayavichitsilp, P. Herpes simplex : [англ.] / P. Chayavichitsilp, J. V. Buckwalter, A. C. Krakowski … [et al.] // Pediatric in Review. — 2009. — Vol. 30, no. 4 (April). — P. 119—129. — doi:10.1542/pir.30-4-119. — PMID 19339385.
- ↑ Smith J.S., Robinson N.J. Age-specific prevalence of infection with herpes simplex virus types 2 and 1: a global review (англ.) // The Journal of Infectious Diseases : journal. — 2002. — Vol. 186 Suppl 1. — P. S3—28. — doi:10.1086/343739. — PMID 12353183.
- ↑ Xu, Fujie. Trends in Herpes Simplex Virus Type 1 and Type 2 Seroprevalence in the United States : [англ.] / Fujie Xu, Maya R. Sternberg, Benny J. Kottiri … [et al.] // Journal of American Medical Association. — 2006. — Vol. 296, no. 8 (23 October). — С. 964—973. — doi:10.1001/jama.296.8.964. — PMID 16926356.
- ↑ Xu. Seroprevalence of Herpes Simplex Virus Type 2 Among Persons Aged 14-49 Years — United States, 2005−2008 (англ.) // Morbidity and Mortality Weekly Report (MMWR) : j. — 2010. — April (vol. 59). — P. 456—459.
- ↑ 1 2 John Leo. The New Scarlet Letter. Time (2 августа 1982).
- ↑ 1 2 Chow, A. W. Cytosine Arabinoside Therapy for Herpes Simplex Encephalitis—Clinical Experience with Six Patients : [англ.] / A. W. Chow, A. Roland, M. Fiala … [et al.] // Antimicrobial Agents and Chemotherapy : j. — 1973. — Vol. 3, no. 3 (March). — P. 412—417. — PMID 4790599. — PMC 444424.
- ↑ Kaufman H. E., Howard G. M. Therapy of experimental herpes simplex keratitis (англ.) // Investigative Ophthalmology & Visual Science. — 1962. — August (vol. 1). — P. 561—564. — PMID 14454441. (недоступная ссылка)
- ↑ Ch'ien L. T., Whitley R. J., Alford C. A., Galasso G. J. Adenine arabinoside for therapy of herpes zoster in immunosuppressed patients: preliminary results of a collaborative study (англ.) // The Journal of Infectious Diseases : journal. — 1976. — June (vol. 133 Suppl). — P. A184—91. — PMID 180198.
- ↑ McKelvey E. M., Kwaan H. C. Cytosine arabinoside therapy for disseminated herpes zoster in a patient with IgG pyroglobulinemia (англ.) // Blood?! : journal. — American Society of Hematology, 1969. — November (vol. 34, no. 5). — P. 706—711. — PMID 5352659.
- ↑ Fiala M., Chow A., Guze L. B. Susceptibility of Herpesviruses to Cytosine Arabinoside: Standardization of Susceptibility Test Procedure and Relative Resistance of Herpes Simplex Type 2 Strains : [англ.] // Antimicrobial Agents and Chemotherapy : j. — 1972. — Vol. 1, no. 4 (April). — P. 354—357. — PMID 4364937. — PMC 444221.
- ↑ Allen LB; Hintz OJ; Wolf SM; Huffman, JH; Simon, LN; Robins, RK; Sidwell, R.W. Effect of 9-beta-D-arabinofuranosylhypoxanthine 5'-monophosphate on genital lesions and encephalitis induced by Herpesvirus hominis type 2 in female mice (англ.) // The Journal of Infectious Diseases : journal. — 1976. — June (vol. 133 Suppl). — P. A178—83. — PMID 6598.
- ↑ Juel-Jensen B.E. Varicella and cytosine arabinoside : [англ.] // The Lancet. — Elsevier, 1970. — Vol. 1, no. 7646 (March). — P. 572. — doi:10.1016/S0140-6736(70)90815-9. — PMID 4190397.
- ↑ Nahmias, A. J. Inhibitory effect of heparin on herpes simplex virus : [нем.] / A. J. Nahmias, S. Kibrick // Journal of Bacteriology : mag. — 1964. — Vol. 87, no. 5 (Mai). — P. 1060—1066. — PMID 4289440. — PMC 277146.
- ↑ Allen, L. B. Target-Organ Treatment of Neurotropic Virus Diseases: Efficacy as a Chemotherapy Tool and Comparison of Activity of Adenine Arabinoside, Cytosine Arabinoside, Idoxuridine, and Trifluorothymidine : [англ.] / L. B. Allen, R. W. Sidwell // Antimicrobial Agents and Chemotherapy : j. — 1972. — Vol. 2, no. 3 (September). — С. 229—233. — PMID 4790562. — PMC 444296.
- ↑ Allen L.B., Wolf S.M., Hintz C.J., Huffman J.H., Sidwell R.W. Effect of ribavirin on Type 2 Herpesvirus hominis (HVH/2) in vitro and in vivo : [англ.] // Annals of the New York Academy of Sciences : journal. — 1977. — Т. 284 (March). — P. 247—253. — doi:10.1111/j.1749-6632.1977.tb21957.x. — PMID 212976.
- ↑ Allen, L. B. Target-Organ Treatment of Neurotropic Virus Disease with Interferon Inducers : [англ.] / L. B. Allen, K. W. Cochran // Infection and Immunity : j. — 1972. — Vol. 6, no. 5 (November). — P. 819—823. — PMID 4404669. — PMC 422616.
- ↑ Sidwell, R. W. Broad-spectrum antiviral activity of Virazole: 1-beta-D-ribofuranosyl-1,2,4-triazole-3-carboxamide / R. W. Sidwell, J.H. Huffman, G. P. Khare … [и др.] // Science. — 1972. — Vol. 177, no. 4050 (август). — P. 705–706. — doi:10.1126/science.177.4050.705. — PMID 4340949.
- ↑ Babiuk L.A., Meldrum B., Gupta V.S., Rouse B.T. Comparison of the Antiviral Effects of 5-Methoxymethyl-deoxyuridine with 5-Iododeoxyuridine, Cytosine Arabinoside, and Adenine Arabinoside : [англ.] // Antimicrobial Agents and Chemotherapy : j. — 1975. — Vol. 8, no. 6 (December). — P. 643—650. — PMID 1239978. — PMC 429441.
- ↑ O'Meara A., Deasy P.F., Hillary I.B., Bridgen W.D. Acyclovir for treatment of mucocutaneous herpes infection in a child with leukaemia (англ.) // The Lancet : journal. — Elsevier, 1979. — December (vol. 2, no. 8153). — P. 1196. — doi:10.1016/S0140-6736(79)92428-0. — PMID 91931.
- ↑ Whitley R; Arvin A; Prober C; Burchett, Sandra; Corey, Lawrence; Powell, Dwight; Plotkin, Stanley; Starr, Stuart; Alford, Charles. A controlled trial comparing vidarabine with acyclovir in neonatal herpes simplex virus infection. Infectious Diseases Collaborative Antiviral Study Group (англ.) // The New England Journal of Medicine : journal. — 1991. — February (vol. 324, no. 7). — P. 444—449. — doi:10.1056/NEJM199102143240703. — PMID 1988829.
- ↑ 1 2 Kimberlin DW; Lin CY; Jacobs RF; Powell, D. A.; Corey, L.; Gruber, W. C.; Rathore, M.; Bradley, J. S.; Diaz, P. S. Safety and efficacy of high-dose intravenous acyclovir in the management of neonatal herpes simplex virus infections (англ.) // Pediatrics[англ.] : journal. — American Academy of Pediatrics[англ.], 2001. — August (vol. 108, no. 2). — P. 230—238. — doi:10.1542/peds.108.2.230. — PMID 11483782.
- ↑ Molecular Therapy. Molecular Therapy - Abstract of article: 801. RNA Gene Therapy Targeting Herpes Simplex Virus. Nature.com (1 мая 2006). Дата обращения: 12 апреля 2011. Архивировано 19 марта 2012 года.
- ↑ University of Florida News – Potential new herpes therapy studied. News.ufl.edu (3 февраля 2009). Дата обращения: 12 апреля 2011. Архивировано из оригинала 19 марта 2012 года.
- ↑ Fox, Maggie (2008-07-02). "New approach offers chance to finally kill herpes". Reuters. Дата обращения: 12 апреля 2011.
- ↑ Kingsbury, Kathleen A Cure for Cold Sores? Time (2 июля 2008). Дата обращения: 4 мая 2010.
- ↑ 1 2 Herpevac Trial for Women. Дата обращения: 4 марта 2008. Архивировано 20 октября 2007 года.
- ↑ Jon Cohen. aPainful Failure of Promising Genital Herpes Vaccine (англ.) // Science : journal. — 2010. — 15 October (vol. 330, no. 6002). — P. 304. — doi:10.1126/science.330.6002.304.
- ↑ http://www.acambis.com/default.asp-id=2052.htm (недоступная ссылка)
- ↑ Liza Green. Herpes Vaccine Developed at HMS Licensed for Preclinical Trials. FOCUS (7 марта 2008). Дата обращения: 5 мая 2019. Архивировано из оригинала 19 марта 2012 года.
- ↑ Harvard Medical School: from Herpes Vaccines (недоступная ссылка), 15. April 2011
- ↑ BioVex commences dosing in Phase 1 study of ImmunoVEX live attenuated genital herpes vaccine. See also: Your partner has herpes — now the good news from New Scientist.
- ↑ Halford W.P., Püschel R., Gershburg E., Wilber A., Gershburg S., Rakowski B. A live-attenuated HSV-2 ICP0 virus elicits 10 to 100 times greater protection against genital herpes than a glycoprotein D subunit vaccine (англ.) // PLoS ONE : journal. — 2011. — Vol. 6, no. 3. — P. e17748. — doi:10.1371/journal.pone.0017748. — PMID 21412438. — PMC 3055896.
