Гидросульфат калия: различия между версиями
Перейти к навигации
Перейти к поиску
| [непроверенная версия] | [непроверенная версия] |
Содержимое удалено Содержимое добавлено
Urbic (обсуждение | вклад) м →Преамбула: пунктуация |
Добавление хим. свойства, мелкие правки. |
||
| Строка 81: | Строка 81: | ||
Гидросульфат калия — бесцветные кристаллы {{Крист|синг=р|гр=''P bca''|a=0,840|b=0,979|c=1,893|alpha=|beta=|gamma=|Z=16|d=|рп=1|nocat=}}. |
Гидросульфат калия — бесцветные кристаллы {{Крист|синг=р|гр=''P bca''|a=0,840|b=0,979|c=1,893|alpha=|beta=|gamma=|Z=16|d=|рп=1|nocat=}}. |
||
Хорошо растворяется в воде, не растворяется в [[ацетон]]е и [[этанол]]е. |
Хорошо растворяется в воде, не растворяется в [[ацетон]]е и [[этанол]]е. Кристаллогидратов не образует. |
||
== Химические свойства == |
== Химические свойства == |
||
| Строка 89: | Строка 89: | ||
* При нагревании гидросульфат калия разлагается: |
* При нагревании гидросульфат калия разлагается: |
||
:: <math>\mathsf{2\ KHSO_4 \ \xrightarrow{240^oC}\ K_2SO_4 + H_2SO_4 }</math> |
:: <math>\mathsf{2\ KHSO_4 \ \xrightarrow{240^oC}\ K_2SO_4 + H_2SO_4 }</math> |
||
:: <math>\mathsf{2\ KHSO_4 \ \xrightarrow{320^oC}\ K_2S_2O_7 + H_2O }</math> |
:: <math>\mathsf{2\ KHSO_4 \ \xrightarrow{320-340^oC}\ K_2S_2O_7 + H_2O }</math> |
||
* Реакция с щелочами приводит к образованию средней соли: |
* Реакция с щелочами приводит к образованию средней соли: |
||
| Строка 95: | Строка 95: | ||
* Взаимодействует с некоторыми солями при сплавлении: |
* Взаимодействует с некоторыми солями при сплавлении: |
||
:: <math>\mathsf{KHSO_4 + KCl \ \xrightarrow{ |
:: <math>\mathsf{KHSO_4 + KCl \ \xrightarrow{450-700^oC}\ K_2SO_4 + HCl }</math> |
||
* Образует пероксидное соединение с концентрированным раствором [[пероксид водорода|пероксида водорода]]: |
|||
:: <math>\mathsf{KHSO_4 + H_2O_2 \ \xrightarrow{0^oC}\ KHSO_3(O_2) + H_2O }</math> |
|||
* При сплавлении переводит многие соединения в растворимую форму, например: |
* При сплавлении переводит многие соединения в растворимую форму, например: |
||
Версия от 20:25, 9 декабря 2022
| Гидросульфат калия | |
|---|---|
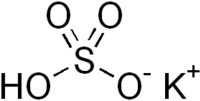 | |
 | |
| Общие | |
| Систематическое наименование |
Гидросульфат калия |
| Традиционные названия | Сернокислый калий, кислый; бисульфат калия |
| Хим. формула | KHSO4 |
| Физические свойства | |
| Состояние | белый порошок |
| Молярная масса | 136,17 г/моль |
| Плотность | 2,24-2,61; 2,322 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 210; 218,6; 222 °C |
| Энтальпия | |
| • образования | -1163,3 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 36,30; 121,6100 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7646-93-7 |
| PubChem | 516920 и 18674734 |
| Рег. номер EINECS | 231-594-1 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E515(ii) |
| RTECS | TS7200000 |
| Номер ООН | 2509 |
| ChemSpider | 56396 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гидросульфа́т ка́лия — кислая соль щелочного металла калия и серной кислоты с химической формулой KHSO4. Белый порошок.
Получение
- Действием серной кислоты на гидроксид калия:
- или сульфат калия:
- Кипячение с концентрированной серной кислотой безводного хлорида калия:
Физические свойства
Гидросульфат калия — бесцветные кристаллы ромбической сингонии, пространственная группа P bca, параметры ячейки a = 0,840 нм, b = 0,979 нм, c = 1,893 нм, Z = 16.
Хорошо растворяется в воде, не растворяется в ацетоне и этаноле. Кристаллогидратов не образует.
Химические свойства
- Водные растворы гидросульфата калия имеют кислую реакцию из-за диссоциации аниона:
- При нагревании гидросульфат калия разлагается:
- Реакция с щелочами приводит к образованию средней соли:
- Взаимодействует с некоторыми солями при сплавлении:
- Образует пероксидное соединение с концентрированным раствором пероксида водорода:
- При сплавлении переводит многие соединения в растворимую форму, например:
Применение
- Как компонент флюса в металлургии.
- Сульфирующий агент в производстве красителей.
- В аналитической химии для перевода некоторых соединений в легкорастворимые формы.
Литература
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |









