Хлорная кислота: различия между версиями
| [непроверенная версия] | [непроверенная версия] |
Нет описания правки |
|||
| Строка 21: | Строка 21: | ||
}} |
}} |
||
}} |
}} |
||
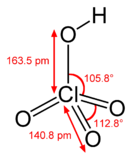
'''Хлорная кислота''' HClO<sub>4</sub> — одноосновная [[кислота]], одна из самых сильных (в водном растворе, pK ≈ −10), безводная — исключительно сильный [[окислитель]], так как содержит [[хлор]] в высшей [[Степень окисления|степени окисления]] +7. |
'''Хлорная кислота''' ([[химическая формула]] — '''HClO<sub>4</sub>''', {{Lang-la|Acidum perchloricum}}) — одноосновная [[кислота]], одна из самых сильных (в водном растворе, pK ≈ −10), безводная — исключительно сильный [[окислитель]], так как содержит [[хлор]] в высшей [[Степень окисления|степени окисления]] +7. |
||
== Свойства == |
== Свойства == |
||
| Строка 73: | Строка 73: | ||
== Получение == |
== Получение == |
||
Водные растворы хлорной кислоты получают электрохимическим окислением [[соляная кислота|соляной кислоты]] или [[хлор]]а, растворённых в концентрированной хлорной кислоте, а также обменным разложением [[перхлорат натрия|перхлоратов натрия]] или [[перхлорат калия|калия]] сильными неорганическими кислотами. При взаимодействии перхлоратов с серной кислотой образуется [[оксид хлора (VII)]] : |
|||
* <math> \mathsf{HCl + 2O_2 \ \xrightarrow{UV, q} HClO_4}</math> <math> \mathsf{Cl_2 + 7O_2 + H_2O \ \xrightarrow{UV, q} 2HClO_4}</math> |
* <math> \mathsf{HCl + 2O_2 \ \xrightarrow{UV, q} HClO_4}</math> |
||
*<math> \mathsf{Cl_2 + 7O_2 + H_2O \ \xrightarrow{UV, q} 2HClO_4}</math> |
|||
| ⚫ | |||
* |
|||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
<math> \mathsf{34NH_4ClO_4 + 36HNO_3 + 8HCl \rightarrow 34HClO_4 + 4Cl_2\uparrow + 35N_2O\uparrow + 73H_2O}</math> |
<math> \mathsf{34NH_4ClO_4 + 36HNO_3 + 8HCl \rightarrow 34HClO_4 + 4Cl_2\uparrow + 35N_2O\uparrow + 73H_2O}</math> |
||
Версия от 13:40, 21 августа 2023
| Хлорная кислота | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Хлорная кислота | ||
| Хим. формула | HClO4 | ||
| Физические свойства | |||
| Состояние | бесцветная жидкость | ||
| Молярная масса | 100,46 г/моль | ||
| Плотность | 1,76 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −102 °C | ||
| • кипения | 203 °C | ||
| Энтальпия | |||
| • образования | −40,4 кДж/моль | ||
| Химические свойства | |||
| Константа диссоциации кислоты | −10 | ||
| Растворимость | |||
| • в воде | смешивается | ||
| Классификация | |||
| Рег. номер CAS | 7601-90-3 | ||
| PubChem | 24247 | ||
| Рег. номер EINECS | 231-512-4 | ||
| SMILES | |||
| InChI | |||
| RTECS | SC7500000 | ||
| ChEBI | 29221 | ||
| Номер ООН | 1873 | ||
| ChemSpider | 22669 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Хлорная кислота (химическая формула — HClO4, лат. Acidum perchloricum) — одноосновная кислота, одна из самых сильных (в водном растворе, pK ≈ −10), безводная — исключительно сильный окислитель, так как содержит хлор в высшей степени окисления +7.
Свойства
Физические свойства
Бесцветная летучая жидкость, сильно дымящая на воздухе, в парах мономерна. Безводная хлорная кислота очень реакционноспособна и неустойчива.
Химические свойства
Жидкая HClO4 частично димеризована, для неё характерна равновесная автодегидратация:
Безводная кислота взрывоопасна из-за наличия в ней оксида хлора(VII). Водные растворы с концентрацией ниже 72 % более безопасны, но на свету желтеют с образованием взрывоопасных оксидов хлора. Пожелтевшую кислоту рекомендуется аккуратно разбавить и нейтрализовать щелочами или карбонатами.
Являясь сильной неустойчивой кислотой, хлорная кислота разлагается:
Хлорную кислоту и её соли (перхлораты) применяют как окислители. Хлорная кислота, как одна из самых сильных кислот и окислитель, растворяет золото и платиновые металлы:
а в реакции с серебром образует хлорноватую кислоту:
Неметаллы и активные металлы восстанавливают концентрированную хлорную кислоту до хлороводорода
- (данная реакция используется в металлургии для очистки руд.
Аммиак окисляется в концентрированной хлорной кислоте до азотной кислоты:
В отличие от других кислот, хлорная при этом не образует соответствующей соли аммония.
Разбавленная хлорная кислота обладает слабыми окислительными свойствами (не окисляет сероводород, диоксид серы, иодоводород, хром(II), азотистую кислоту) и при реакции с металлами до водорода в электрохимическом ряду выделяет водород с образованием перхлоратов. Водные растворы хлорной кислоты устойчивы.
Хлорная кислота хорошо растворима во фтор- и хлорорганических растворителях, таких, как CF3COOH, CHCl3, CH2Cl2 и др. Смешивание с растворителями, проявляющими восстановительные свойства (например, с диметилсульфоксидом), может привести к воспламенению и взрыву. С водой хлорная кислота смешивается в любых соотношениях и образует ряд гидратов HClO4·nH2O (где n = 0,25…4). Моногидрат HClO4·H2O имеет ионную природу и температуру плавления +50 °C. Хлорная кислота с водой образует азеотропную смесь, кипящую при 203 °C и содержащую 72 % хлорной кислоты. Растворы хлорной кислоты в хлорсодержащих углеводородах являются сверхкислотами (суперкислотами). Хлорная кислота является одной из сильнейших неорганических кислот, в её среде даже кислотные соединения ведут себя как основания, присоединяя протон и образуя катионы ацилперхлоратов: P(OH)4+ClO4−, NO2+ClO4−.
При слабом нагревании при пониженном давлении смеси хлорной кислоты с фосфорным ангидридом, отгоняется бесцветная маслянистая жидкость — хлорный ангидрид:
Соли хлорной кислоты называются перхлоратами. Их большинство растворимо в воде. Малорастворимы перхлораты калия, цезия и рубидия. Перхлорат йода в лаборатории получают при обработке раствора йода в безводной хлорной кислоте озоном:
Перхлорат фтора можно получить прямым синтезом:
2F2+4HClO4→4FClO3+2H2O+О2↑
Получение
Водные растворы хлорной кислоты получают электрохимическим окислением соляной кислоты или хлора, растворённых в концентрированной хлорной кислоте, а также обменным разложением перхлоратов натрия или калия сильными неорганическими кислотами. При взаимодействии перхлоратов с серной кислотой образуется оксид хлора (VII) :
Для получения безводной хлорной кислоты требуется нагрев насыщенного раствора перхлората аммония с добавлением азотной, а затем и соляной кислоты, вследствие чего образуется хлорная кислота, вода, хлор и оксид азота (I):
Для получения особо чистого оксида хлора семь требуется нагрев сухих хлоратов металлов с жидким фторидом кислорода:
Применение
- Концентрированные водные растворы хлорной кислоты широко используются в аналитической химии, а также для получения перхлоратов.
- Хлорная кислота применяется при разложении сложных руд, при анализе минералов, а также в качестве катализатора.
- Соли хлорной кислоты: перхлорат калия малорастворим в воде, применяется в производстве взрывчатых веществ, перхлорат магния (ангидрон) — осушитель, перхлорат аммония — добавка к ракетному топливу и взрывчатое вещество.
Безводную хлорную кислоту нельзя длительно хранить и перевозить, так как при хранении в обычных условиях она медленно разлагается, окрашивается оксидами хлора, образующимися при её разложении, и может самопроизвольно взрываться. Зато её водные растворы вполне устойчивы.
Литература
- Ахметов Н. С. Общая и неорганическая химия. — М., 2001.
- Реми Г. Курс неорганической химии. — М.: Иностранная литература, 1963.