Хлорсульфоновая кислота: различия между версиями
Перейти к навигации
Перейти к поиску
| [непроверенная версия] | [непроверенная версия] |
Содержимое удалено Содержимое добавлено
Ptichka (обсуждение | вклад) свойства |
Ptichka (обсуждение | вклад) родственные соединения |
||
| Строка 28: | Строка 28: | ||
==Свойства== |
==Свойства== |
||
Хлорсульфоновая кислота не образует солей. Она бурно реагирует с водой, распадаясь на [[Серная кислота|серную кислоту]] и хлороводород: |
|||
::ClSO<sub>2</sub>OH + H<sub>2</sub>O → HCl + H<sub>2</sub>SO<sub>4</sub> |
::ClSO<sub>2</sub>OH + H<sub>2</sub>O → HCl + H<sub>2</sub>SO<sub>4</sub> |
||
| Строка 34: | Строка 34: | ||
::R-H + ClSO<sub>2</sub>OH → RSO<sub>2</sub>OH + HCl |
::R-H + ClSO<sub>2</sub>OH → RSO<sub>2</sub>OH + HCl |
||
::CH<sub>3</sub>C<sub>6</sub>H<sub>5</sub> + ClSO<sub>2</sub>OH → CH<sub>3</sub>C<sub>6</sub>H<sub>4</sub>SO<sub>2</sub>Cl + HCl |
::CH<sub>3</sub>C<sub>6</sub>H<sub>5</sub> + ClSO<sub>2</sub>OH → CH<sub>3</sub>C<sub>6</sub>H<sub>4</sub>SO<sub>2</sub>Cl + HCl |
||
Благодаря этим реакциям, HSO<sub>3</sub>Cl широко применяется в качестве сульфурирующего агента в органической химии. |
|||
==Родственные соединения== |
|||
* [[Фторсульфоновая кислота]] FSO<sub>2</sub>OH]] - очень сильная кислота, в незначительной степени гидролизующаяся водой. |
|||
* Бромосульфоновая кислота BrSO<sub>2</sub>OH - нестабильная кислота, разлагающаяся при температуре плавления 8°C Br<sub>2</sub>, SO<sub>2</sub> и H<sub>2</sub>SO<sub>4</sub>. |
|||
* Йодосульфоновая кислота неизвестна. |
|||
Версия от 02:55, 24 февраля 2009
| Хлорсульфоновая кислота | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Хлорсульфоновая кислота | ||
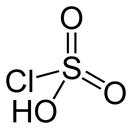
| Хим. формула | HSO3Cl | ||
| Физические свойства | |||
| Состояние | бесцветная дымящаяся жидкость | ||
| Молярная масса | 116.52 г/моль | ||
| Плотность | 1,77 (18°C) | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -80.5 °C | ||
| • кипения | 151 °C | ||
| • разложения | 151 °C | ||
| Энтальпия | |||
| • образования | -555,2 (ж) кДж/моль | ||
| Классификация | |||
| Рег. номер CAS | [7790-94-5] | ||
| PubChem | 24638 | ||
| Рег. номер EINECS | 232-234-6 | ||
| SMILES | |||
| InChI | |||
| RTECS | FX5730000 | ||
| Номер ООН | 1754 | ||
| ChemSpider | 23040 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Хлорсульфо́новая кислота, HSO3Cl - монохлоангидрид cерной кислоты, бесцветная, дымящая на воздухе и резко пахнущая жидкость.
Свойства
Хлорсульфоновая кислота не образует солей. Она бурно реагирует с водой, распадаясь на серную кислоту и хлороводород:
- ClSO2OH + H2O → HCl + H2SO4
С органическими соединениями хлорсульфоновая кислота взаимодействует, образуя, в зависимости от условий, сульфоновые кислоты или их хлориды:
- R-H + ClSO2OH → RSO2OH + HCl
- CH3C6H5 + ClSO2OH → CH3C6H4SO2Cl + HCl
Благодаря этим реакциям, HSO3Cl широко применяется в качестве сульфурирующего агента в органической химии.
Родственные соединения
- Фторсульфоновая кислота FSO2OH]] - очень сильная кислота, в незначительной степени гидролизующаяся водой.
- Бромосульфоновая кислота BrSO2OH - нестабильная кислота, разлагающаяся при температуре плавления 8°C Br2, SO2 и H2SO4.
- Йодосульфоновая кислота неизвестна.
Получение
Получают хлосульфоновую кислоту непосредственно при взаимодействии хлороводорода с оксидом серы(VI) :
- HCl + SO3 → ClSO2OH,
или при взаимодействии концентрированной серной кислоты с трихлоридом- или пентахлоридом фосфора:
- PCl5 + SO2(OH)2 → ClSO2OH + POCl3 + HCl
Литература
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
- Ф. Коттон, Дж. Уилкинсон «Современная неорганическая химия» М.: Мир, 1969
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |