Фторид иода(VII): различия между версиями
| [непроверенная версия] | [отпатрулированная версия] |
→Методы получения: унификация формул |
|||
| Строка 48: | Строка 48: | ||
== Методы получения == |
== Методы получения == |
||
* Известен метод получения гептафторида взаимодействием иода с [[фторид]]ами металлов, например, [[Фторид серебра|фторидом серебра]]. Такую реакцию впервые наблюдал Каммерер. Однако, в таких условиях также получается [[пентафторид иода]]: |
* Известен метод получения гептафторида взаимодействием иода с [[фторид]]ами металлов, например, [[Фторид серебра(I)|фторидом серебра]]. Такую реакцию впервые наблюдал Каммерер. Однако, в таких условиях также получается [[пентафторид иода]]: |
||
: I<sub>2</sub> + 14AgF → 2IF<sub>7</sub> + 14Ag. |
|||
:: <math>\mathsf{I_2 + 14AgF \rightarrow IF_7 + 14Ag}</math> |
|||
* Также применяется метод получения из простых веществ. Для этого фтор пропускают над иодом в [[Платина|платиновом]] реакторе. Сначала образуется [[пентафторид иода]], который при 270 °C реагирует с иодом и образуется гептафторид. |
* Также применяется метод получения из простых веществ. Для этого фтор пропускают над иодом в [[Платина|платиновом]] реакторе. Сначала образуется [[пентафторид иода]], который при 270 °C реагирует с иодом и образуется гептафторид. |
||
: I<sub>2</sub> + 5F<sub>2</sub> → 2IF<sub>5</sub> |
|||
:: <math>\mathsf{I_2 + 5F_2 \rightarrow 2IF_5}</math> |
|||
: IF<sub>5</sub> + F<sub>2</sub> → IF<sub>7</sub>. |
|||
:: <math>\mathsf{IF_5 + F_2 \rightarrow IF_7}</math> |
|||
* Чаще всего применяют взаимодействие пентафторида иода с фтором, при этом проходят процессы аналогичные второй стадии предыдущего метода. |
* Чаще всего применяют взаимодействие пентафторида иода с фтором, при этом проходят процессы аналогичные второй стадии предыдущего метода. |
||
* Продукт, полученный вышеописанными методами, всегда загрязнён примесью IOF<sub>5</sub> за счёт [[гидролиз]]а IF<sub>5</sub>. Поэтому, для получения чистого продукта можно применять метод взаимодействия фтора с сухими [[Иодиды|иодидами]]<ref name="Bartlett" />. Например: |
* Продукт, полученный вышеописанными методами, всегда загрязнён примесью IOF<sub>5</sub> за счёт [[гидролиз]]а IF<sub>5</sub>. Поэтому, для получения чистого продукта можно применять метод взаимодействия фтора с сухими [[Иодиды|иодидами]]<ref name="Bartlett" />. Например: |
||
: PdI<sub>2</sub> + 7F<sub>2</sub> → 2IF<sub>7</sub> + Pd. |
|||
:: <math>\mathsf{PdI_2 + 9F_2 \rightarrow 2IF_7 + PdF_4}</math> |
|||
== Химические свойства == |
== Химические свойства == |
||
Версия от 02:48, 28 августа 2012
| Фторид иода(VII) | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Фторид иода (VII) | ||
| Хим. формула | IF7 | ||
| Физические свойства | |||
| Молярная масса | 259,89 г/моль | ||
| Плотность | 2,7 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 4,5 °C | ||
| • кипения | 4,77 °C | ||
| • разложения | 350 °C | ||
| Классификация | |||
| Рег. номер CAS | 16921-96-3 | ||
| PubChem | 85645 | ||
| Рег. номер EINECS | 240-981-4 | ||
| SMILES | |||
| InChI | |||
| ChemSpider | 21477354 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Фторид иода(VII) (гептафторид иода), IF7 — бесцветное газообразное вещество (при 20 °C) с резким запахом, высший фторид иода, в котором атом иода проявляет степень окисления +7.
Физическо-химические свойства
До сегодняшнего дня нет единого мнения о температурах фазового перехода соединения, поскольку его сложно отчистить от примеси IOF5, который занижает температуру плавления. По некоторым данным, температура плавления соединения находится в пределах 6,4 ± 0,1°С[1].
| Свойство | Значение[2] |
|---|---|
| Энтальпия образования (298 К, в газовой фазе) | −122,22 кДж/моль(по другим данным[3] −229,80 кДж/моль) |
| Энтропия образования (300 К, в газовой фазе) | 355,16 Дж/(моль·К) |
| Теплоёмкость (300 К, в газовой фазе) | 137,09 Дж/(моль·К) |
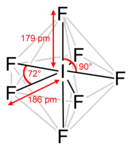
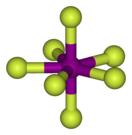
Строение
Пентагонально-бипирамидальное строение молекулы подтверждено спектроскопически при помощи ИК, КР и ЯМР-19F спектроскопии.
Методы получения
- Известен метод получения гептафторида взаимодействием иода с фторидами металлов, например, фторидом серебра. Такую реакцию впервые наблюдал Каммерер. Однако, в таких условиях также получается пентафторид иода:
- Также применяется метод получения из простых веществ. Для этого фтор пропускают над иодом в платиновом реакторе. Сначала образуется пентафторид иода, который при 270 °C реагирует с иодом и образуется гептафторид.
- Чаще всего применяют взаимодействие пентафторида иода с фтором, при этом проходят процессы аналогичные второй стадии предыдущего метода.
- Продукт, полученный вышеописанными методами, всегда загрязнён примесью IOF5 за счёт гидролиза IF5. Поэтому, для получения чистого продукта можно применять метод взаимодействия фтора с сухими иодидами[1]. Например:
Химические свойства
Химические свойства гептафторида иода во многом схожи со свойствами трифторида хлора. Химически чрезвычайно активен и агрессивен к большинству материалов. Сильный окислитель.
- Достаточно часто, в начале реакции молекула гептафторида отщепляет 2 атома фтора, которые участвуют в дальнейшей реакции, а IF5 выделяется с продуктами:
- 2B + 3IF7 → 2BF3 + 3IF5
- Углекислый газ сгорает в присутствии IF7 с образованием простого иода:
- 7CO2 + 4IF7 → 2I2 + 7CF4 + 7O2
- Гидролизуется водой, при этом образуется ортоиодная кислота и фтороводород:[4]
- IF7 + 6H2O → H5IO6 + 7HF
- Реагирует с диоксидом кремния и стеклом с образованием оксопентафторида иода и тетрафторида кремния:
- 2IF7 + SiO2 → SiF4 + 2IOF5
- С некоторыми фторидами (AsF5, SbF5, BF3)[5] образует комплексные соединения, которые вполне устойчивы до темперутур около 140 °C. Предположительно, структура таких соединений ионная: IF6+·AsF6−.
- IF7 + AsF5 → IF7·AsF5
- Органические соединения при контакте с гептафторидом иода воспламеняются с образованием массы различных продуктов, которые обычно не полностью идентифицированы.
Применение
Нашёл некоторое применение в органическом синтезе.[6]
Опасности
Гептафторид иода высокоопасен, очень сильно раздражает кожу и слизистые оболочки.
См. также
Литература
- Химия галоидных соединений фтора. Николаев Н. С., Сухоруков В. Ф., Шишков Ю. Д., Аленчикова И. Ф. — М.: Наука, 1968, с.344.
Примечания
- ↑ 1 2 англ. Bartlett, Levchuk, Proc. Chem. Soc., 1963, P.362
- ↑ англ. R.K. Khanna J. Mol. Spectr., 1962, V.8, P.134
- ↑ The enthalpies of formation of iodine pentafluoride and iodine heptafluoride. Journal of Inorganic and Nuclear Chemistry. V. 28, 1976, P. 135—140
- ↑ IF7 на сайте «Химия и токсикология»
- ↑ Acceptor properties of iodine heptafluoride: octafluoroperiodates(VII). Inorganic and Nuclear Chemistry Letters. V. 10, Issue 10, 1974, P. 831—835
- ↑ Успехи химии, 1984, Том 53, Номер 12, Страницы 2024—2055.