Иодная кислота: различия между версиями
| [непроверенная версия] | [непроверенная версия] |
Нет описания правки |
|||
| Строка 46: | Строка 46: | ||
== Применение == |
== Применение == |
||
Иодная кислота и ее соли применяются в [[аналитическая химия|аналитической химии]] как окислители и при анализе структуры [[углеводы|углеводов]]. |
Иодная кислота и ее соли применяются в [[аналитическая химия|аналитической химии]] как окислители и при анализе структуры [[углеводы|углеводов]]. |
||
Йодную кислоту или ее соли используют для окислительного расщепления виц-диолов до альдегидов. Тандем 1.OsO4 2.NaIO4 в современном органическом синтезе встречается довольно часто для окисления алкенов до альдегидов ( на первой стадии образуется виц-диол, на второй он расщепляется). В органической химии эта реакция часто называется реакцией Малапарада. |
|||
{{inorganic-compound-stub}} |
{{inorganic-compound-stub}} |
||
Версия от 05:56, 30 сентября 2012
| Иодная кислота | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Иодная кислота | ||
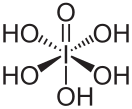
| Хим. формула | H5IO6 | ||
| Физические свойства | |||
| Состояние | бесцветные кристаллы | ||
| Молярная масса | 227.941 г/моль | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 122 °C | ||
| • разложения | 130–140 °C | ||
| Классификация | |||
| Рег. номер CAS | [10450-60-9] | ||
| PubChem | 25289 | ||
| Рег. номер EINECS | 233-937-0 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 29150 | ||
| ChemSpider | 23622 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Иодная кислота HIO4 (Н5IO6)— слабая кислота, гигроскопичное кристаллическое вещество.
Свойства
Иодная кислота хорошо растворима в воде. В водном растворе Н5IO6 – слабая кислота (K1 = 5⋅10−4; K2 = 2⋅10−7; K3 = 10−15)[источник не указан 4982 дня].
В растворах существует ряд гидратов состава mHIO4•nН2О, которые можно рассматривать как представителей ряда многоосновных кислот H3IO5, H4I2O9, H5IO6 и т. д. Их устойчивость зависит от концентрации раствора. Ион (IO6)5− имеет октаэдрическую структуру (dI-O = 185 нм).

Кислотные свойства НIO4 выражены несравненно слабее, чем у HClO4, в то время, как она проявляет более сильные окислительные свойства(E0(HIO4/HIO3) = 1,64 В.). Отвечающий ей ангидрид неизвестен. При нагревании НIO4разлагается по уравнению:
- 2НIO4 → Н2О + I2O5 + О2
Периодаты
В зависимости от условий реакции (концентрация, рН) иодная кислота образует ряд солей, содержащих ионы, IO65−, IO53−, IO4−и I2O94− – соответственно орто-, мезо-, мета- и дипериодаты.
Соли иодной кислоты (периодаты) являются сильными окислителями, при нагревании разлагаются с выделением кислорода и иодида:
- NaIO4 → NaI + 2O2↑.
Периодаты могут быть получены окислением иодатов в щелочной среде сильными окислителями, например хлором:
- NaIO3 + 2NaOH + Cl2 → NaIO4 + 2NaCl + H2O.
Применение
Иодная кислота и ее соли применяются в аналитической химии как окислители и при анализе структуры углеводов.
Йодную кислоту или ее соли используют для окислительного расщепления виц-диолов до альдегидов. Тандем 1.OsO4 2.NaIO4 в современном органическом синтезе встречается довольно часто для окисления алкенов до альдегидов ( на первой стадии образуется виц-диол, на второй он расщепляется). В органической химии эта реакция часто называется реакцией Малапарада.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |