Кофермент A: различия между версиями
| [непроверенная версия] | [отпатрулированная версия] |
Скорее всего просто была опечатка |
JackieBot (обсуждение | вклад) м бот: автоматизированная замена текста (-{{Шаблон: +{{) |
||
| Строка 117: | Строка 117: | ||
* [[Племенков, Виталий Владимирович|Племенков, В. В.]] Введение в химию природных соединений / В. В. Племенков. – Казань: КГУ, 2001. – 376 с. |
* [[Племенков, Виталий Владимирович|Племенков, В. В.]] Введение в химию природных соединений / В. В. Племенков. – Казань: КГУ, 2001. – 376 с. |
||
{{ |
{{Кофакторы ферментов}} |
||
Версия от 20:48, 22 февраля 2015
| Кофермент A | |
|---|---|
  | |
| Общие | |
| Систематическое наименование |
'"`UNIQ--nowiki-00000000-QINU`"' |
| Традиционные названия | Коэнзим-А |
| Хим. формула | C21H36N7O16P3S |
| Физические свойства | |
| Молярная масса | 767,534 ± 0,031 г/моль |
| Классификация | |
| Рег. номер CAS | 85-61-0 |
| PubChem | 68163312 |
| Рег. номер EINECS | 201-619-0 |
| SMILES | |
| InChI |
|
| ChEBI | 15346 |
| ChemSpider | 79067 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Кофермент А (коэнзим А, КоА, СоА, HSKoA) — кофермент ацетилирования; один из важнейших коферментов, принимающий участие в реакциях переноса ацильных групп при синтезе и окислении жирных кислот и окислении пирувата в цикле лимонной кислоты.[1]
Строение
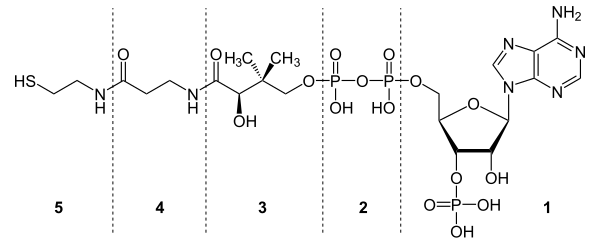
Молекула КоА состоит из остатка адениловой кислоты (1), связанной пирофосфатной группой (2) с остатком пантотеновой кислоты (3), которая в свою очередь связанна пептидной связью с аминокислотой β-аланином (4) (эти две группы представляют собой остаток пантотеновой кислоты), соединённой пептидной связью с остатком β-меркаптоэтаноламина (5).
Биосинтез
Кофермент А синтезируется в пять этапов из пантотеновой кислоты (витамина B5) и цистеина:
- Пантотеновая кислота фосфорилируется в 4'-фосфопантотенат с помощью фермента пантотенаткиназы
- Цистеин присоединяется к 4'-фосфопантотенату с помощью фермента фосфопантотеноилцистеинсинтетазы с образованием 4'-фосфо-N-пантотеноилцистеина
- 4'-фосфо-N-пантотеноилцистеин декарбоксилируется с образованием 4'-фосфопантотеина с помощью фермента фосфопантотеноилцистеиндекарбоксилазы
- 4'-фосфопантотеин с адениловой кислотой формирует дефосфо-КоА под действием фермента фосфопантотеинаденилтрансферазы
- Наконец, дефосфо-КоА фосфорилируется АТФ в кофермент А с помощью фермента дефосфокоэнзимкиназы.
Биохимическая роль
С КоА связан ряд биохимических реакций, лежащих в основе окисления и синтеза жирных кислот, биосинтеза жиров, окислительных превращений продуктов распада углеводов. Во всех случаях КоА действует в качестве промежуточного звена, связывающего и переносящего кислотные остатки на другие вещества. При этом кислотные остатки в составе соединения с КоА подвергаются тем или иным превращениям, либо передаются без изменений на определённые метаболиты.
История открытия
Впервые кофермент был выделен из печени голубя в 1947 году Ф. Липманом.[2] Структура кофермента А была определена в начале 1950-х годов Ф. Линеном в Институте Листера в Лондоне. Полный синтез КоА осуществил в 1961 году X. Корана.
Список ацил-КоА
Из природных соединений выделены и идентифицированы различные ацильные производные кофермента А:
Ацил-КоА из карбоновых кислот:
- Ацетил-КоА
- Пропионил-КоА
- Ацетоацетил-КоА
- Кумарол-КоА
- Бутирил-КоА
Ацил-КоА из дикарбоновых кислот:
- Малонил-КоА
- Сукцинил-КоА
- Гидроксиметилглютарил-КоА
- Пименил-КоА
Ацил-КоА из карбоциклических кислот:
- Бензоил-КоА
- Фенилацетил-КоА
Существуют также разнообразные ацил-КоА жирных кислот, которые играют большое значение в качестве субстратов для реакций синтеза липидов.
См. также
Примечания
- ↑ Овчинников Ю. А. Биоорганическая химия / Ю. А. Овчинников. — М.: Просвещение, 1987. — 815 с., ил.
- ↑ Baddiley, J.; Thain, E. M.; Novelli, G. D.; Lipmann, F. (1953). "Structure of Coenzyme A". Nature. 171 (4341): 76. doi:10.1038/171076a0.
Литература
- Филиппович, Ю. Б. Основы биохимии: Учеб. для хим. и биол. спец. пед. ун-тов и ин-тов / Ю. Б. Филиппович. – 4-е изд., перераб. и доп. – М.: «Агар», 1999. – 512 с., ил.
- Березов, Т. Т. Биологическая химия: Учебник / Т. Т. Березов, Б. Ф. Коровкин. – 3-е изд., перераб. и доп. – М.: Медицина, 1998. – 704 с., ил.
- Овчинников, Ю. А. Биоорганическая химия / Ю. А. Овчинников. – М.: Просвещение, 1987. – 815 с., ил.
- Племенков, В. В. Введение в химию природных соединений / В. В. Племенков. – Казань: КГУ, 2001. – 376 с.