Долутегравир: различия между версиями
| [непроверенная версия] | [непроверенная версия] |
ReTTTT (обсуждение | вклад) |
ReTTTT (обсуждение | вклад) |
||
| Строка 199: | Строка 199: | ||
Возникновение [[Липодистрофия|липодистрофии]], ассоциированная с приемом ВААРТ, при приеме долутегравира не изучено<ref name="сша" />. |
Возникновение [[Липодистрофия|липодистрофии]], ассоциированная с приемом ВААРТ, при приеме долутегравира не изучено<ref name="сша" />. |
||
Редко (менее 1%) могут встречаться: [[суицид]]альные мысли, [[гепатит]]. Менее 2% [[миозит]] и [[почечная недостаточность]]<ref name="сша" />. От 1% до 10% встречается: утомляемость, бессонница, головокружение, необычные сновидения и фантазии, [[депрессия]], [[рвота]], [[метеоризм]], боли в верхней части живота, боли и дискомфорт в области живота, сыпь, зуд, повышение [[АЛТ]], [[Аспартатаминотрансфераза|АСТ]], [[КФК]], [[креатинин]]а |
Редко (менее 1%) могут встречаться: [[суицид]]альные мысли, [[гепатит]]. Менее 2% [[миозит]] и [[почечная недостаточность]]<ref name="сша" />. От 1% до 10% встречается: утомляемость, бессонница, головокружение, необычные сновидения и фантазии, [[депрессия]], [[рвота]], [[метеоризм]], боли в верхней части живота, боли и дискомфорт в области живота, сыпь, зуд, повышение [[АЛТ]], [[Аспартатаминотрансфераза|АСТ]], [[КФК]], [[креатинин]]а, общего [[билирубин]]а<ref name="рф" /><ref name="ес" />, глюкозы, липазы, нейтрофилов. Более 10%: головная боль, тошнота, [[диарея]]<ref name="рф" /><ref name="ес" />. |
||
Ввиду возможного головокружения пациенты должны быть предупреждены об осторожности при вождении автомобиля и применении машин<ref name="ес" />. |
Ввиду возможного головокружения пациенты должны быть предупреждены об осторожности при вождении автомобиля и применении машин<ref name="ес" />. |
||
Версия от 14:42, 4 сентября 2016
| Долутегравир | |
|---|---|
 | |
 | |
| Химическое соединение | |
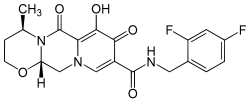
| ИЮПАК | (4R,12aS)-N-(2,4-difluorobenzyl)-7-hydroxy-4-methyl-6,8-dioxo-3,4,6,8,12,12a-hexahydro-2H-pyrido[1',2':4,5]pyrazino[2,1-b][1,3]oxazine-9-carboxamide |
| Брутто-формула | C20H19F2N3O5 |
| Молярная масса | 419.38 г/моль |
| CAS | 1051375-16-6 |
| PubChem | 54726191 |
| DrugBank | DB08930 |
| Состав | |
| Классификация | |
| АТХ | J05AX12 |
| Фармакокинетика | |
| Биодоступн. | неизвестно |
| Связывание с белками плазмы | около 99% |
| Метаболизм | UGT1A1 и CYP3A |
| Период полувывед. | ~14 часов |
| Экскреция | Фекалии (53%) и моча (32%) |
| Способы введения | |
| перорально | |
Долутегравир (англ. Dolutegravir, DTG) — противовирусное средство для лечения ВИЧ из класса ингибиторов интегразы.
Препарат также известен как «S/GSK1349572», «SV 572», «572». Долутегравир изобретен компаний «ViiV Healthcare» (совместное предприятие «GlaxoSmithKline» и «Pfizer») и выпускается под коммерческим названием Тивикай (англ. Tivicay), а также в составе комбинированного препарата Триомек (англ. Triomeq).
Одобрение
Средство одобрено в большинстве западных стран в качестве одного из компонентов высокоактивной антиретровирусной терапии. В США одобрено FDA 13 августа 2013 года[1], в Канаде — 4 ноября 2013 года[2], в Евросоюзе EMEA— 16 января 2014 года[3], в России — 16 июля 2014 года[4].
Исследования
Профиль безопасности долутегравира оценивался по анализу данных от двух международных многоцентровых двойных слепых испытаний SPRING-2 (ING113086 и SINGLE (ING114467), и данных международного многоцентрового исследования FLAMINGO (ING114915)[5].
Показания
Лечение ВИЧ-1 инфекции у взрослых и детей старше 12 лет и массой тела более 40 кг (более 30 кг[5]) в составе ВААРТ[6][7].
Препарат рекомендуется для применения как у пациентов, не получавших терапии («наивных»), так и у пациентов с опытом ВААРТ. Применение ограничено у пациентов, имеющих частичную резистентность к ингибиторам интегразы[5].
Противопоказание
Реакции гиперчувствительности на долутегравир (и вспомогательных веществ).
Прием антиаритмического средства Дофетилида (англ. Dofetilide, коммерческое наименование англ. Tikosyn)[6][5][7].
Возраст младше 12 лет и масса тела менее 40 кг[6] (менее 30 кг[5]).
Фармакологические свойства
Фармакодинамика
Механизм действия
Долутегравир блокирует фермент интегразу ВИЧ-1, связываясь с её активным участком, делая невозможным этап переноса цепей во время интеграции ретровирусной ДНК в ДНК клетки, тем самым прерывая весь цикл репликации ВИЧ[6][5][7].
Влияние на почки
Влияние на ЭКГ
Влияние на обмен билирубина
Конкуренция долутегравира и билирубина за УДФ-ГТ может приводить к клинически незначимому повышению общего билирубина[6].
Фармакокинетика
Фармакокинетические свойства в целом сходны у здоровых и ВИЧ-инфицированных людей[6][5][7].
Всасывание
Долутегравир быстро всасывается после приеме внутрь. Среднее время достижения максимальной концентрации — 2-3 часа[6][5][7]. При приеме 1 раз в день фармакокинетическое стационарное состояние достигается примерно через 5 дней после начала приема внутрь[5].
Пища повышает степень и снижает скорость всасывания долутегравира[6][5][7]. Данные изменения как правило клинически не значимы, поэтому Тивикай можно принимать вне зависимости от приема пищи[6][5]. Однако пациентам, инфицированным ВИЧ-1 с определенной устойчивостью к ингибиторам интегразы, рекомендуется принимать Тивикай с пищей[7].
Абсолютная биодоступность долутегравира не установлена[6][5][7].
Распределение
Долутегравир примерно на 99% связывается белками крови. По разным данным кажущийся объём распределения (Vd/F) вариирует от 12.5 до 20 литров. Степень связывание долутегравира с белками крови не зависит от его концентрации[6][5][7].
Долутегравир проникает в спиномозговую жидкость, снижая концентрацию ВИЧ в ней[6][7]. Клиническая значимость этого факта пока не установлена[5].
Долутегравир обнаруживается в тканях половых путей и прямой кишки[6][7].
Метаболизм и выведение
Долутегравир в неизменённом виде циркулирует в плазме крови.
Долутегравир метаболизируется в основном ферментом УДФ-ГТ 1А1 (англ. UGT1A1), в меньшей степени — CYP3A.
53% от общей принятой дозы выводится с фекалиями в неизменённом виде. При этом неизвестно соотношения полного или неполного всасывания в кишечнике и выведение препарата с желчью. 32% от общей принятой дозы выводится с мочой, при этом 18,9% в виде эфира глюкуронида долутегравира, 3,6% в виде N-деалкилированого метаболита, 3% в виде метаболита, образуется путем окисления бензильного атома углерода, 1% в неизменённом виде.
Долутегравир имеет конечный период полувыведения составляет приблизительно 14 часов, а явный клиренс (CL/F) — 0,56[6]-1,0 л/час[5][7].
Особые группы пациентов
Дети
Исследования показали, что у ВИЧ-1-инфицированных детей (от 12 до 18 лет) весом до 40 кг при приеме 50 мг (и от 30 до 40 кг при приеме 35 мг[5]) 1 раз в день имеют схожую фармакокинетику с аналогичной схемой у взрослых[6][7].
Пациенты пожилого возраста.
Возраст не имеет значения для фармакокинетики долутегравира. При этом данные по ациентам старше 65 лет ограниченны[6][5][7].
Пол
Пол не имеет значения для фармакокинетики долутегравира.
Раса
Раса не имеет значения для фармакокинетики долутегравира.
Пациенты с почечной недостаточностью
Выведение через почки является вторым по значимости путем выведения долутегравира. У пациентов с тяжелой почечной недостаточностью отмечается снижение экспозиции долутегравира. Механизм этого не известен. Как правило почечная недостаточность клинически незначима и не требует корректировки дозы[6][7]. Однако у пациентов с тяжелой почечной недостаточностью и наличием частичной резистентности ВИЧ-1 к ингибиторам интегразы следует проявить осторожность[5]. Долутегравир не был изучен у пациентов, получающих диализ.
Пациенты с печеночной недостаточностью
Метаболизм в печени и выделение с желчью является основным путем выведения долутегравира. При исследовании пациентов с средней печеночной недостаточностью (класс B по Чайлд—Пью) не было выявлено значимых отклонений фармакодинамики. Корректировка дозы при легкой и средней печеночной недостаточности не требуется. У пациентов с тяжелой недостаточностью эффекты не изучались[6][7] и препарат не рекомендуется[5].
Коинфекция ВИЧ и вирусных гепатитов B и C
Коинфекция гепатитом C не имеет значения для фармакокинетики долутегравира. Данные по коинфекция гепатитом B ограничены[6][5][7].
Полиморфизм метаболизирующих долутегравир ферментов
Нет доказательств, что распространенные полиморфизмы метаболизирующих долутегравир ферментов имеют клиническое значение[6][5][7].
Побочные эффекты
Реакция гиперчувствительности
В редких случаях (менее 1%) были зарегистрированы реакции гиперчувствительности, проявляющихся сыпью (от «крапивницы» до буллёзной), поражением слизистых, сопровождающиеся лихорадкой, болями в мышцах и суставах, слабостью и недомоганием, ангионевротическим отёком, эозинофилией и другими нарушениям вплоть до органной дисфункции, тяжелой печеночной недостаточностью. Развитие реакции гиперчувствительности требует немедленного прекращения приёма препарата[6][5][7].
Синдром восстановления иммунитета
У пациентов с тяжелым иммунодефицитом при начале приема ВААРТ возможно возникновение синдрома восстановления иммунитета, вызванное развитием полноценного воспалительного ответа на ранее бессимптомно протекавшие оппортунистические инфекции (ввиду восстановление иммунной системы). Это может вызвать усугубление симптомов и даже серьезные клинические состояния и осложнения. Такое проявление возникает в течении первых нескольких недель или месяцев после начала ВААРТ.
Типичные примеры инфекций: цитомегаловирусный ретинит, пневмоцистная пневмония, обострение туберкулёза, вирусных гепатитов В и С. Также могут обостряться аутоиммунные заболевания (такие как болезнь Грейвса, полимиозит и синдром Гийена-Барре), однако эти проявления могут возникать и много месяцев позже[6][5][7].
Другие побочные эффекты
Возникновение липодистрофии, ассоциированная с приемом ВААРТ, при приеме долутегравира не изучено[5].
Редко (менее 1%) могут встречаться: суицидальные мысли, гепатит. Менее 2% миозит и почечная недостаточность[5]. От 1% до 10% встречается: утомляемость, бессонница, головокружение, необычные сновидения и фантазии, депрессия, рвота, метеоризм, боли в верхней части живота, боли и дискомфорт в области живота, сыпь, зуд, повышение АЛТ, АСТ, КФК, креатинина, общего билирубина[6][7], глюкозы, липазы, нейтрофилов. Более 10%: головная боль, тошнота, диарея[6][7].
Ввиду возможного головокружения пациенты должны быть предупреждены об осторожности при вождении автомобиля и применении машин[7].
Отмечается повышение частоты отклонения АСТ и АЛТ при коинфекции вирусных гепатитов В и С. Возможно повышение АЛТ и АСТ в рамках развития синдрома восстановления иммунитета[7][6].
Передозировка
Сведения о передозировке препарата ограничены. При приеме повышенных доз не побочные эффекты отличались от обычных. Специфического лечения передозировка препарата не имеет, рекомендована симптоматическая терапия. Ввиду высокой связи препарата с белками крови диализ не показан[6][5][7].
Примечания
- ↑ "U.S. FDA approves GlaxoSmithKline's HIV drug Tivicay". Reuters. 12 August 2013. Дата обращения: 13 февраля 2013.
- ↑ "ViiV Healthcare receives approval for Tivicay™ (dolutegravir) in Canada for the treatment of HIV" (PDF). Дата обращения: 11 ноября 2013.
- ↑ EMA. Tivicay information page
- ↑ В РФ зарегистрирован препарат «Тивикай»® (долутегравир) для лечения ВИЧ-инфекции. Видаль. 15.10.2014
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 Food and Drug Administration, GlaxoSmithKline. Prescribing information and patient information leaflet for Tivicay (англ.) (PDF). Дата обращения: 4 сентября 2016.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 Министерство здравоохранения Российской Федерации. Инструкция по применению лекарственного препарата для медицинского применения «Тивикай» (PDF). Дата обращения: 4 сентября 2016.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 Европейское агентство лекарственных средств. European Summary of Prescribing Information. Tivicay (англ.). Дата обращения: 4 сентября 2016.
Ссылки
- Министерство здравоохранения Российской Федерации. Государственный реестр лекарственных средств. Регистрационное удостоверение Тивикай. Дата обращения: 4 сентября 2016.
- Министерство здравоохранения Российской Федерации. Инструкция по применению лекарственного препарата для медицинского применения «Тивикай» (PDF). Дата обращения: 4 сентября 2016.
- ViiV Healthcare. Tivicay (англ.). Дата обращения: 4 сентября 2016.
- Food and Drug Administration, GlaxoSmithKline. Prescribing information and patient information leaflet for Tivicay (англ.) (PDF). Дата обращения: 4 сентября 2016.
- Европейское агентство лекарственных средств. European Summary of Prescribing Information. Tivicay (англ.). Дата обращения: 4 сентября 2016.