Муравьиная кислота: различия между версиями
| [непроверенная версия] | [непроверенная версия] |
Нет описания правки |
Добавил ссылки |
||
| Строка 94: | Строка 94: | ||
{| border="1" cellspacing="0" cellpadding="1" |
{| border="1" cellspacing="0" cellpadding="1" |
||
|+ [[Плотность]] водных растворов муравьиной кислоты при 20 °C |
|+ [[Плотность]] [[Раствор|водных растворов]] муравьиной кислоты при 20 °C |
||
|'''ω(H<sub>2</sub>CO<sub>2</sub>)'''||1||2||4||6||8||10||12||14||16||18||22||26||30 |
|'''ω(H<sub>2</sub>CO<sub>2</sub>)'''||1||2||4||6||8||10||12||14||16||18||22||26||30 |
||
|- |
|- |
||
| Строка 156: | Строка 156: | ||
== Получение == |
== Получение == |
||
# Побочный продукт в производстве [[уксусная кислота|уксусной кислоты]] жидкофазным окислением [[Бутан (вещество)|бутана]]. |
# Побочный продукт в производстве [[уксусная кислота|уксусной кислоты]] жидкофазным [[Окисление|окислением]] [[Бутан (вещество)|бутана]]. |
||
# Окисление [[метанол]]а:<br />[[Файл:Reaction of production of formic with methanol oxidation.png|Получение муравьиной кислоты окислением метанола]] |
# Окисление [[метанол]]а:<br />[[Файл:Reaction of production of formic with methanol oxidation.png|Получение муравьиной кислоты окислением метанола]] |
||
# Реакцией [[монооксид углерода|монооксида углерода]] с [[гидроксид натрия|гидроксидом натрия]]:<br /> NaOH + CO → HCOONa → (+[[серная кислота|H<sub>2</sub>SO<sub>4</sub>]], −Na<sub>2</sub>SO<sub>4</sub>) HCOOH<br /> Это основной промышленный метод, который осуществляют в две стадии: на первой стадии монооксид углерода под давлением 0,6—0,8 МПа пропускают через нагретый до 120—130 °C гидроксид натрия; на второй стадии проводят обработку формиата натрия [[серная кислота|серной кислотой]] и вакуумную перегонку продукта. |
# Реакцией [[монооксид углерода|монооксида углерода]] с [[гидроксид натрия|гидроксидом натрия]]:<br /> NaOH + CO → HCOONa → (+[[серная кислота|H<sub>2</sub>SO<sub>4</sub>]], −Na<sub>2</sub>SO<sub>4</sub>) HCOOH<br /> Это основной промышленный метод, который осуществляют в две стадии: на первой стадии монооксид углерода под давлением 0,6—0,8 МПа пропускают через нагретый до 120—130 °C гидроксид натрия; на второй стадии проводят обработку формиата натрия [[серная кислота|серной кислотой]] и вакуумную перегонку продукта. |
||
# Разложением глицериновых эфиров [[Щавелевая кислота|щавелевой кислоты]]. Для этого нагревают безводный глицерин со щавелевой кислотой, при этом отгоняется вода и образуются щавелевые эфиры. При дальнейшем нагревании эфиры разлагаются, выделяя углекислый газ, при этом образуются муравьиные эфиры, которые после разложения водой дают муравьиную кислоту и глицерин. |
# Разложением глицериновых эфиров [[Щавелевая кислота|щавелевой кислоты]]. Для этого нагревают безводный глицерин со щавелевой кислотой, при этом отгоняется вода и образуются щавелевые эфиры. При дальнейшем нагревании эфиры разлагаются, выделяя [[Диоксид углерода|углекислый газ]], при этом образуются муравьиные эфиры, которые после разложения водой дают муравьиную кислоту и [[глицерин]]. |
||
== Безопасность == |
== Безопасность == |
||
| Строка 174: | Строка 174: | ||
Муравьиная кислота, кроме кислотных свойств, проявляет также некоторые свойства [[альдегиды|альдегидов]], в частности, восстановительные. При этом она окисляется до углекислого газа. Например: |
Муравьиная кислота, кроме кислотных свойств, проявляет также некоторые свойства [[альдегиды|альдегидов]], в частности, восстановительные. При этом она окисляется до углекислого газа. Например: |
||
: 2KMnO<sub>4</sub> + 5HCOOH + 3H<sub>2</sub>SO<sub>4</sub> → K<sub>2</sub>SO<sub>4</sub> + 2MnSO<sub>4</sub> + 5CO<sub>2</sub>↑ + 8H<sub>2</sub>O |
: [[Перманганат калия|2KMnO<sub>4</sub>]] + 5HCOOH + 3H<sub>2</sub>SO<sub>4</sub> → K<sub>2</sub>SO<sub>4</sub> + 2MnSO<sub>4</sub> + 5CO<sub>2</sub>↑ + 8H<sub>2</sub>O |
||
: |
: |
||
При нагревании с сильными водоотнимающими средствами (H<sub>2</sub>SO<sub>4 (конц.)</sub> или P<sub>4</sub>O<sub>10</sub>) разлагается на [[Вода|воду]] и [[моноксид углерода]]<ref>[http://school-collection.edu.ru/catalog/res/665a25f3-5872-5a4a-073f-e824d8b2c563 Разложение муравьиной кислоты] — видеоопыт в Единой коллекции цифровых образовательных ресурсов</ref>: |
При нагревании с сильными водоотнимающими средствами (H<sub>2</sub>SO<sub>4 (конц.)</sub> или P<sub>4</sub>O<sub>10</sub>) разлагается на [[Вода|воду]] и [[моноксид углерода]]<ref>[http://school-collection.edu.ru/catalog/res/665a25f3-5872-5a4a-073f-e824d8b2c563 Разложение муравьиной кислоты] — видеоопыт в Единой коллекции цифровых образовательных ресурсов</ref>: |
||
| Строка 187: | Строка 187: | ||
== Нахождение в природе == |
== Нахождение в природе == |
||
В природе муравьиная кислота обнаружена в хвое, [[крапива|крапиве]], фруктах, едких выделениях медуз, пчёл и муравьёв. Муравьиная кислота впервые была выделена в [[1670 год]]у английским натуралистом [[Рэй, Джон (натуралист)|Джоном Рэйем]] из [[Formica rufa|рыжих лесных муравьёв]], чем и объясняется её название<ref name="Wray1670">{{cite journal | doi = 10.1098/rstl.1670.0052 | title = Extract of a Letter, Written by Mr. John Wray to the Publisher January 13. 1670. Concerning Some Un-Common Observations and Experiments Made with an Acid Juyce to be Found in Ants | year = 1670 | last = Wray | first = J. | journal = Philosophical Transactions of the Royal Society of London | volume = 5 | issue = 57–68 | pages = 2063 }}</ref><ref name="Johnson1803">{{cite book | url = http://books.google.de/books?id=i1eS9LAe3PsC&pg=PA51 | title = History of the process and present state of animal chemistry | author1 = Johnson | first1 = W. B. | year = 1803}}</ref><ref>{{cite book|author=Charles Earle Raven|publisher=Cambridge University Press|year=1986|isbn=0521310830|title=John Ray, naturalist : his life and works}}</ref><ref name="ХЭ">{{книга|автор=Вергунова Н.Г.|часть=Муравьиная кислота|заглавие=Химическая энциклопедия: В 5 т.|ответственный=Редкол.: [[Кнунянц, Иван Людвигович|И. Л. Кнунянц]] и др.|место=М.|издательство=Советская энциклопедия |год=1992|том=3 |страницы=148—149|страниц=639 |isbn=5-85270-039-8}}</ref>. |
В природе муравьиная кислота обнаружена в [[Хвоя|хвое]], [[крапива|крапиве]], [[Фрукт|фруктах]], едких выделениях медуз, пчёл и муравьёв. Муравьиная кислота впервые была выделена в [[1670 год]]у английским натуралистом [[Рэй, Джон (натуралист)|Джоном Рэйем]] из [[Formica rufa|рыжих лесных муравьёв]], чем и объясняется её название<ref name="Wray1670">{{cite journal | doi = 10.1098/rstl.1670.0052 | title = Extract of a Letter, Written by Mr. John Wray to the Publisher January 13. 1670. Concerning Some Un-Common Observations and Experiments Made with an Acid Juyce to be Found in Ants | year = 1670 | last = Wray | first = J. | journal = Philosophical Transactions of the Royal Society of London | volume = 5 | issue = 57–68 | pages = 2063 }}</ref><ref name="Johnson1803">{{cite book | url = http://books.google.de/books?id=i1eS9LAe3PsC&pg=PA51 | title = History of the process and present state of animal chemistry | author1 = Johnson | first1 = W. B. | year = 1803}}</ref><ref>{{cite book|author=Charles Earle Raven|publisher=Cambridge University Press|year=1986|isbn=0521310830|title=John Ray, naturalist : his life and works}}</ref><ref name="ХЭ">{{книга|автор=Вергунова Н.Г.|часть=Муравьиная кислота|заглавие=Химическая энциклопедия: В 5 т.|ответственный=Редкол.: [[Кнунянц, Иван Людвигович|И. Л. Кнунянц]] и др.|место=М.|издательство=Советская энциклопедия |год=1992|том=3 |страницы=148—149|страниц=639 |isbn=5-85270-039-8}}</ref>. |
||
В больших количествах муравьиная кислота образуется в качестве побочного продукта при жидкофазном окислении [[бутан]]а и лёгкой [[бензин]]овой фракции в производстве [[Уксусная кислота|уксусной кислоты]]. Муравьиную кислоту получают также гидролизом [[формамид]]а (~35 % от общего мирового производства); процесс состоит из нескольких стадий: карбонилирование [[метанол]]а, взаимодействие [[метилформиат]]а с безводным [[Аммиак|NH<sub>3</sub>]] и последующий [[гидролиз]] образовавшегося формамида 75%-ной [[Серная кислота|H<sub>2</sub>SO<sub>4</sub>]]. Иногда используют прямой гидролиз метилформиата (реакцию проводят в избытке воды или в присутствии третичного [[Амины|амина]]), [[Гидратация|гидратацию]] [[Монооксид углерода|СО]] в присутствии щёлочи (кислоту выделяют из соли действием H<sub>2</sub>SO<sub>4</sub>), дегидрогенизацию СН<sub>3</sub>ОН в паровой фазе в присутствии [[катализатор]]ов, содержащих Cu, а также Zr, Zn, Cr, Mn, Mg и др. (метод не имеет промышленного значения). |
В больших количествах муравьиная кислота образуется в качестве побочного продукта при жидкофазном окислении [[бутан]]а и лёгкой [[бензин]]овой фракции в производстве [[Уксусная кислота|уксусной кислоты]]. Муравьиную кислоту получают также гидролизом [[формамид]]а (~35 % от общего мирового производства); процесс состоит из нескольких стадий: карбонилирование [[метанол]]а, взаимодействие [[метилформиат]]а с безводным [[Аммиак|NH<sub>3</sub>]] и последующий [[гидролиз]] образовавшегося формамида 75%-ной [[Серная кислота|H<sub>2</sub>SO<sub>4</sub>]]. Иногда используют прямой гидролиз метилформиата (реакцию проводят в избытке воды или в присутствии третичного [[Амины|амина]]), [[Гидратация|гидратацию]] [[Монооксид углерода|СО]] в присутствии щёлочи (кислоту выделяют из соли действием H<sub>2</sub>SO<sub>4</sub>), дегидрогенизацию СН<sub>3</sub>ОН в паровой фазе в присутствии [[катализатор]]ов, содержащих Cu, а также Zr, Zn, Cr, Mn, Mg и др. (метод не имеет промышленного значения). |
||
| Строка 206: | Строка 206: | ||
== См. также == |
== См. также == |
||
* [[Муравьиный спирт]] |
* [[Муравьиный спирт]] |
||
* [[Формиаты]] |
|||
== Примечания == |
== Примечания == |
||
Версия от 15:12, 23 октября 2016
| Муравьиная кислота | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Метановая кислота |
| Традиционные названия | Муравьиная кислота |
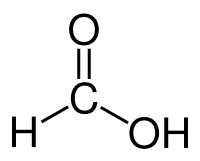
| Хим. формула | HCOOH |
| Рац. формула | CH2O2 |
| Физические свойства | |
| Состояние | жидкость |
| Молярная масса | 46,025380 г/моль |
| Плотность | 1,2196 г/см³ |
| Динамическая вязкость | 0,16 Па·с |
| Энергия ионизации | 11,05 ± 0,01 эВ[1] |
| Термические свойства | |
| Температура | |
| • плавления | 8,25 °C |
| • кипения | 100,7 °C |
| • вспышки | 60 °C |
| • самовоспламенения | 520 °C |
| Пределы взрываемости | 18 ± 1 об.%[1] |
| Тройная точка | 281,40 K (8,25 °C), 2,2 кПа |
| Критическая точка | 588 K (315 °C), 5,81 МПа |
| Мол. теплоёмк. | 98,74 Дж/(моль·К) |
| Энтальпия | |
| • образования | −409,19 кДж/моль |
| Давление пара | 120 мм. рт. ст. (16 кПа) при 50 °C |
| Химические свойства | |
| Константа диссоциации кислоты | 3,75 |
| Оптические свойства | |
| Показатель преломления | 1,3714 |
| Структура | |
| Дипольный момент | 1,41 (газ) Д |
| Классификация | |
| Рег. номер CAS | 64-18-6 |
| PubChem | 284 и 18971002 |
| Рег. номер EINECS | 200-579-1 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E236 |
| RTECS | LQ4900000 |
| ChEBI | 30751 |
| ChemSpider | 278 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Муравьиная кислота (систематическое наименование: метановая кислота) — первый представитель в ряду насыщенных одноосновных карбоновых кислот. Зарегистрирована в качестве пищевой добавки под обозначением E236. Своё название муравьиная кислота получила потому, что впервые она была выделена в 1670 году английским натуралистом Джоном Рэйем у рыжих лесных муравьёв. В природе также обнаружена у пчёл, в крапиве, хвое[2][3].
Физические и термодинамические свойства
При нормальных условиях муравьиная кислота представляет собой бесцветную жидкость. Растворима в ацетоне, бензоле, глицерине, толуоле. Смешивается с водой, диэтиловым эфиром, этанолом.
| Давление паров | 120 мм. рт. ст. (при 50 °C) |
| Стандартная энтальпия образования ΔH | −409,19 кДж/моль (ж) (при 298 К) |
| Стандартная энергия Гиббса образования G | −346 кДж/моль (ж) (при 298 К) |
| Стандартная энтропия образования S | 128,95 Дж/моль·K (ж) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 98,74 Дж/моль·K (ж) (при 298 К) |
| Энтальпия плавления ΔHпл | 12,72 кДж/моль |
| Энтальпия кипения ΔHкип | 22,24 кДж/моль |
| Теплота сгорания -ΔH°298 (конечные вещества CO2, H2O) | 254,58 кДж/моль |
| ω(H2CO2) | 1 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 22 | 26 | 30 |
| ρ, г/см³ | 1,0020 | 1,0045 | 1,0094 | 1,0142 | 1,0197 | 1,0247 | 1,0297 | 1,0346 | 1,0394 | 1,0442 | 1,0538 | 1,0634 | 1,0730 |
| Температура, °C | 15 | 20 | 30 |
| σ, Н/м | 3,813⋅10−2 | 3,758⋅10−2 | 3,648⋅10−2 |
| Давление, кПа (мм. рт. ст.) | 0,133(1) | 0,667(5) | 1,333(10) | 2,666(20) | 5,333(40) |
| Tкип, °C | −20,0 (кр.) | −5,0 (кр.) | +2,1 (кр.) | 10,3 | 24,0 |
| Давление, кПа (мм. рт. ст.) | 7,999(60) | 13,333(100) | 26,66(200) | 53,33(400) | 101,32(760) |
| Tкип, °C | 32,4 | 43,8 | 61,4 | 80,3 | 100,7 |
| Число молей H2O на 1 моль HCOOH | m, моль HCOOH на 1 кг H2O | -ΔHm, кДж/моль |
|---|---|---|
| 1 | 55,51 | 0,83 |
| 2 | 27,75 | 0,87 |
| 3 | 18,50 | 0,79 |
| 4 | 13,88 | 0,71 |
| 5 | 11,10 | 0,67 |
| 6 | 9,25 | 0,62 |
| 8 | 6,94 | 0,58 |
| 10 | 5,55 | 0,56 |
| 15 | 3,70 | 0,55 |
| 20 | 2,78 | 0,55 |
| 30 | 1,85 | 0,56 |
| 40 | 1,39 | 0,57 |
| 50 | 1,11 | 0,60 |
| 75 | 0,740 | 0,65 |
| 100 | 0,555 | 0,66 |
| ∞ | 0,0000 | 0,71 |
Получение
- Побочный продукт в производстве уксусной кислоты жидкофазным окислением бутана.
- Окисление метанола:

- Реакцией монооксида углерода с гидроксидом натрия:
NaOH + CO → HCOONa → (+H2SO4, −Na2SO4) HCOOH
Это основной промышленный метод, который осуществляют в две стадии: на первой стадии монооксид углерода под давлением 0,6—0,8 МПа пропускают через нагретый до 120—130 °C гидроксид натрия; на второй стадии проводят обработку формиата натрия серной кислотой и вакуумную перегонку продукта. - Разложением глицериновых эфиров щавелевой кислоты. Для этого нагревают безводный глицерин со щавелевой кислотой, при этом отгоняется вода и образуются щавелевые эфиры. При дальнейшем нагревании эфиры разлагаются, выделяя углекислый газ, при этом образуются муравьиные эфиры, которые после разложения водой дают муравьиную кислоту и глицерин.
Безопасность

Опасность муравьиной кислоты зависит от концентрации. Согласно классификации Европейского союза, концентрация до 10 % обладает раздражающим эффектом, больше 10 % — разъедающим.
При контакте с кожей 100%-ная жидкая муравьиная кислота вызывает сильные химические ожоги. Попадание даже небольшого её количества на кожу причиняет сильную боль, поражённый участок сначала белеет, как бы покрываясь инеем, потом становится похожим на воск, вокруг него появляется красная кайма. Кислота легко проникает через жировой слой кожи, поэтому промывание поражённого участка раствором соды необходимо произвести немедленно. Контакт с концентрированными парами муравьиной кислоты может привести к повреждению глаз и дыхательных путей. Случайное попадание внутрь даже разбавленных растворов вызывает явления тяжелого некротического гастроэнтерита.
Муравьиная кислота быстро перерабатывается и выводится организмом. Тем не менее, муравьиная кислота и формальдегид, образующиеся при отравлении метанолом, вызывают повреждение зрительного нерва и ведут к слепоте.
Химические свойства
Константа диссоциации: 1,772⋅10−4.
Муравьиная кислота, кроме кислотных свойств, проявляет также некоторые свойства альдегидов, в частности, восстановительные. При этом она окисляется до углекислого газа. Например:
- 2KMnO4 + 5HCOOH + 3H2SO4 → K2SO4 + 2MnSO4 + 5CO2↑ + 8H2O
При нагревании с сильными водоотнимающими средствами (H2SO4 (конц.) или P4O10) разлагается на воду и моноксид углерода[4]:
- HCOOH →(t) CO↑ + H2O
- Муравьиная кислота реагирует с аммиачным раствором оксида серебра
- HCOOH + 2[Ag(NH3)2]OH --> 2Ag + (NH4)2CO3 + 2NH3 + H2O
- Взаимодействие муравьиной кислоты с гидроксидом натрия.
- HCOOH+ NaOH =HCOONa+H2O
Нахождение в природе
В природе муравьиная кислота обнаружена в хвое, крапиве, фруктах, едких выделениях медуз, пчёл и муравьёв. Муравьиная кислота впервые была выделена в 1670 году английским натуралистом Джоном Рэйем из рыжих лесных муравьёв, чем и объясняется её название[2][5][6][3].
В больших количествах муравьиная кислота образуется в качестве побочного продукта при жидкофазном окислении бутана и лёгкой бензиновой фракции в производстве уксусной кислоты. Муравьиную кислоту получают также гидролизом формамида (~35 % от общего мирового производства); процесс состоит из нескольких стадий: карбонилирование метанола, взаимодействие метилформиата с безводным NH3 и последующий гидролиз образовавшегося формамида 75%-ной H2SO4. Иногда используют прямой гидролиз метилформиата (реакцию проводят в избытке воды или в присутствии третичного амина), гидратацию СО в присутствии щёлочи (кислоту выделяют из соли действием H2SO4), дегидрогенизацию СН3ОН в паровой фазе в присутствии катализаторов, содержащих Cu, а также Zr, Zn, Cr, Mn, Mg и др. (метод не имеет промышленного значения).
Применение
В основном, муравьиную кислоту используют как консервирующий и антибактериальный агент при заготовке корма. Муравьиная кислота замедляет процессы гниения и распада, поэтому сено и силос, обработанные муравьиной кислотой, дольше сохраняются. Муравьиная кислота также используется в протравном крашении шерсти, для борьбы с паразитами в пчеловодстве, как растворитель в некоторых химических реакциях.
В лабораториях используют разложение жидкой муравьиной кислоты под действием горячей концентрированной серной кислоты, либо пропуская муравьиную кислоту над оксидом фосфора P2O5, для получения монооксида углерода. Схема реакции:
- HCOOH →(t, H2SO4) H2O + CO↑
В медицине используется для приготовления растворов пермуравьиной кислоты («первомур», или рецептура «С-4»(смесь перекиси водорода и муравьиной кислоты)). Первомур используют в хирургии в качестве предоперационного антисептического средства, в фармацевтической промышленности для дезинфекции оборудования[7].
Производные муравьиной кислоты
Соли и эфиры муравьиной кислоты называют формиатами.
См. также
Примечания
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0296.html
- ↑ 1 2 Wray, J. (1670). "Extract of a Letter, Written by Mr. John Wray to the Publisher January 13. 1670. Concerning Some Un-Common Observations and Experiments Made with an Acid Juyce to be Found in Ants". Philosophical Transactions of the Royal Society of London. 5 (57—68): 2063. doi:10.1098/rstl.1670.0052.
- ↑ 1 2 Вергунова Н.Г. Муравьиная кислота // Химическая энциклопедия: В 5 т. / Редкол.: И. Л. Кнунянц и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — С. 148—149. — 639 с. — ISBN 5-85270-039-8.
- ↑ Разложение муравьиной кислоты — видеоопыт в Единой коллекции цифровых образовательных ресурсов
- ↑ Johnson, W. B. History of the process and present state of animal chemistry. — 1803.
- ↑ Charles Earle Raven. John Ray, naturalist : his life and works. — Cambridge University Press, 1986. — ISBN 0521310830.
- ↑ Красильников А. П. Справочник по антисептике. — Минск, 1995.

