Оксид цинка: различия между версиями
| [непроверенная версия] | [отпатрулированная версия] |
Спасено источников — 0, отмечено мёртвыми — 1. Сообщить об ошибке. См. FAQ. #IABot (v2.0beta9) |
заменил математический формулу ( синтаксис <math>) на химическую формулу (синтаксис <chem>) . Выглядит красивее и четче, а запись компактней. |
||
| Строка 129: | Строка 129: | ||
Оксид цинка [[амфотерность|амфотерен]] — реагирует с [[кислота]]ми с образованием солей, при взаимодействии с растворами щелочей образует комплексные три- тетра- и гексагидроксоцинкаты (Na<sub>2</sub>[Zn(OH)<sub>4</sub>], Ba<sub>2</sub>[Zn(OH)<sub>6</sub>]): |
Оксид цинка [[амфотерность|амфотерен]] — реагирует с [[кислота]]ми с образованием солей, при взаимодействии с растворами щелочей образует комплексные три- тетра- и гексагидроксоцинкаты (Na<sub>2</sub>[Zn(OH)<sub>4</sub>], Ba<sub>2</sub>[Zn(OH)<sub>6</sub>]): |
||
: |
:<chem>[Zn(OH)3]- + OH- -> [Zn(OH)4]^2-</chem> |
||
Оксид цинка растворяется в водном растворе [[аммиак]]а, образуя комплексный аммиакат: |
Оксид цинка растворяется в водном растворе [[аммиак]]а, образуя комплексный аммиакат: |
||
: |
:<chem>ZnO + 4NH3 + H2O -> [Zn(NH3)4](OH)2</chem> |
||
При сплавлении с щелочами и оксидами металлов оксид цинка образует [[цинкаты]]: |
При сплавлении с щелочами и оксидами металлов оксид цинка образует [[цинкаты]]: |
||
: |
:<chem>ZnO + 2NaOH -> Na2ZnO2 + H2O</chem> |
||
: |
:<chem>ZnO + CoO -> CoZnO2</chem> |
||
При сплавлении с оксидами бора и кремния оксид цинка образует стекловидные бораты и [[силикаты]]: |
При сплавлении с оксидами бора и кремния оксид цинка образует стекловидные бораты и [[силикаты]]: |
||
: |
:<chem>ZnO + B2O3 -> Zn(BO2)2</chem> |
||
:<chem>ZnO + SiO2 ->ZnSiO3</chem> |
|||
: ZnO + SiO<sub>2</sub> <math>\to</math> ZnSiO<sub>3</sub> |
|||
== Получение == |
== Получение == |
||
Версия от 20:54, 12 ноября 2018
| Оксид цинка | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Цинка оксид | ||
| Хим. формула | ZnO | ||
| Физические свойства | |||
| Состояние | твёрдое | ||
| Молярная масса | 81,408 г/моль | ||
| Плотность | 5,61 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 3587 ± 1 ℉[1] | ||
| • сублимации | 1800 °C | ||
| Мол. теплоёмк. | 40,28 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | -350,8 кДж/моль | ||
| Давление пара | 0 ± 1 мм рт.ст.[1] | ||
| Оптические свойства | |||
| Показатель преломления | 2,015 и 2,068 | ||
| Структура | |||
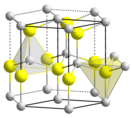
| Кристаллическая структура | гексагональная сингония, a = 0,32495 нм, c = 0,52069 нм, z = 2 | ||
| Классификация | |||
| Рег. номер CAS | 1314-13-2 | ||
| PubChem | 14806 | ||
| Рег. номер EINECS | 215-222-5 | ||
| SMILES | |||
| InChI | |||
| RTECS | ZH4810000 | ||
| ChEBI | ZH4810000 | ||
| ChemSpider | 14122 | ||
| Безопасность | |||
| Предельная концентрация |
в воздухе рабочей зоны 0.5 мг/м3 в атмосферном воздухе 0.05 мг/м3 |
||
| Токсичность | Токсичен, при вдыхании пыли вызывает литейную лихорадку | ||
| Фразы риска (R) | R50/53 | ||
| Фразы безопасности (S) | S60, S61 | ||
| Краткие характер. опасности (H) |
H410 |
||
| Меры предостор. (P) |
P273 |
||
| Сигнальное слово | осторожно | ||
| Пиктограммы СГС |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Окси́д ци́нка (окись цинка) ZnO — бесцветный кристаллический порошок, нерастворимый в воде, желтеющий при нагревании и сублимирующийся при 1800 °C.
Свойства
- Теплопроводность: 54 Вт/(м*К)[2]
Оксид цинка является прямозонным полупроводником с шириной запрещённой зоны 3,36 эВ. Естественное легирование кислородом делает его полупроводником n-типа.
При нагревании вещество меняет цвет: белый при комнатной температуре, оксид цинка становится жёлтым. Объясняется это уменьшением ширины запрещённой зоны и сдвигом края в спектре поглощения из УФ-области в синюю.
Оксид цинка амфотерен — реагирует с кислотами с образованием солей, при взаимодействии с растворами щелочей образует комплексные три- тетра- и гексагидроксоцинкаты (Na2[Zn(OH)4], Ba2[Zn(OH)6]):
Оксид цинка растворяется в водном растворе аммиака, образуя комплексный аммиакат:
При сплавлении с щелочами и оксидами металлов оксид цинка образует цинкаты:
При сплавлении с оксидами бора и кремния оксид цинка образует стекловидные бораты и силикаты:
Получение
- природный минерал цинкит
- сжиганием паров цинка в кислороде («французский процесс»)
- термическим разложением соединений:
- ацетата Zn(CH3COO)2
- гидроксида Zn(OH)2
- карбоната ZnCO3
- нитрата Zn(NO3)2
- окислительным обжигом сульфида ZnS
- гидротермальный синтез[3]
- извлечением из пылей и шламов металлургических комбинатов, особенно тех, что работают на металлоломе в качестве сырья (он содержит значительную долю оцинкованного железа).
- извлечением из тройной системы фазового равновесия «нитрат цинка-нитрат амина-вода» (с нитратом пиридина и хинолина размерность частиц порядка 5-10 нм до 75 %)
Применение
Свойства оксида цинка обусловливают его широкое применение в химической, фармацевтической промышленности. Оксид цинка нашёл широкое применение в создании абразивных зубных паст и цементов в терапевтической стоматологии, в кремах для загара и косметических процедурах, в производстве электрокабеля, искусственной кожи и резинотехнических изделий. Кроме того, применение распространено в шинной, лакокрасочной, нефтеперерабатывающей промышленностях. Оксид цинка применяют при производстве стекла и керамики.
В химической промышленности
- активатор вулканизации некоторых каучуков
- вулканизирующий агент хлоропреновых каучуков
- катализатор синтеза метанола
- белый пигмент при производстве красок и эмалей (в настоящее время (2007) вытеснен нетоксичным диоксидом титана TiO2)
- наполнитель и пигмент в производстве:
- добавка к кормам для животных
- в производстве стекла и красок на основе жидкого стекла
- как один из компонентов преобразователя ржавчины
Известно также, что оксид цинка обладает фотокаталитической активностью, что на практике используется для создания самоочищающихся поверхностей, бактерицидных покрытий для стен и потолков в больницах и пр. Для фотокаталитической очистки воды в промышленных масштабах оксид цинка в настоящее время не используется.
В электронике
Оксид цинка применяется для производства варисторов, которые могут использоваться для изготовления современных ограничителей перенапряжений (ОПН) взамен устаревших вентильных разрядников. Кроме того, порошок оксида цинка — перспективный материал в качестве рабочей среды для порошковых лазеров. На основе оксида цинка создан светодиод голубого цвета. Тонкие плёнки и иные наноструктуры на основе оксида цинка могут применяться как чувствительные газовые и биологические сенсоры. Также оксид цинка входит в состав теплопроводных паст.
В медицине

В медицине используется в качестве компонента лекарственных средств, применяемых в дерматологии. Обладает противовоспалительным, подсушивающим, адсорбирующим, вяжущим и антисептическим действием. Применяют наружно в виде присыпки, мази, пасты, линимента. Является одним из компонентов ряда комплексных дерматологических и косметических препаратов, таких как «Цинковая мазь», «Паста Лассара» и пр.
Фармакологическое действие: образует альбуминаты и денатурирует белки. При нанесении на поражённую поверхность уменьшает явления экссудации, воспаления и раздражения тканей, образует защитный барьер от действия раздражающих факторов.
Может применяться при дерматите, в том числе пелёночном, опрелостях, потнице, поверхностных ранах и ожогах (солнечные ожоги, порезы, царапины), язвенных поражениях кожи (трофических язвах), пролежнях, экземе в стадии обострения, простом герпесе, стрептодермии.
Влияние на человека
Слабо токсичен, ПДК в воздухе рабочих помещений — 0,5 мг/м³ (согласно ГОСТ 10262-73). Пыль может образовываться при обжиге изделий из латуни.
Примечания
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0675.html
- ↑ Термопрохладки
- ↑ S. Baruah and J. Dutta «Review: Hydrothermal growth of ZnO nanostructures» Sci. Technol. Adv. Mater. 10 (2009) 013001 скачать бесплатно (недоступная ссылка)
Литература
- В.И.Перельман. Краткий справочник химика. — М.—Л.: Химия, 1964.
- Бовина Л. А. и др. Физика соединений AIIBVI / под ред. А. Н. Георгобиани, М. К. Шейнкмана. — М.: Наука, Гл. ред. физ.-мат. лит., 1986. — 319, [1] с.: рис., табл. — 2600 экз.
- статья «Цинка окись» в Большой советской энциклопедии
Дополнительная литература
- Özgür Ü., Alivov Ya. I., Liu C., Teke A., Reshchikov M. A., Doğan S., Avrutin V., Cho S.-J., Morkoç H. A comprehensive review of ZnO materials and devices // Journal of Applied Physics. — 2005. — Vol. 98. — P. 041301. — ISSN 00218979. — doi:10.1063/1.1992666.


![{\displaystyle {\ce {[Zn(OH)3]- + OH- -> [Zn(OH)4]^2-}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/6d142e8afdcf69972b430bd5938dab8a3928654c)
2}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/90007118646e4602bc2966387b9c587ea6a97cfa)



