Ацетали: различия между версиями
| [отпатрулированная версия] | [отпатрулированная версия] |
Нет описания правки |
|||
| Строка 13: | Строка 13: | ||
:: <math>\mathsf{R\text{-}CHO + H^+ \rightleftarrows R\text{-}CH^+\text{-}OH \rightleftarrows R\text{-}CH\text{=}O^+H}</math> |
:: <math>\mathsf{R\text{-}CHO + H^+ \rightleftarrows R\text{-}CH^+\text{-}OH \rightleftarrows R\text{-}CH\text{=}O^+H}</math> |
||
:: <math>\mathsf{R\text{-}CH^+\text{-}OH + |
:: <math>\mathsf{R\text{-}CH^+\text{-}OH + R'OH \rightleftarrows R\text{-}CH(OR')OH + H^+}</math> |
||
:: <math>\mathsf{R\text{-}CH(OR')OH + R'OH \rightarrow R\text{-}CH(OR')_2 + H_2O}</math> |
|||
| ⚫ | |||
:: <math>\mathsf{R\text{-}CH(OR')_2 + R''XS \rightarrow R\text{-}CH(OR_1)OR'' + H_2X, \ \ \ X=O, S}</math> |
|||
: R—CH(OR)OH + H<sup>+</sup> + H<sup>+</sup> <math>\rightleftharpoons</math> R—СH<sup>+</sup>—OR + H<sub>2</sub>O |
|||
: R—СH<sup>+</sup>—OR + ROH <math>\rightleftharpoons</math> R—CH(OR)<sub>2</sub> + H<sup>+</sup> |
|||
| ⚫ | |||
: R—CH(OR)<sub>2</sub> + H<sup>+</sup> <math>\rightleftharpoons</math> R—СH<sup>+</sup>—OR <math>\longleftrightarrow</math> R—СH=O<sup>+</sup>R |
|||
: R—СH<sup>+</sup>—OR + R<sup>1</sup>XH <math>\rightleftharpoons</math> R—CH(OR)XR<sup>1</sup> |
|||
: X = O, S, |
|||
Переацетализация происходит при взаимодействии ацеталей не только со спиртами, но и при реакции с тиолами и ведет в последнем случае к образованию [[Тиоацетали|дитиоацеталей]] R<sub>2</sub>C(SR)<sub>2</sub>. |
Переацетализация происходит при взаимодействии ацеталей не только со спиртами, но и при реакции с тиолами и ведет в последнем случае к образованию [[Тиоацетали|дитиоацеталей]] R<sub>2</sub>C(SR)<sub>2</sub>. |
||
Версия от 07:41, 16 декабря 2018

Ацета́ли — простые эфиры гем-диолов общей формулы R₂C(OR¹)(OR²), где R¹ и R² — углеводородные радикалы: CH3, C2H5 и др. Первоначально к ацеталям относили производные альдегидов RCH(OR¹)(OR²), а аналогичные производные кетонов именовались кеталями R—C(R¹)(OR²)(OR³), однако в настоящее время в номенклатуре IUPAC для обоих классов соединений рекомендуется название «ацетали».[1].
Если один из R¹ или R² представляет собой атом водорода, то такие соединения R₂C(OH)OR′ (R′ ≠ H) называют гемиацеталями (полуацеталями)[2].
Свойства и реакционная способность
Низшие ацетали — жидкости приятного фруктового запаха, растворимые в органических растворителях и нерастворимые в воде.
Ацетали устойчивы в щелочных средах, однако в присутствии кислот легко гидролизуются водой с образованием альдегидов и спиртов, производными которых они являются. Полуацетали, как правило, ещё легче подвержены гидролизу и в растворах находятся в равновесии с исходным альдегидом и спиртом.
Такое поведение ацеталей и гемиацеталей — как и их образование из карбонильных соединений — обусловлено общим механизмом кислотного катализа с образованием резонансно стабилизированного α-атомом кислорода карбокатиона:
Все эти реакции обратимы, и положение равновесия может быть сдвинуто удалением из реакционной смеси какого-либо компонента. Другим следствием обратимости реакций ацеталей в условиях кислотного катализа, идущих с образованием карбокатионов, являются реакции переацетализации:
Переацетализация происходит при взаимодействии ацеталей не только со спиртами, но и при реакции с тиолами и ведет в последнем случае к образованию дитиоацеталей R2C(SR)2.
В реакциях с азотистыми нуклеофилами ацетали выступают как функциональные аналоги исходных карбонильных соединений: так, в реакциях ацеталей с первичными аминами, гидразинами и гидроксиламином образуются имины, гидразоны и оксимы:
- R2C(OR1)2 + R2NH2 R2C=NR2 + 2 R1OH
- R2 = Alk, Ar (имины), NR2 (гидразоны), OH (оксимы)
При взаимодействии вторичных аминов с ацеталями — функциональными аналогами енолизирующихся альдегидов и кетонов образуются енамины:
- R12CHCR2(OR)2 + R3NH R12C=CR2NR3
Синтез
Основным препаративным методом синтеза ацеталей является взаимодействие альдегидов и кетонов со спиртами либо ортоэфирами в условиях кислотного катализа:
В качестве эквивалента диола в таком синтезе ацеталей могут выступать эпоксиды:
Ацетали также могут быть синтезированы присоединением спиртов к виниловым эфирам и их гомологам:
- СН2=СНОR + R1ОН СН3СН(ОR)(OR1)
Замещение галогена в алифатических гем-дагалогенидах и α-галогенэфирах алкоголятами и фенолятами также ведет к ацеталям:
- RCHXHal + RO- RCH(OR)2
- X = OR, Hal,
такой метод синтеза — взимодействие этилидендибромида с этилатом натрия — был использован Вюрцем и Фраполли для доказательства строения диэтилацеталя уксусного альдегида, полученного в 1833 году Деберейнером при окисления этанола над платиновой чернью[3]
Биологическое значение
Образование полуацеталей и ацеталей имеет чрезвычайно важное значение в химии углеводов, являющихся полигидроксиальдегидами (альдозы) и полигидроксикетонами (кетозы).
Такое сочетание гидроксильных и карбонильных функций в одной молекуле ведет к тому, что моносахариды могут существовать и в линейной форме, и, за счет внутримолекулярного образования полуацеталей, в циклической:
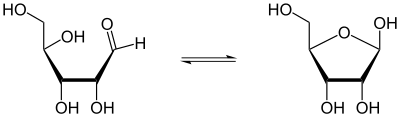
Линейная (оксо-) и циклическая гемиацетальная (фуранозная) формы рибозы
В водных растворах линейные оксоформы и циклические полуацетальные формы моносахаридов, являющиеся динамическими структурными изомерами, находятся равновесии, то есть являются таутомерами. Таутомерия этого типа получила название цикло-оксо таутомерии.
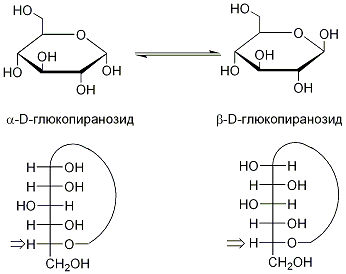
В свою очередь, циклические полуацетальные формы моносахаридов могут существовать в виде двух стереоизомерных аномерных форм, образующихся вследствие образования циклических гемиацеталей при нуклеофильной атаки гидроксила с различных сторон карбонильной группы:
Циклические гемиацетальные формы моноз способны образовывать полные ацетали с различными соединениями: так, образование смешанных ацеталей с другими монозами ведет к образованию сахаридов — обширного класса природных соединений, включающих как низкомолекулярные ди- и олигосахариды, так и высокомолекулярные полисахариды (целлюлоза, хитин и др.):
Примечания
- ↑ acetals // IUPAC Gold Book
- ↑ hemiacetals // IUPAC Gold Book
- ↑ Ацеталь // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.