Благородные газы: различия между версиями
| [непроверенная версия] | [отпатрулированная версия] |
Нет описания правки |
м автоматическая отмена правки участника 31.13.145.151, вредной с вероятностью 0.939 Метка: откат |
||
| Строка 28: | Строка 28: | ||
|} |
|} |
||
'''Благоро́дные га́зы''' (также '''ине́ртные'''<ref>{{Из КНЭ|2|473|Инертные газы}}</ref> или '''ре́дкие га́зы'''<ref>{{Из|ХЭ|http://www.xumuk.ru/encyklopedia/588.html|заглавие=Благородные газы}}</ref>) — группа [[Химический элемент|химических элементов]] со схожими свойствами: при [[Нормальные условия|нормальных условиях]] они представляют собой [[одноатомный газ|одноатомные газы]] без цвета, запаха и вкуса с очень низкой {{нп5|Химическая реактивность|химической реактивностью|en|Reactivity (chemistry)}}. К |
'''Благоро́дные га́зы''' (также '''ине́ртные'''<ref>{{Из КНЭ|2|473|Инертные газы}}</ref> или '''ре́дкие га́зы'''<ref>{{Из|ХЭ|http://www.xumuk.ru/encyklopedia/588.html|заглавие=Благородные газы}}</ref>) — группа [[Химический элемент|химических элементов]] со схожими свойствами: при [[Нормальные условия|нормальных условиях]] они представляют собой [[одноатомный газ|одноатомные газы]] без цвета, запаха и вкуса с очень низкой {{нп5|Химическая реактивность|химической реактивностью|en|Reactivity (chemistry)}}. К благородным газам относятся [[гелий]] (He), [[неон]] (Ne), [[аргон]] (Ar), [[криптон]] (Kr), [[ксенон]] (Xe) и радиоактивный [[радон]] (Rn). Формально к этой группе также причисляют недавно открытый [[оганесон]] (Og), однако его химические свойства почти не исследованы. |
||
В первых 6 периодах [[Периодическая таблица|периодической таблицы химических элементов]] инертные газы относятся к последней, '''18-й группе'''. Согласно старой европейской системе нумерации [[Группа периодической системы|групп периодической таблицы]], группа инертных газов обозначается '''VIIIA''' (главная подгруппа 8-й группы, или подгруппа гелия), согласно старой американской системе — '''VIIIB'''; кроме того, в некоторых источниках, особенно в старых, группа инертных газов обозначается цифрой 0, ввиду характерной для них нулевой валентности. Возможно, что из-за [[Релятивистская квантовая химия|релятивистских эффектов]] элемент 7-го периода [[подгруппа углерода|14-й группы]] [[флеровий]] обладает некоторыми свойствами благородных газов<ref>{{cite web|accessdate=2009-08-08|title=Flerov laboratory of nuclear reactions|publisher=JINR|url=http://www1.jinr.ru/Reports/2008/english/06_flnr_e.pdf}}</ref>. Он может заменить в периодической таблице оганесон<ref>{{cite journal|title=Atomic and Molecular Properties of Elements 112, 114, and 118|author=Nash, Clinton S. |journal=J. Phys. Chem. A |year=2005 |volume=109 |issue=15 |pages=3493–3500|doi=10.1021/jp050736o|pmid=16833687}}</ref>. Благородные газы химически неактивны и способны участвовать в химических реакциях лишь при экстремальных условиях. |
|||
Характеристики благородных газов объяснены современными теориями [[строение атома|структуры атома]]: их [[Электронная оболочка|электронные оболочки]] из [[Валентный электрон|валентных электронов]] являются заполненными, тем самым позволяя участвовать лишь в очень малом количестве химических реакций: известны всего несколько сотен химических [[Соединения благородных газов|соединений этих элементов]]. |
|||
Неон, аргон, криптон и ксенон выделяют из [[воздух]]а [[Воздухоразделительные установки|специальными установками]], используя при этом методы [[Сжижение газов|сжижения газов]] и [[Фракционированная конденсация|фракционированной конденсации]]. Источником гелия являются [[Месторождение природного газа|месторождения природного газа]] с высокой концентрацией гелия, который отделяется с помощью методов [[разделение газов|криогенного разделения газов]]. Радон обычно получают как продукт [[радиоактивный распад|радиоактивного распада]] [[радий|радия]] из растворов соединений этого элемента. <!-- Noble gases have several important applications in industries such as lighting, welding, and space exploration. A [[Heliox|helium-oxygen breathing gas]] is often used by deep-sea divers at depths of seawater over {{convert|55|m|ft|abbr=on}} to keep the diver from experiencing [[Oxygen toxicity|oxygen toxemia]], the lethal effect of high-pressure oxygen, and [[nitrogen narcosis]], the distracting narcotic effect of the nitrogen in air beyond this partial-pressure threshold. After the risks caused by the flammability of [[hydrogen]] became apparent, it was replaced with helium in [[blimp]]s and [[gas balloon|balloons]]. |
|||
--> |
--> |
||
| Строка 56: | Строка 62: | ||
|} |
|} |
||
=== Соединения === |
|||
[[Файл:Xenon-tetrafluoride-3D-vdW.png|thumb|left|Структура [[тетрафторид ксенона|тетрафторида ксенона]] XeF<sub>4</sub>, одного из первых когда-либо обнаруженных соединений благородных газов|alt=Структура XeF<sub>4</sub>, одного из первых когда-либо обнаруженных соединений благородных газов]] |
[[Файл:Xenon-tetrafluoride-3D-vdW.png|thumb|left|Структура [[тетрафторид ксенона|тетрафторида ксенона]] XeF<sub>4</sub>, одного из первых когда-либо обнаруженных соединений благородных газов|alt=Структура XeF<sub>4</sub>, одного из первых когда-либо обнаруженных соединений благородных газов]] |
||
{{main|Соединения благородных газов}} |
|||
Инертные газы отличаются химической неактивностью (отсюда и название). Тем не менее, в 1962 году [[Бартлетт, Нил|Нил Барлетт]] показал, что все они при определённых условиях могут образовывать [[соединения благородных газов|соединения]] (особенно охотно со [[фтор]]ом). Наиболее «инертны» неон и гелий: чтобы заставить их вступить в реакцию, нужно применить много усилий, искусственно ионизируя каждый атом. Ксенон же, наоборот, слишком активен (для инертных газов) и реагирует даже при [[Нормальные условия|нормальных условиях]], демонстрируя чуть ли не все возможные степени окисления (+1, +2, +4, +6, +8). [[Радон]] тоже имеет высокую химическую активность (по сравнению с лёгкими инертными газами), но он радиоактивен и быстро распадается, поэтому подробное изучение его химических свойств осложнено, в отличие от ксенона. |
|||
[[Оганесон]], несмотря на его принадлежность к 18-й группе периодической таблицы, может не являться инертным газом, так как предполагается, что при нормальных условиях в силу [[Релятивистская квантовая химия|релятивистских эффектов]], влияющих на движение электронов вблизи его ядра с высоким зарядом, он будет находиться в твёрдом состоянии<ref>{{cite journal|title=Atomic weights of the elements 2005 (IUPAC Technical Report)|journal=Pure Appl. Chem.|year=2006|volume=78|issue=11|pages=2051–2066| doi=10.1351/pac200678112051| author=Wieser M.E.}}</ref>. |
|||
== Физические свойства == |
== Физические свойства == |
||
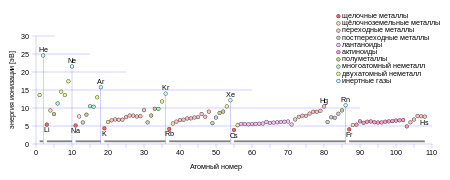
[[Файл:First Ionization Energy.svg|lang=ru|thumb|450px|right|Инертные газы имеют самые большие в своём периоде [[Энергия ионизации|энергии ионизации]]]] |
[[Файл:First Ionization Energy.svg|lang=ru|thumb|450px|right|Инертные газы имеют самые большие в своём периоде [[Энергия ионизации|энергии ионизации]]]] |
||
Инертные газы бесцветны, прозрачны и не имеют запаха и вкуса. В небольшом количестве они присутствуют в [[воздух]]е и некоторых [[горная порода|горных породах]], а также в атмосферах некоторых [[Планеты-гиганты|планет-гигантов]] и планет земной группы. Гелий является вторым (после водорода) по распространённости элементом во Вселенной, однако для Земли он является редким газом, который улетучился в космос во время образования планеты. Почти весь добываемый гелий является радиогенным продуктом происходящего в течение миллиардов лет в недрах Земли [[альфа-распад]]а урана, тория и их дочерних элементов; лишь малая часть земного гелия сохранилась от эпохи образования Солнечной системы. Аналогично, по большей части радиогенным является и аргон, возникший в результате постепенного радиоактивного распада [[Калий-40|калия-40]]. |
|||
| ⚫ | |||
| ⚫ | |||
При нормальном давлении температуры [[Температура плавления|плавления]] и [[Температура кипения|кипения]] у любого благородного газа отличаются менее чем на 10 °C; таким образом, они остаются жидкими лишь в малом температурном интервале. Температуры сжижения и кристаллизации растут с ростом номера периода. Гелий под атмосферным давлением вообще не становится твёрдым даже при абсолютном нуле — единственный из всех веществ. |
При нормальном давлении температуры [[Температура плавления|плавления]] и [[Температура кипения|кипения]] у любого благородного газа отличаются менее чем на 10 °C; таким образом, они остаются жидкими лишь в малом температурном интервале. Температуры сжижения и кристаллизации растут с ростом номера периода. Гелий под атмосферным давлением вообще не становится твёрдым даже при абсолютном нуле — единственный из всех веществ. |
||
== Биологическое действие == |
== Биологическое действие == |
||
Инертные газы не обладают химической [[яд|токсичностью]]. Однако атмосфера с увеличенной концентрацией инертных газов и соответствующим снижением концентрации [[кислород]]а может оказывать удушающее действие на человека, вплоть до потери сознания и смерти<ref>[http://fire-engine.ru/print.php?page=opasnosti-azot-argon Опасности при работе с азотом и аргоном]</ref><ref>[http://www.inetstati.ru/instr/20-instrukciya-po-yekspluatacii-ballonov-s-argonom-ispolzuemyx-v-spektralnoj-laboratorii.html Инструкция по эксплуатации баллонов с аргоном, используемых в спектральной лаборатории]{{Недоступная ссылка|date=Май 2018 |bot=InternetArchiveBot }}</ref>. Известны случаи гибели людей при утечках инертных газов. |
|||
Ввиду высокой [[Радиоактивность|радиоактивности]] всех изотопов радона он является радиотоксичным. Наличие радона и радиоактивных продуктов его распада во вдыхаемом воздухе вызывает стохастические эффекты хронического облучения, в частности [[Рак (заболевание)|рак]]. |
Ввиду высокой [[Радиоактивность|радиоактивности]] всех изотопов радона он является радиотоксичным. Наличие радона и радиоактивных продуктов его распада во вдыхаемом воздухе вызывает стохастические эффекты хронического облучения, в частности [[Рак (заболевание)|рак]]. |
||
| Строка 70: | Строка 86: | ||
== Применение == |
== Применение == |
||
[[Файл:Glowing noble gases.jpg|мини|350px|справа|Благородные газы в вакуумных стеклянных колбах, через которые пропущен ток]] |
[[Файл:Glowing noble gases.jpg|мини|350px|справа|Благородные газы в вакуумных стеклянных колбах, через которые пропущен ток]] |
||
Лёгкие инертные газы имеют очень низкие точки кипения и плавления, что позволяет их использовать в качестве [[холодильный агент|холодильного агента]] в [[криогенная техника|криогенной технике]]. [[Жидкий гелий]], который кипит при {{nobr|4,2 К}} {{nobr|(−268,95 °C)}}, используется для получения сверхпроводимости — в частности, для охлаждения [[Сверхпроводник|сверхпроводящих]] обмоток электромагнитов, применяемых, например, для [[Магнитно-резонансная томография|магнитно-резонансной томографии]] и других приложений [[Ядерный магнитный резонанс|ядерного магнитного резонанса]]. Жидкий неон, хотя его температура кипения {{nobr|(–246,03 °C)}} и не достигает таких низких значений как у жидкого гелия, также находит применение в криогенике, потому что его охлаждающие свойства ([[Удельная теплота парообразования и конденсации|удельная теплота испарения]]) более чем в 40 раз лучше, чем у жидкого гелия, и более чем в три раза лучше, чем у жидкого водорода. |
|||
Гелий, благодаря его пониженной растворимости в жидкостях, особенно в липидах, используется вместо азота как компонент [[Газовая смесь для дыхания|дыхательных смесей]] для дыхания под давлением (например, при [[Дайвинг|подводном плавании]]). Растворимость газов в [[кровь|крови]] и [[Ткань (биология)|биологических тканях]] растёт под давлением. В случае использования для дыхания обычного воздуха или других азотсодержащих дыхательных смесей это может стать причиной эффекта, известного как [[азотное отравление]]. |
Гелий, благодаря его пониженной растворимости в жидкостях, особенно в липидах, используется вместо азота как компонент [[Газовая смесь для дыхания|дыхательных смесей]] для дыхания под давлением (например, при [[Дайвинг|подводном плавании]]). Растворимость газов в [[кровь|крови]] и [[Ткань (биология)|биологических тканях]] растёт под давлением. В случае использования для дыхания обычного воздуха или других азотсодержащих дыхательных смесей это может стать причиной эффекта, известного как [[азотное отравление]]. |
||
Версия от 18:45, 15 января 2019
| Группа → | 18 | ||||||
|---|---|---|---|---|---|---|---|
| ↓ Период | |||||||
| 1 |
| ||||||
| 2 |
| ||||||
| 3 |
| ||||||
| 4 |
| ||||||
| 5 |
| ||||||
| 6 |
| ||||||
| 7 |
| ||||||
Благоро́дные га́зы (также ине́ртные[1] или ре́дкие га́зы[2]) — группа химических элементов со схожими свойствами: при нормальных условиях они представляют собой одноатомные газы без цвета, запаха и вкуса с очень низкой химической реактивностью[англ.]. К благородным газам относятся гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радиоактивный радон (Rn). Формально к этой группе также причисляют недавно открытый оганесон (Og), однако его химические свойства почти не исследованы.
В первых 6 периодах периодической таблицы химических элементов инертные газы относятся к последней, 18-й группе. Согласно старой европейской системе нумерации групп периодической таблицы, группа инертных газов обозначается VIIIA (главная подгруппа 8-й группы, или подгруппа гелия), согласно старой американской системе — VIIIB; кроме того, в некоторых источниках, особенно в старых, группа инертных газов обозначается цифрой 0, ввиду характерной для них нулевой валентности. Возможно, что из-за релятивистских эффектов элемент 7-го периода 14-й группы флеровий обладает некоторыми свойствами благородных газов[3]. Он может заменить в периодической таблице оганесон[4]. Благородные газы химически неактивны и способны участвовать в химических реакциях лишь при экстремальных условиях.
Характеристики благородных газов объяснены современными теориями структуры атома: их электронные оболочки из валентных электронов являются заполненными, тем самым позволяя участвовать лишь в очень малом количестве химических реакций: известны всего несколько сотен химических соединений этих элементов.
Неон, аргон, криптон и ксенон выделяют из воздуха специальными установками, используя при этом методы сжижения газов и фракционированной конденсации. Источником гелия являются месторождения природного газа с высокой концентрацией гелия, который отделяется с помощью методов криогенного разделения газов. Радон обычно получают как продукт радиоактивного распада радия из растворов соединений этого элемента.
Химические свойства

Благородные газы не поддерживают горения и не возгораются при нормальных условиях.
| № | Элемент | № электронов/электронной оболочки |
|---|---|---|
| 2 | гелий | 2 |
| 10 | неон | 2, 8 |
| 18 | аргон | 2, 8, 8 |
| 36 | криптон | 2, 8, 18, 8 |
| 54 | ксенон | 2, 8, 18, 18, 8 |
| 86 | радон | 2, 8, 18, 32, 18, 8 |
Соединения
Инертные газы отличаются химической неактивностью (отсюда и название). Тем не менее, в 1962 году Нил Барлетт показал, что все они при определённых условиях могут образовывать соединения (особенно охотно со фтором). Наиболее «инертны» неон и гелий: чтобы заставить их вступить в реакцию, нужно применить много усилий, искусственно ионизируя каждый атом. Ксенон же, наоборот, слишком активен (для инертных газов) и реагирует даже при нормальных условиях, демонстрируя чуть ли не все возможные степени окисления (+1, +2, +4, +6, +8). Радон тоже имеет высокую химическую активность (по сравнению с лёгкими инертными газами), но он радиоактивен и быстро распадается, поэтому подробное изучение его химических свойств осложнено, в отличие от ксенона.
Оганесон, несмотря на его принадлежность к 18-й группе периодической таблицы, может не являться инертным газом, так как предполагается, что при нормальных условиях в силу релятивистских эффектов, влияющих на движение электронов вблизи его ядра с высоким зарядом, он будет находиться в твёрдом состоянии[5].
Физические свойства
Инертные газы бесцветны, прозрачны и не имеют запаха и вкуса. В небольшом количестве они присутствуют в воздухе и некоторых горных породах, а также в атмосферах некоторых планет-гигантов и планет земной группы. Гелий является вторым (после водорода) по распространённости элементом во Вселенной, однако для Земли он является редким газом, который улетучился в космос во время образования планеты. Почти весь добываемый гелий является радиогенным продуктом происходящего в течение миллиардов лет в недрах Земли альфа-распада урана, тория и их дочерних элементов; лишь малая часть земного гелия сохранилась от эпохи образования Солнечной системы. Аналогично, по большей части радиогенным является и аргон, возникший в результате постепенного радиоактивного распада калия-40.
При нормальных условиях все элементы 18-й группы (кроме, возможно, оганесона) являются одноатомными газами. Их плотность растёт с увеличением номера периода. Плотность гелия при нормальных условиях примерно в 7 раз меньше плотности воздуха, тогда как радон почти в восемь раз тяжелее воздуха.
При нормальном давлении температуры плавления и кипения у любого благородного газа отличаются менее чем на 10 °C; таким образом, они остаются жидкими лишь в малом температурном интервале. Температуры сжижения и кристаллизации растут с ростом номера периода. Гелий под атмосферным давлением вообще не становится твёрдым даже при абсолютном нуле — единственный из всех веществ.
Биологическое действие
Инертные газы не обладают химической токсичностью. Однако атмосфера с увеличенной концентрацией инертных газов и соответствующим снижением концентрации кислорода может оказывать удушающее действие на человека, вплоть до потери сознания и смерти[6][7]. Известны случаи гибели людей при утечках инертных газов.
Ввиду высокой радиоактивности всех изотопов радона он является радиотоксичным. Наличие радона и радиоактивных продуктов его распада во вдыхаемом воздухе вызывает стохастические эффекты хронического облучения, в частности рак.
Инертные газы обладают биологическим действием, которое проявляется в их наркотическом воздействии на организм и по силе этого воздействия располагаются по убыванию в следующем порядке (в сравнении приведены также азот и водород): Xe — Kr — Ar — N2 — H2 — Ne — He. При этом ксенон и криптон проявляют наркотический эффект при нормальном барометрическом давлении, аргон — при давлении свыше 0,2 МПа (2 атм), азот — свыше 0,6 МПа (6 атм), водород — свыше 2,0 МПа (20 атм). Наркотическое действие неона и гелия в опытах не регистрируются, так как под давлением раньше возникают симптомы «нервного синдрома высокого давления» (НСВД)[8].
Применение

Лёгкие инертные газы имеют очень низкие точки кипения и плавления, что позволяет их использовать в качестве холодильного агента в криогенной технике. Жидкий гелий, который кипит при 4,2 К (−268,95 °C), используется для получения сверхпроводимости — в частности, для охлаждения сверхпроводящих обмоток электромагнитов, применяемых, например, для магнитно-резонансной томографии и других приложений ядерного магнитного резонанса. Жидкий неон, хотя его температура кипения (–246,03 °C) и не достигает таких низких значений как у жидкого гелия, также находит применение в криогенике, потому что его охлаждающие свойства (удельная теплота испарения) более чем в 40 раз лучше, чем у жидкого гелия, и более чем в три раза лучше, чем у жидкого водорода.
Гелий, благодаря его пониженной растворимости в жидкостях, особенно в липидах, используется вместо азота как компонент дыхательных смесей для дыхания под давлением (например, при подводном плавании). Растворимость газов в крови и биологических тканях растёт под давлением. В случае использования для дыхания обычного воздуха или других азотсодержащих дыхательных смесей это может стать причиной эффекта, известного как азотное отравление.
Благодаря меньшей растворимости в липидах, атомы гелия задерживаются клеточной мембраной, и поэтому гелий используется в дыхательных смесях, таких как тримикс и гелиокс, уменьшая наркотический эффект газов, возникающий на глубине. Кроме того, пониженная растворимость гелия в жидкостях тела позволяет избежать кессонной болезни при быстром всплытии с глубины. Уменьшение остатка растворённого газа в теле означает, что во время всплытия образуется меньшее количество газовых пузырьков; это уменьшает риск газовой эмболии. Другой инертный газ, аргон, рассматривается как лучший выбор для использования в качестве прослойки к сухому костюму[9][неавторитетный источник] для подводного плавания.
Аргон, наиболее дешёвый среди инертных газов (его содержание в атмосфере составляет около 1 %), широко используется при сварке в защитных газах, резке и других приложениях для изоляции от воздуха металлов, реагирующих при нагреве с кислородом (и азотом), а также для обработки жидкой стали. Аргон также применяется в люминесцентных лампах для предотвращения окисления разогретого вольфрамового электрода. Также, ввиду низкой теплопроводности, аргон (а также криптон) используют для заполнения стеклопакетов.
После крушения дирижабля «Гинденбург» в 1937 году огнеопасный водород был заменен негорючим гелием в качестве заполняющего газа в дирижаблях и воздушных шарах, несмотря на снижение плавучести на 8,6 % по сравнению с водородом. Несмотря на замену, катастрофа оказала непропорционально большое влияние на всю область герметичных летательных аппаратов легче воздуха и подорвала планы по расширению этой области авиации более чем на полвека. Они стали популярнее только в последнее время, с развитием нановолоконных тканей и альтернативной энергетики.
Цвета и спектры благородных газов
| Форма | Гелий | Неон | Аргон | Криптон | Ксенон |
| В колбе под действием электричества | 
|

|

|

|

|
| В прямой трубке | 
|

|

|

|

|
| В трубках-литерах Периодической таблицы | 
|

|

|

|

|
| Cпектр поглощения газа |
См. также
Примечания
- ↑ Инертные газы // Казахстан. Национальная энциклопедия. — Алматы: Қазақ энциклопедиясы, 2005. — Т. II. — ISBN 9965-9746-3-2. (CC BY-SA 3.0)
- ↑ Благородные газы — статья из Химической энциклопедии
- ↑ Flerov laboratory of nuclear reactions. JINR. Дата обращения: 8 августа 2009.
- ↑ Nash, Clinton S. (2005). "Atomic and Molecular Properties of Elements 112, 114, and 118". J. Phys. Chem. A. 109 (15): 3493—3500. doi:10.1021/jp050736o. PMID 16833687.
- ↑ Wieser M.E. (2006). "Atomic weights of the elements 2005 (IUPAC Technical Report)". Pure Appl. Chem. 78 (11): 2051—2066. doi:10.1351/pac200678112051.
- ↑ Опасности при работе с азотом и аргоном
- ↑ Инструкция по эксплуатации баллонов с аргоном, используемых в спектральной лаборатории (недоступная ссылка)
- ↑ Павлов Б.Н. Проблема защиты человека в экстремальных условиях гипербарической среды обитания. www.argonavt.com (15 мая 2007). Дата обращения: 22 мая 2010. Архивировано 22 августа 2011 года.
- ↑ en:Dry_suit (англ.)
Литература
- Беннетт, Питер. The Physiology and Medicine of Diving / Питер Беннетт, Дэвид Эллиотт. — SPCK Publishing, 1998. — ISBN 0-7020-2410-4.
- Bobrow Test Preparation Services. CliffsAP Chemistry. — CliffsNotes, 2007-12-05. — ISBN 0-470-13500-X.
- Гринвуд, Н.Н. Chemistry of the Elements / Н.Н. Гринвуд, A. Ёрншо. — 2nd. — Oxford:Butterworth-Heinemann, 1997. — ISBN 0-7506-3365-4.
- Хардинг, Чарли Дж. Elements of the P Block / Чарли Дж. Хардинг, Роб Джейнс. — Royal Society of Chemistry, 2002. — ISBN 0-85404-690-9.
- Холловэй, Джон. Noble-Gas Chemistry. — Лондон : Methuen Publishing, 1968. — ISBN 0-412-21100-9.
- Менделеев, Дмитрий. Основы Химии : []. — 7-е. — 1902–1903.
- Оджима, Минору. Noble Gas Geochemistry / Минору Оджима, Франк Подосек. — Cambridge University Press, 2002. — ISBN 0-521-80366-7.
- Вайнхольд, Ф. Valency and bonding / Ф. Вайнхольд, C. Лэндис. — Cambridge University Press, 2005. — ISBN 0-521-83128-8.
- Скерри, Эрик. The Periodic Table, Its Story and Its Significance. — Oxford University Press, 2007. — ISBN 0-19-530573-6.