Бактериородопсин: различия между версиями
| [непроверенная версия] | [отпатрулированная версия] |
мНет описания правки |
Qkowlew (обсуждение | вклад) м Отклонение правок и возврат к версии 98418928 (Sweep-Net) |
||
| Строка 18: | Строка 18: | ||
'''Бактериородопси́ны''' — семейство [[мембранные белки|мембранных]] светочувствительных [[белки|белков]] [[археи|археот]] (например, [[галобактерии|галобактерий]]). Бактериородопсины осуществляют перенос [[протон]]а через [[плазматическая мембрана|плазматическую мембрану]], по строению сходны с [[родопсин]]ами [[млекопитающие|млекопитающих]]. |
'''Бактериородопси́ны''' — семейство [[мембранные белки|мембранных]] светочувствительных [[белки|белков]] [[археи|археот]] (например, [[галобактерии|галобактерий]]). Бактериородопсины осуществляют перенос [[протон]]а через [[плазматическая мембрана|плазматическую мембрану]], по строению сходны с [[родопсин]]ами [[млекопитающие|млекопитающих]]. |
||
Этот белок выполняет ту же функцию, что и [[хлорофилл]] в других организмах - обеспечивает преобразование энергии солнечного света в энергию химических связей. Он действует как зависимая от света [[протонная помпа]]. Поглощение кванта света приводит к быстрым структурным изменениям в молекуле, благодаря которым происходит перенос |
Этот белок выполняет ту же функцию, что и [[хлорофилл]] в других организмах - обеспечивает преобразование энергии солнечного света в энергию химических связей. Он действует как зависимая от света [[протонная помпа]]. Поглощение кванта света приводит к быстрым структурным изменениям в молекуле, благодаря которым происходит перенос катиона водорода с цитоплазмы на внешнюю сторону клеточной мембраны. |
||
== Состав белка == |
== Состав белка == |
||
Трансмембранная часть бактериородопсина сложена из 7 регулярных <math>\alpha</math>-спиралей, идущих от одного до другого края мембраны, а одинокая <math>\beta</math>-шпилька и все нерегулярные участки цепи (соединяющие спирали-петли) выходят из мембраны<ref> А. В. Финкельштейн, О. Б. Птицын, «Физика белка», 2002 </ref>. Сидящие на <math>\alpha</math>-спиралях [[гидрофобность|гидрофобные]] группы обращены «наружу» к липидам (тоже [[гидрофобность|гидрофобным]]) мембраны. Полярные же группы (их немного) обращены внутрь очень узкого канала, по которому идет протон. |
Трансмембранная часть бактериородопсина сложена из 7 регулярных <math>\alpha</math>-спиралей, идущих от одного до другого края мембраны, а одинокая <math>\beta</math>-шпилька и все нерегулярные участки цепи (соединяющие спирали-петли) выходят из мембраны<ref> А. В. Финкельштейн, О. Б. Птицын, «Физика белка», 2002 </ref>. Сидящие на <math>\alpha</math>-спиралях [[гидрофобность|гидрофобные]] группы обращены «наружу» к липидам (тоже [[гидрофобность|гидрофобным]]) мембраны. Полярные же группы (их немного) обращены внутрь очень узкого канала, по которому идет протон. |
||
| Строка 28: | Строка 28: | ||
== Применение бактериородопсина в нано-биотехнологиях == |
== Применение бактериородопсина в нано-биотехнологиях == |
||
В 1971 году Остерхельт (ФРГ) и Стохениус (США) сумели выделить бактериородопсин из клеточной мембраны галобактерии Halobacterium halobium<ref> Oesterhelt D., Stoeckenius W. (1971) Rhodopsin — Like Protein from the Purple Membrane of Halobacterium Halobium, Nature, V. 233, № 89, pp. 149-60. </ref><ref> Vought B.W., Birge R.R. (eds.) (1999) Molecular electronics and hybrid computers./in: Wiley Encyclopedia of Electrical and Electronics Engineering, Wiley-Interscience: New York,.pp. 477—490.</ref>. Природные фотопреобразующие наноматериалы используются в фармакологии, биомедицине, био- и нанотехнологиях. В 1994-м группа российских ученых впервые в мире получила пластинки с бактериородопсином. Пластинки с бактериородопсином можно применять в биомолекулярной электронике. Главный результат достижения — ориентирование пурпурных мембран, которые содержат бактериородопсин в гидрофобных и гидрофильных средах<ref> Мосин О. В., Складнев Д. А., Егорова Т. А., Швец В. И. Получение бактериородопсина H. halobium, меченного дейтерием по остаткам ароматическим аминокислот фенилаланина, тирозина и триптофана // Биотехнология, 1996. — № 10. — С. 24-40.</ref>. В пластинках на желатиновой основе содержится около 50 % бактериородопсина. На основе бактериородопсина создается фоторецептор с микроэлектродом из SnO<sub>2</sub> и на светоизлучающие диоды подается сигнал.<ref> Мосин O.В., Складнев Д. А., Швец В. И. Включение дейтерированных ароматических аминокислот в молекулу бактериородопсина Halobacterium halobium // Прикладная биохимия и микробиология, 1999. — Т. 35. — № 1. — с. 34-42. </ref> Главное применение этого нанотехнологического материала — в искусственных энерго- и фотопреобразующих мембранах и нанопленках. |
В 1971 году Остерхельт (ФРГ) и Стохениус (США) сумели выделить бактериородопсин из клеточной мембраны галобактерии Halobacterium halobium<ref> Oesterhelt D., Stoeckenius W. (1971) Rhodopsin — Like Protein from the Purple Membrane of Halobacterium Halobium, Nature, V. 233, № 89, pp. 149-60. </ref><ref> Vought B.W., Birge R.R. (eds.) (1999) Molecular electronics and hybrid computers./in: Wiley Encyclopedia of Electrical and Electronics Engineering, Wiley-Interscience: New York,.pp. 477—490.</ref>. Природные фотопреобразующие наноматериалы используются в фармакологии, биомедицине, био- и нанотехнологиях. В 1994-м группа российских ученых впервые в мире получила пластинки с бактериородопсином. Пластинки с бактериородопсином можно применять в биомолекулярной электронике. Главный результат достижения — ориентирование пурпурных мембран, которые содержат бактериородопсин в гидрофобных и гидрофильных средах<ref> Мосин О. В., Складнев Д. А., Егорова Т. А., Швец В. И. Получение бактериородопсина H. halobium, меченного дейтерием по остаткам ароматическим аминокислот фенилаланина, тирозина и триптофана // Биотехнология, 1996. — № 10. — С. 24-40.</ref>. В пластинках на желатиновой основе содержится около 50 % бактериородопсина. На основе бактериородопсина создается фоторецептор с микроэлектродом из SnO<sub>2</sub> и на светоизлучающие диоды подается сигнал.<ref> Мосин O.В., Складнев Д. А., Швец В. И. Включение дейтерированных ароматических аминокислот в молекулу бактериородопсина Halobacterium halobium // Прикладная биохимия и микробиология, 1999. — Т. 35. — № 1. — с. 34-42. </ref> Главное применение этого нанотехнологического материала — в искусственных энерго- и фотопреобразующих мембранах и нанопленках. |
||
Дальнейшее исследование родопсина имеет не только фундаментальное значение и может быть использовано не только для лечения или предотвращения биохимических нарушений зрения. Родопсин — самый разносторонне исследованный белок из семейства GPCR-рецепторов, и закономерности, полученные для него, могут быть использованы для изучения структуры и функциональных особенностей других рецепторов этого семейства. |
|||
== Галерея == |
== Галерея == |
||
| Строка 43: | Строка 41: | ||
== Примечания == |
== Примечания == |
||
{{примечания}} |
{{примечания}} |
||
== Источники == |
|||
* https://biomolecula.ru/articles/zritelnyi-rodopsin-retseptor-reagiruiushchii-na-svet |
|||
== См. также == |
== См. также == |
||
Версия от 11:41, 27 марта 2019
| Бактериородопсин | |
|---|---|
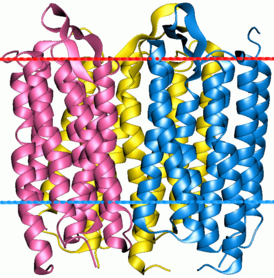 Тример бактериородопсина | |
| Идентификаторы | |
| Символ | Bac_rhodopsin |
| Pfam | PF01036 |
| InterPro | IPR001425 |
| PROSITE | PDOC00291 |
| SCOP | 2brd |
| SUPERFAMILY | 2brd |
| TCDB | 3.E.1 |
| OPM superfamily | 6 |
| OPM protein | 1vgo |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
Бактериородопси́ны — семейство мембранных светочувствительных белков археот (например, галобактерий). Бактериородопсины осуществляют перенос протона через плазматическую мембрану, по строению сходны с родопсинами млекопитающих.
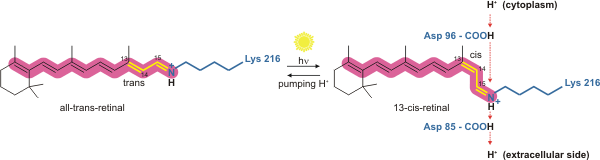
Этот белок выполняет ту же функцию, что и хлорофилл в других организмах - обеспечивает преобразование энергии солнечного света в энергию химических связей. Он действует как зависимая от света протонная помпа. Поглощение кванта света приводит к быстрым структурным изменениям в молекуле, благодаря которым происходит перенос катиона водорода с цитоплазмы на внешнюю сторону клеточной мембраны.
Состав белка
Трансмембранная часть бактериородопсина сложена из 7 регулярных -спиралей, идущих от одного до другого края мембраны, а одинокая -шпилька и все нерегулярные участки цепи (соединяющие спирали-петли) выходят из мембраны[1]. Сидящие на -спиралях гидрофобные группы обращены «наружу» к липидам (тоже гидрофобным) мембраны. Полярные же группы (их немного) обращены внутрь очень узкого канала, по которому идет протон.
Процесс переноса протона через мембрану
Протонная проводимость осуществляется при содействии прикрепленной внутри пучка спиралей молекулы кофактора — ретиналя. Он перекрывает центральный канал бактериородопсина. Поглотив фотон, ретиналь переходит из полностью-транс- в 13-цис-форму. При этом он изгибается и переносит протон с одного конца семиспирального пучка на другой. А потом ретиналь разгибается и возвращается назад, но уже без протона.
Применение бактериородопсина в нано-биотехнологиях
В 1971 году Остерхельт (ФРГ) и Стохениус (США) сумели выделить бактериородопсин из клеточной мембраны галобактерии Halobacterium halobium[2][3]. Природные фотопреобразующие наноматериалы используются в фармакологии, биомедицине, био- и нанотехнологиях. В 1994-м группа российских ученых впервые в мире получила пластинки с бактериородопсином. Пластинки с бактериородопсином можно применять в биомолекулярной электронике. Главный результат достижения — ориентирование пурпурных мембран, которые содержат бактериородопсин в гидрофобных и гидрофильных средах[4]. В пластинках на желатиновой основе содержится около 50 % бактериородопсина. На основе бактериородопсина создается фоторецептор с микроэлектродом из SnO2 и на светоизлучающие диоды подается сигнал.[5] Главное применение этого нанотехнологического материала — в искусственных энерго- и фотопреобразующих мембранах и нанопленках.
Галерея
 |
 |
 |
Примечания
- ↑ А. В. Финкельштейн, О. Б. Птицын, «Физика белка», 2002
- ↑ Oesterhelt D., Stoeckenius W. (1971) Rhodopsin — Like Protein from the Purple Membrane of Halobacterium Halobium, Nature, V. 233, № 89, pp. 149-60.
- ↑ Vought B.W., Birge R.R. (eds.) (1999) Molecular electronics and hybrid computers./in: Wiley Encyclopedia of Electrical and Electronics Engineering, Wiley-Interscience: New York,.pp. 477—490.
- ↑ Мосин О. В., Складнев Д. А., Егорова Т. А., Швец В. И. Получение бактериородопсина H. halobium, меченного дейтерием по остаткам ароматическим аминокислот фенилаланина, тирозина и триптофана // Биотехнология, 1996. — № 10. — С. 24-40.
- ↑ Мосин O.В., Складнев Д. А., Швец В. И. Включение дейтерированных ароматических аминокислот в молекулу бактериородопсина Halobacterium halobium // Прикладная биохимия и микробиология, 1999. — Т. 35. — № 1. — с. 34-42.
- ↑ Nishikawa, T.; Murakami, M. Crystal structure of the 13-cis isomer of bacteriorhodopsin. RCSB Protein Data Bank (PDB) (28 марта 2005). doi:10.2210/pdb1x0s/pdb. Дата обращения: 7 октября 2012.
- ↑ Nishikawa, T.; Murakami, M. (2005). "Crystal structure of the 13-cis isomer of bacteriorhodopsin in the dark-adapted state". J.Mol.Biol. 352. Elsevier: 319—328. doi:10.1016/j.jmb.2005.07.021. PMID 16084526. PDB ID: 1X0S. Дата обращения: 7 октября 2012.
- ↑ Image created with RasTop (Molecular Visualization Software)