Конфокальная микроскопия
Конфокальная микроскопия (конфокальная лазерная сканирующая микроскопия, КЛСМ (англ. confocal laser scanning microscopy)) — разновидность световой оптической микроскопии, обладающей значительным контрастом и пространственным разрешением по сравнению с классической световой микроскопией, что достигается использованием точечной диафрагмы (пинхол, pinhole), размещённой в плоскости изображения и ограничивающей поток фонового рассеянного света излучаемого не из фокальной плоскости объектива[1]. Это позволяет получить серии изображений на различных глубинах фокальной плоскости внутри образца (т. н. оптическое секционирование образца по глубине), и затем реконструировать трехмерное изображение образца из этих серий. Конфокальная микроскопия получила широкое применение в области биологии, медицины, материаловедения и физике полупроводников.
История
Первые прототипы

В 1940 году Ганс Гольдманн, офтальмолог из Берна, Швейцария, разработал систему щелевых ламп для документирования глазных обследований[2]. Эта система рассматривается некоторыми более поздними авторами в качестве первой конфокальной оптической системы.[3][4]
В 1943 году Зюн Коана опубликовала конфокальную систему.[3] В 1951 году Хирото Наора, коллега Коаны, описал конфокальный микроскоп в журнале Science для спектрофотометрии[5].
В 1950-х годах биологам понадобилось увеличить контраст изображений меченых флюорохромами объектов в толстых срезах тканей[6]. Для разрешения этой проблемы Марвин Минский, профессор Массачусетского технологического института в США, предложил использовать для флуоресцентных микроскопов конфокальную схему. В 1957 г. Минский получил на эту схему патент[7].

Тандем-сканирующий микроскоп
В 1960-х годах чехословацкий ученый Моймир Петраш, сотрудник медицинского факультета Карловского университета в Пльзени, разработал Тандем-сканирующий микроскоп, первый коммерческий конфокальный микроскоп, в конструкции которого использовался вращающийся диск — диск Нипкова — для создания и локализации множественных точечных источников возбуждения и излучения.[8][9]
Чехословацкий патент был подан в 1966 году Петрашем и его коллегой Миланом Хадравским. Первая научная публикация с данными и изображениями, полученными с помощью этого микроскопа, авторами которой стали Дэвид Эггер из Йельского университета и непосредственно Моймир Петраш, была опубликована в журнале Science в 1967 году[10]. Вторая публикация 1968 года описывает теорию и технические детали прибора[11]. В 1970 году на изобретение был получен патент в США.[12]
Совмещение конфокального микроскопа с лазерным осветителем
В 1969 и 1971 гг. ученые Дэвид Эггер и Пол Давидович из Йельского университета опубликовали пионерские работы, описывающие первый конфокальный лазерный сканирующий микроскоп[13][14] Это был точечный сканер, то есть генерировалось только одно пятно освещения. Они использовали эпи-подсветку в отраженном свете для наблюдения нервной ткани. В качестве источника когерентного излучения использовался 5 мВт гелий-неоновый лазер с длиной волны 633 нм. Лазерный пучок отражался полупрозрачным зеркалом в направлении объектива. Объективом являлась простая линза с фокусным расстоянием 8,5 мм. В отличие от всех предыдущих (а впоследствии и поздних конструкций конфокальных систем) образец сканировался движением этой линзы (сканирование объективом), что приводило к перемещению фокальной точки. Отраженный свет возвращался на полупрозрачное зеркало, фокусировался другой линзой на диафрагму (пинхол), позади которой размещался фотоэлектронный умножитель. Сигнал визуализировался с помощью ЭЛТ осциллографа, катодный луч перемещался одновременно с объективом. С помощью специального адаптера, предусматривалась возможность делать фотографии на фотоаппарат Polaroid. Три из полученных таким образом фотографии были опубликованы в работе 1971 года[14].
Получили свое развитие и схемы конфокального сканирующего микроскопа Марвина Мински с использованием лазерного излучения[15]. В дальнейшем основное внимание исследователей было направлено на анализ применения флуоресцентных красителей для исследований in vivo и улучшение качества конфокального изображения за счет увеличения интенсивности флуоресцентного излучения.
Развитие сканирующих систем
В 1977 году Колин Дж. Р. Шеппард и Амаржиоти Чоудхури опубликовали теоретический анализ конфокальных и лазерно-сканирующих микроскопов.[16] Вероятно, это явилось первой научной публикацией, в которой использовался термин «конфокальный микроскоп».[17] В 1978 году Кристоф Кремер и Томас Кремер опубликовали проект конфокального лазерного сканирующего микроскопа, используя флуоресцентное возбуждение с электронным автофокусом.[18] В этой модели КЛСМ впервые был совмещен метод лазерного сканирования с объемной детекцией биологических объектов, меченных флуоресцентными маркерами. В 1978 и 1980 годах оксфордская группа Колина Шеппарда и Тони Уилсона описала конфокальную систему с эпи-лазерной подсветкой, сканирующим предметным столиком и фотоумножителями в качестве детекторов. Столик мог перемещаться вдоль оптической оси, что позволяло проводить трёхмерное оптическое послойное секционирование.[17] В 1979 году Фред Бракенхофф и его коллеги продемонстрировали, что теоретические преимущества оптического секционирования и улучшение оптического разрешения действительно достижимы на практике.[19] В 1983 году И. Кокс и Ш. Шеппард опубликовали первую работу, в которой конфокальный микроскоп управлялся персональным компьютером.[20]
Точечное сканирование лазерным пучком

В середине 1980-х годов Уильям Брэдшоу Амос и Джон Грэлхем Уайт с коллегами из Лаборатории молекулярной биологии в Кембридже построили первый конфокальный лазерно-сканирующий микроскоп.[21][22] В его оптической схеме сканирование осуществлялось путем последовательного перемещения пучка освещения по образцу, а не движением столика с образцом. Данная схема позволила значительно увеличить скорость сканирования за счет отказа от инерционных механических систем сканирования и достичь быстродействия до четырех кадров в секунду (512 строк в каждом).[21]
Параллельно совет медицинских исследований (MRC) Великобритании, спонсировал разработку прототипа современного коммерческого конфокального микроскопа, который в дальнейшем был приобретен компанией Bio-Rad, дополнен компьютерным управлением и коммерциализирован как «MRC 500». Преемник MRC 600 позднее стал основой для разработки первого двухфотонного флуоресцентного микроскопа, разработанного в 1990 году в Корнельском университете.[19]
Исследования, проводимые в Стокгольмском университете примерно в то же время, также трансформировались в коммерческий КЛСМ Sarastro.[23]
Предприятие было приобретено в 1990 году Molecular Dynamics[24], но дальнейшая разработка системы в конечном итоге была прекращена.
В 1989 году Фритц Карл и Экхард Прайкшаты изобрели сканирующий лазерно-диодный микроскоп для анализа размеров частиц.[25][26]
В Германии компания Heidelberg Instruments, основанная в 1984 году, разработала технологию КЛСМ, которая первоначально предназначалась для промышленного применения, а не для биологии. В начале 1990-х гг данная технология активно развивалась в компаниях Leica Lasertechnik и Carl Zeiss, которая на тот момент уже успешно осуществляла выпуск световых микроскопов с реализованной схемой сканирования лазерным пучком, которые в дальнейшем были модернизирована до конфокальных систем[27].
Принцип работы

Оптическая схема обычного светового микроскопа формирует изображение всей части образца, находящегося в ГРИП используемого микрообъектива, а конфокальный микроскоп формирует изображение очень тонкого среза объекта на одном уровне глубины. По сути, метод КЛСМ достигается за счет контролируемого ограничения глубины фокуса оптической системы.
Принцип конфокальной визуализации был запатентован в 1957 году Марвином Минским[28][29] и направлен на преодоление некоторых ограничений традиционных флуоресцентных микроскопов. В обычном (широкопольном) флуоресцентном микроскопе весь образец равномерно освещается источником излучения микроскопа. При этом происходит одновременное облучение и возбуждение всего образца, а результирующая флуоресценция детектируется с помощью фотоприемника или камеры микроскопа, включая большую фоновую часть объекта. Напротив, конфокальный микроскоп использует точечную подсветку (см. Функция Размытия Точки, Point Spread Function) и пинхол в оптически сопряженной плоскости перед детектором для исключения внефокусного сигнала. Таким образом, происходит детектирование флуоресцентного излучения только из фокальной плоскости, поэтому оптическое разрешение изображения, особенно вдоль оси Z (по глубине образца), намного выше, чем у обычных световых микроскопов. Однако, поскольку большая часть флуоресценции от образца диафрагмируется, увеличению разрешения сопутствует снижение интенсивности полезного сигнала. Для компенсации этого побочного эффекта используют более длительную экспозицию детектора и высокочувствительные фотоприемники, как правило ФЭУ или лавинный фотодиод, которые преобразуют оптический сигнал в электрический, с последующей регистрацией на персональном компьютере[30].
Поскольку на образце регистрируется только одна флуоресцирующая точка, то для формирования двумерного или трехмерного изображения требуется растровое сканирование образца. Лазерный пучок перемещается по образцу в горизонтальной плоскости с использованием одного или нескольких зеркал с управляемым углом наклона. Этот метод сканирования обычно имеет низкую скорость сканирования, которая, однако, может варьироваться. Так, более медленное сканирование обеспечивает лучшее соотношение сигнал/шум, что приводит к лучшему контрасту и более высокому разрешению.
Как известно, ГРИП КЛСМ прямо пропорциональна длине волны используемого излучения и обратно пропорциональна числовой апертуре микрообъектива, а также зависит от оптических свойств образца. Благодаря этому в КЛСМ с помощью различных алгоритмов происходит программная реконструкция точки 3D-объектов. Наиболее распространенным является алгоритм поиска максимума интенсивности.[31]
Конфокальный микроскоп имеет разрешение такое же как и обычный микроскоп и ограничено оно дифракционным пределом.
где — длина волны излучения, — числовая апертура объектива, — показатель преломления среды между образцом и объективом, — половина угла, который «захватывает» объектив. В видимом диапазоне разрешение составляет ~ 250 нм (NA=1,45, n=1,51).Однако в последние годы успешно развиваются схемы микроскопов, которые используют нелинейные свойства флуоресценции образцов. В этом случае достигается разрешение значительно меньшее дифракционного предела и составляет ~ 3—10 нм[32][33][34][35].
Рассмотрим теперь вопрос увеличения контрастности при использовании конфокальной оптической схемы. Во-первых, так как в конфокальном микроскопе свет дважды проходит через объектив, то функция размытия точки[36] (далее обозначаемая PSF) имеет следующий вид:
,
где Pconf — конфокальная функция размытия точки, а p — обычная функция размытия точки.

Таким образом, достижимая толщина фокальной плоскости определяется в основном длиной волны используемого излучения, деленной на числовую апертуру объектива, а также зависит от оптических свойств образца. Благодаря тонкому оптическому срезу эти типы микроскопов особенно хороши для 3D-визуализации и поверхностном профилировании образцов.
Последовательные срезы формируют «z-стек», который может быть обработан определенным программным обеспечением для создания реконструированного 3D-изображения или представлен в двухмерном стеке для публикации, благодаря распространенному алгоритму поиска максимума интенсивности.[31]
Конфокальная микроскопия обеспечивает возможность прямого, неинвазивного последовательного оптического секционирования интактных толстых живых образцов с минимальными требованиями к их подготовке, а также более высокое латеральное разрешение в сравнении с обычной световой микроскопией[37][38]. Как правило, биологические образцы контрастируют флуоресцентными красителями, чтобы визуализировать их определенные области или органеллы. При этом фактическая концентрация красителя может быть очень низкой, чтобы свести к минимуму воздействие на биологические системы. Так, некоторые конфокальные системы могут отслеживать отдельные флуоресцентные молекулы[39]. Кроме того, трансгенные технологии могут создавать организмы, которые продуцируют свои собственные флуоресцентные химерные молекулы (меченые GFP, green fluorescent protein)[40].
Конфокальный лазерный сканирующий микроскоп, имеющий высокий контраст, даёт две неоценимые возможности: он позволяет исследовать ткани на клеточном уровне в состоянии физиологической жизнедеятельности, а также оценивать результаты (динамику) клеточной активности в четырёх измерениях — высота, ширина, глубина и время.[41]
Пространственное разрешение в конфокальной микроскопии


Применяя критерий Релея для разрешения (провал 26 % от максимума распределения), мы получим, что разрешение в конфокальном микроскопе увеличивается, но не существенно. Для конфокального микроскопа разрешение (rc) определяется следующим образом[8][42][1]:
,
где n — относительный показатель преломления, D — диаметр входного зрачка оптической системы, λ — длина волны, F — фокусное расстояние микрообъектива, θ - апертурный угол микрообъектива, λ'=λ/n. Для обычного светового микроскопа разрешение (rr):
Однако основным достоинством конфокального микроскопа является не увеличение разрешения в смысле критерия Релея, а существенное увеличение контрастности. В частности для обычной PSF в фокальной плоскости отношение амплитуды в первом боковом максимуме к амплитуде главного максимума составляет 2 %, для случая конфокального микроскопа это отношение будет 0,04 %. На рисунке приведено распределение интенсивностей флуоресцентного сигнала. На верхней части рисунка мы видим, что тусклый объект (интенсивность в 200 раз меньше, чем у яркого) невозможно обнаружить в обычный световой микроскоп, хотя расстояние между объектами существенно больше определяемого критерием Релея для их разрешения. В то же самое время, методом конфокальной микроскопии данный объект хорошо регистрируется.
Конфокальная микроскопия обеспечивает увеличение контраста изображения за счет использования сфокусированной подсветки (возбуждения) в области анализа и диафрагмирования флуоресцентного излучения в плоскости изображения. Такое увеличение контрастности приводит к возможности разрешения объектов, имеющих разницу в интенсивности до 200:1, а также обеспечивает повышение разрешения, как в плоскости объекта, так и вдоль оптической оси. Наряду с повышением контрастности флуоресцентная конфокальная микроскопия позволяет обеспечивать пошаговую трехмерную реконструкцию исследуемого объекта за счет использования многоточечной подсветки. Среди наиболее передовых методик сканирующей конфокальной микроскопии следует выделить использование сканирующего диска с микродиафрагмами и применение матричных фотодетекторов [2].
На сегодня существуют методы, которые позволяют значительно повысить разрешающую способность конфокального микроскопа. В обычном конфокальном микроскопе возбуждающий свет фокусируется в одну точку на образце с последующей детекцией эмиссионного флуоресцентного сигнала. Эмиссионное излучение вне фокуса отсекается пинхолом (точечной диафрагмой), размер которого определяет, сколько максимумов диска Эйри достигнет детектора. Увеличения разрешения можно добиться за счет уменьшения диаметра диафрагмы (пинхола), но соотношение «сигнал-шум» при этом значительно снизится за счет уменьшения интенсивности проходящего через диафрагму эмиссионного излучения. Альтернативой такому сканированию является использование матричных детекторов[43][44], которые одновременно регистрируют распределение интенсивности вдоль латеральной плоскости образца одновременно со всей площади диска Эйри, где каждый фоточувствительный элемент выполняет функцию пинхол апертуры. Так, с использованием алгоритма детекции 32-канальным матричным детектором (Airyscan[45][46]), была показана возможность превышения предела классического разрешения (дифракционного предела) более чем в 1,7 раза во всех трех измерениях: до 140 нм латерально и 400 нм аксиально при длине волны 488 нм[47][48][49][50][51][52][53].
Применение
КЛСМ широко используется практически во всех отраслях биологии, от клеточной биологии и генетики до микробиологии и биологии развития. Она также используется в квантовой оптике и нанокристаллической визуализации и спектроскопии.
- Биология и медицина
В клиническом плане, КЛСМ используется для исследования различных заболеваний глаз, и особенно для визуализации, качественного анализа и количественной оценки эндотелиальных клеток роговицы[54]. Он используется для локализации и идентификации присутствия нитевидных грибковых филаментов в строме роговицы в случаях кератомикоза, что обеспечивает быструю диагностику и раннее введение корректной терапии. Также представляется перспективным проведение методом КЛСМ эндоскопических процедур (эндомикроскопия)[55]. В фармацевтической промышленности было рекомендовано с помощью данного подхода отслеживать процесс производства тонкопленочных фармацевтических форм, контролировать качество и однородность распределения лекарственных субстанций.
- Оптика и кристаллография
КЛСМ используется как механизм восстановления данных в некоторых 3D-оптических системах хранения данных или картировании химических соединений, а также в физике полупроводников и спинтронике (в частности, в изучении свойств NV-центров).[56][57].
Пример изображений, полученных методом КЛСМ
-
Серия конфокальных изображений (z-стек), демонстрирующих распределение актиновых филаментов в клеточной линии остеосаркомы U2OS
-
3D реконструкция серии конфокальных изображений ядра фиксированных клеток линии HeLa, трансгенный химерный белок гистон H2B-GFP
-
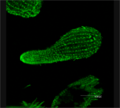
Срез листа Pteridium aquilinum
-
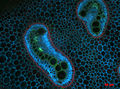
Конфокальное изображение поперечного среза стебля Lycopodium annotinum
-
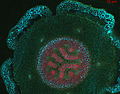
Поперечный срез листа Dryopleris filix-mas
-
Конфокальное изображение фрагмента монеты «1 евро»
-
Двухканальное конфокальное изображение митотических микротрубочек
См. также
- Оптическая микроскопия
- Флуоресцентная микроскопия
- Флуоресцентная наноскопия
- Флуоресценция в биологических исследованиях
- Лазерная микроскопия
Примечания
- ↑ Handbook of Biological Confocal Microscopy / J.B. Pawley. — 3rd ed. — Berlin : Springer, 2006. — 985 p. — ISBN 0-387-25921-X. — doi:10.1007/978-0-387-45524-2.
- ↑ Hans Goldmann (1939) - Академия Google. scholar.google.ru. Дата обращения: 11 мая 2017.
- ↑ 1 2 Wiley-VCH Verlag GmbH & Co. KGaA. Confocal Microscopy | Imaging & Microscopy - Research, Development, Production (англ.). www.imaging-git.com. Дата обращения: 11 мая 2017.
- ↑ Barry R. Masters. Confocal Microscopy and Multiphoton Excitation Microscopy: The Genesis of Live Cell Imaging. — SPIE Press, 2006-01-01. — 234 с. — ISBN 9780819461186.
- ↑ Hiroto Naora. Microspectrophotometry in Visible Light Range. — 1958-01-01. — book с.
- ↑ Конфокальная микроскопия
- ↑ US 3013467
- ↑ 1 2 Robert H. Webb. Confocal optical microscopy (англ.) // Reports on Progress in Physics. — 1996-01-01. — Vol. 59, iss. 3. — P. 427. — ISSN 0034-4885. — doi:10.1088/0034-4885/59/3/003.
- ↑ Guy Cox. Optical Imaging Techniques in Cell Biology, Second Edition. — CRC Press, 2012-06-04. — 319 с. — ISBN 9781439848258.
- ↑ M. David Egger, Mojmir Petran. New Reflected-Light Microscope for Viewing Unstained Brain and Ganglion Cells (англ.) // Science. — 1967-07-21. — Vol. 157, iss. 3786. — P. 305—307. — ISSN 1095-9203 0036-8075, 1095-9203. — doi:10.1126/science.157.3786.305.
- ↑ Mojmír Petráň, Milan Hadravský, M. David Egger, Robert Galambos. Tandem-Scanning Reflected-Light Microscope* (EN) // JOSA. — 1968-05-01. — Т. 58, вып. 5. — С. 661—664. — doi:10.1364/JOSA.58.000661.
- ↑ Method and arrangement for improving the resolving power and contrast. Дата обращения: 11 мая 2017.
- ↑ M. D. Egger, W. Gezari, P. Davidovits, M. Hadravský, M. Petráň. Observation of nerve fibers in incident light (англ.) // Experientia. — 1969-11-01. — Vol. 25, iss. 11. — P. 1225—1226. — ISSN 1420-9071 0014-4754, 1420-9071. — doi:10.1007/BF01900292.
- ↑ 1 2 P. Davidovits, M. D. Egger. Scanning Laser Microscope for Biological Investigations (EN) // Applied Optics. — 1971-07-01. — Т. 10, вып. 7. — С. 1615—1619. — ISSN 1539-4522. — doi:10.1364/AO.10.001615.
- ↑ Barry R. Masters. Confocal Microscopy and Multiphoton Excitation Microscopy: The Genesis of Live Cell Imaging. — SPIE Press, 2006-01-01. — 234 с. — ISBN 9780819461186.
- ↑ C. J. R. Sheppard, A. Choudhury. Image Formation in the Scanning Microscope // Optica Acta: International Journal of Optics. — 1977-10-01. — Т. 24, вып. 10. — С. 1051—1073. — ISSN 0030-3909. — doi:10.1080/713819421.
- ↑ 1 2 Shinya Inoué. Foundations of Confocal Scanned Imaging in Light Microscopy (англ.) // Handbook Of Biological Confocal Microscopy / James B. Pawley. — Springer US, 2006-01-01. — P. 1—19. — ISBN 9780387259215, 9780387455242. — doi:10.1007/978-0-387-45524-2_1.
- ↑ C. Cremer, T. Cremer. Considerations on a laser-scanning-microscope with high resolution and depth of field // Microscopica Acta. — 1978-09-01. — Т. 81, вып. 1. — С. 31—44. — ISSN 0044-376X.
- ↑ 1 2 W. B. Amos, J. G. White. How the confocal laser scanning microscope entered biological research // Biology of the Cell. — 2003-09-01. — Т. 95, вып. 6. — С. 335—342. — ISSN 0248-4900.
- ↑ Digital image processing of confocal images - ScienceDirect (англ.). www.sciencedirect.com. Дата обращения: 11 мая 2017.
- ↑ 1 2 J. G. White, W. B. Amos, M. Fordham. An evaluation of confocal versus conventional imaging of biological structures by fluorescence light microscopy // The Journal of Cell Biology. — 1987-07-01. — Т. 105, вып. 1. — С. 41—48. — ISSN 0021-9525.
- ↑ John White (англ.). royalsociety.org. Дата обращения: 11 мая 2017.
- ↑ Detection of ras oncoprotein in liver cells of flatfish (Dab) from a contaminated site in the North Sea - ScienceDirect (англ.). www.sciencedirect.com. Дата обращения: 11 мая 2017.
- ↑ Image Is Everything | The Scientist Magazine. The Scientist. Дата обращения: 11 мая 2017.
- ↑ Apparatus and method for particle analysis. Дата обращения: 11 мая 2017.
- ↑ Apparatus and method for particle analysis. Дата обращения: 11 мая 2017.
- ↑ Confocal Microscopes Widen Cell Biology Career Horizons | The Scientist Magazine. The Scientist. Дата обращения: 11 мая 2017.
- ↑ Espacenet - Bibliographic data (англ.). worldwide.espacenet.com. Дата обращения: 11 мая 2017.
- ↑ Marvin Minsky,. web.media.mit.edu. Дата обращения: 11 мая 2017.
- ↑ Olympus Microscopy Resource Center. olympus.magnet.fsu.edu. Дата обращения: 11 мая 2017.
- ↑ 1 2 James Pawley. Handbook of Biological Confocal Microscopy. — Springer Science & Business Media, 2006-06-02. — 1018 с. — ISBN 9780387259215.
- ↑ Stefan W. Hell. Far-Field Optical Nanoscopy (неопр.) // SCIENCE. — 2007. — Т. 316. — С. 1153—1158. — doi:10.1126/science.1137395.
- ↑ Kelly Rae Chi. Microscopy: Ever-increasing resolution (англ.) // Nature. — 2009-12-03. — Vol. 462, iss. 7273. — P. 675—678. — ISSN 0028-0836. — doi:10.1038/462675a.
- ↑ Mariella Vicinanza, Viktor I. Korolchuk, Avraham Ashkenazi, Claudia Puri, Fiona M. Menzies. PI(5)P Regulates Autophagosome Biogenesis (англ.) // Molecular Cell. — 2015-01-22. — Vol. 57, iss. 2. — P. 219—234. — ISSN 1097-2765. — doi:10.1016/j.molcel.2014.12.007.
- ↑ Laurens Liesenborghs, Marijke Peetermans, Jorien Claes, Tiago Rafael Veloso, Christophe Vandenbriele. Shear-Resistant Binding to von Willebrand Factor AllowsStaphylococcus lugdunensisto Adhere to the Cardiac Valves and Initiate Endocarditis (англ.) // Journal of Infectious Diseases. — 2016-04-01. — Vol. 213, iss. 7. — P. 1148—1156. — ISSN 0022-1899. — doi:10.1093/infdis/jiv773.
- ↑ Point spread function (англ.) // Wikipedia. — 2016-12-29.
- ↑ Hydrogen Peroxide and Cell Signaling. — Academic Press, 2013-06-19. — 343 с. — ISBN 9780124055421.
- ↑ Richard W. Cole, Tushare Jinadasa, Claire M. Brown. Measuring and interpreting point spread functions to determine confocal microscope resolution and ensure quality control (англ.) // Nature Protocols. — 2011-12-01. — Vol. 6, iss. 12. — P. 1929—1941. — ISSN 1754-2189. — doi:10.1038/nprot.2011.407.
- ↑ Gerald Burgstaller, Bettina Oehrle, Ina Koch, Michael Lindner, Oliver Eickelberg. Multiplex Profiling of Cellular Invasion in 3D Cell Culture Models (англ.) // PLOS One?!. — Public Library of Science, 2013-05-09. — Vol. 8, iss. 5. — P. e63121. — ISSN 1932-6203. — doi:10.1371/journal.pone.0063121.
- ↑ Josephine Walter, Silke Keiner, Otto W. Witte, Christoph Redecker. Age-related effects on hippocampal precursor cell subpopulations and neurogenesis // Neurobiology of Aging. — 2011-10-01. — Т. 32, вып. 10. — С. 1906—1914. — doi:10.1016/j.neurobiolaging.2009.11.011.
- ↑ SP Equipment " Лабораторное оборудование " Оптическая микроскопия Olympus " Mикpoскопы для медицины и биологии " Конфокальные микроскопы " Конфокальный микроскоп Оlympus FV300. Дата обращения: 2 октября 2009. Архивировано из оригинала 16 октября 2007 года.
- ↑ Gordon S. Kino, Timothy R. Corle. Confocal Scanning Optical Microscopy and Related Imaging Systems. — Academic Press, 1996-09-18. — 353 с. — ISBN 9780080529783.
- ↑ Patricia Sheehan, Mei Zhu, Anne Beskow, Cyndel Vollmer, Clarissa L. Waites. Activity-Dependent Degradation of Synaptic Vesicle Proteins Requires Rab35 and the ESCRT Pathway (англ.) // Journal of Neuroscience. — 2016-08-17. — Vol. 36, iss. 33. — P. 8668—8686. — ISSN 1529-2401 0270-6474, 1529-2401. — doi:10.1523/JNEUROSCI.0725-16.2016.
- ↑ Mo Zhou, Heidi Wiener, Wenjuan Su, Yong Zhou, Caroline Liot. VPS35 binds farnesylated N-Ras in the cytosol to regulate N-Ras trafficking (англ.) // J Cell Biol. — 2016-08-02. — P. jcb.201604061. — ISSN 1540-8140 0021-9525, 1540-8140. — doi:10.1083/jcb.201604061.
- ↑ Joseph Huff. The Airyscan detector from ZEISS: confocal imaging with improved signal-to-noise ratio and super-resolution (англ.) // Nature Methods. — 2015-12-01. — Vol. 12, iss. 12. — ISSN 1548-7091. — doi:10.1038/nmeth.f.388.
- ↑ Mayandi Sivaguru, Michael A. Urban, Glenn Fried, Cassandra J. Wesseln, Luke Mander. Comparative performance of airyscan and structured illumination superresolution microscopy in the study of the surface texture and 3D shape of pollen // Microscopy Research and Technique. — doi:10.1002/jemt.22732.
- ↑ SGB Furness, DL Hare, A Kourakis, AM Turnley, PJ Wookey. A novel ligand of calcitonin receptor reveals a potential new sensor that modulates programmed cell death // Cell Death Discovery. — 2016-10-10. — Т. 2. — С. 16062. — ISSN 2058-7716. — doi:10.1038/cddiscovery.2016.62.
- ↑ Patrick Robison, Matthew A. Caporizzo, Hossein Ahmadzadeh, Alexey I. Bogush, Christina Yingxian Chen. Detyrosinated microtubules buckle and bear load in contracting cardiomyocytes (англ.) // Science. — 2016-04-22. — Vol. 352, iss. 6284. — P. aaf0659. — ISSN 1095-9203 0036-8075, 1095-9203. — doi:10.1126/science.aaf0659.
- ↑ Enrique Sosa, Rachel Kim, Ernesto J. Rojas, Linzi Hosohama, Jon D. Hennebold. An integration-free, virus-free rhesus macaque induced pluripotent stem cell line (riPSC89) from embryonic fibroblasts // Stem Cell Research. — 2016-09-01. — Т. 17, вып. 2. — С. 444—447. — doi:10.1016/j.scr.2016.09.015.
- ↑ Joanne Bruno, Alexandria Brumfield, Natasha Chaudhary, David Iaea, Timothy E. McGraw. SEC16A is a RAB10 effector required for insulin-stimulated GLUT4 trafficking in adipocytes (англ.) // J Cell Biol. — 2016-06-21. — P. jcb.201509052. — ISSN 1540-8140 0021-9525, 1540-8140. — doi:10.1083/jcb.201509052.
- ↑ HoJun Jeon, JaeYoon Lee, Hyeongjin Lee, Geun Hyung Kim. Nanostructured surface of electrospun PCL/dECM fibres treated with oxygen plasma for tissue engineering (англ.) // RSC Advances. — 2016-03-31. — Vol. 6, iss. 39. — ISSN 2046-2069. — doi:10.1039/C6RA03840A.
- ↑ Emily Breeze, Natasha Dzimitrowicz, Verena Kriechbaumer, Rhiannon Brooks, Stanley W. Botchway. A C-terminal amphipathic helix is necessary for the in vivo tubule-shaping function of a plant reticulon (англ.) // Proceedings of the National Academy of Sciences. — National Academy of Sciences, 2016-09-27. — Vol. 113, iss. 39. — P. 10902—10907. — ISSN 1091-6490 0027-8424, 1091-6490. — doi:10.1073/pnas.1605434113.
- ↑ Felipe Mora-Bermúdez, Farhath Badsha, Sabina Kanton, J. Gray Camp, Benjamin Vernot. Differences and similarities between human and chimpanzee neural progenitors during cerebral cortex development (англ.) // eLife. — 2016-09-26. — Vol. 5. — P. e18683. — ISSN 2050-084X. — doi:10.7554/eLife.18683.
- ↑ Dipika V. Patel, Charles N. J. McGhee. Contemporary in vivo confocal microscopy of the living human cornea using white light and laser scanning techniques: a major review // Clinical & Experimental Ophthalmology. — 2007-01-01. — Т. 35, вып. 1. — С. 71—88. — ISSN 1442-6404. — doi:10.1111/j.1442-9071.2007.01423.x.
- ↑ A. Hoffman, M. Goetz, M. Vieth, P. Galle, M. Neurath. Confocal laser endomicroscopy: technical status and current indications (англ.) // Endoscopy. — Vol. 38, iss. 12. — P. 1275—1283. — doi:10.1055/s-2006-944813.
- ↑ Фотоника - научно-технический журнал - Фотоника - Визуализация химического картирования: конфокальная микроскопия комбинационного рассеяния. www.photonics.su. Дата обращения: 11 мая 2017.
- ↑ ROBERT BELLINGER, OLYMPUS SCIENTIFIC SOLUTIONS AMERICAS INC. Laser Confocal Microscopy: Challenging the Limits of Measuring Surface Roughness. Дата обращения: 11 мая 2017.
Ссылки
- Molecular Expressions: Laser Scanning Confocal Microscopy
- Nikon’s MicroscopyU. Comprehensive introduction to confocal microscopy.
- Emory’s Physics Department. Introduction to confocal microscopy and fluorescence.
- The Science Creative Quarterly’s overview of confocal microscopy — high res images also available.
- Programmable Array Microscope (недоступная ссылка) — Confocal Microscope Capabilities.
- OPTELICS HYBRID — многофункциональный световой конфокальный и лазерный конфокальный микроскоп .