Пентаэритриттетранитрат
| Пентаэритриттетранитрат | |
|---|---|
 | |
| Общие | |
| Сокращения | PETN |
| Традиционные названия | Тэн, тетранитропентаэритрит, пентаэритрита тетранитрат, пентрит, ниперит |
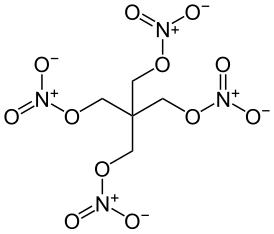
| Хим. формула | (CH2ONO2)4C |
| Рац. формула | C5H8N4O12 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 316,25[1] г/моль |
| Плотность | 1,773 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 141,3 °C |
| • кипения | 180 °C |
| • разложения | 150 °C |
| • вспышки | 215 °C |
| • самовоспламенения | 200[1] °C |
| Энтальпия | |
| • образования | -541,65[1] кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | не растворим |
| • в ацетоне (при 50 °C) | 58,76[1] |
| • в диметилформамиде (при 100 °C) | 70[1] |
| Классификация | |
| Рег. номер CAS | 78-11-5 |
| PubChem | 6518 |
| Рег. номер EINECS | 201-084-3 |
| SMILES | |
| InChI | |
| ChEBI | 25879 |
| ChemSpider | 6271 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Пентаэритриттетранитрат (пентаэритрита тетранитрат, тетранитропентаэритрит, тэн, пентрит, ниперит) — химическое соединение (CH2ONO2)4C. Мощное бризантное взрывчатое вещество. Чувствителен к удару. В чистом виде используется для снаряжения капсюлей-детонаторов, а во флегматизированном виде — для снаряжения кумулятивных припасов, детонирующего шнура. Химически стоек. Представляет собой белый порошок кристаллического вида.
Физико-химические свойства
Бесцветное кристаллическое вещество практически не растворимое в воде (0,01 г/100 г при 20 °С), трудно растворимое в спирте и эфире, но хорошо растворимое в ацетоне (24,8 г/100 г при 20 °С и 58,8 г/100 г при 50 °С) и диметилформамиде (70 г/100 г при 100 °С). Твердость по Моосу - 1,9.
Растворимость ТЭНа в различных растворителях:
| Растворитель | Температура | В 100 г растворителя |
|---|---|---|
| Этилацетат | 19 °С
50 °С |
6,322 г
17,868 г |
| Ацетон | 13 °С
50 °С |
25,632 г
57,960 г |
| Этанол (96 %) | 19 °С | 0,042 г |
| Этанол абс. | 21,5 °С | 0,129 г |
| Безводный эфир | 19 °С | 0,165 г |
| Толуол | 17,5 °С | 0,623 г |
| Диметилформамид | 100 °С | 70,0 г |
| Пиридин | 19 °С
50 °С |
5,436 г
8,567 г |
| Вода | 19 °С
50 °С 100 °С |
0,010 г
0,010 г 0,035 г |
Разлагается при продолжительном кипячении с водой, а также со слабыми кислотами и щелочами с образованием динитропентаэритрита. В свою очередь, в щелочной среде может быть использован как мягкий нитрующий агент, по эффективности эквивалентный тетранитрометану. Воспламеняется с трудом, в малых количествах сгорает спокойно с шипением, при горении плавится. При медленном разложении на проволочной сетке в пламени газовой горелки сильно взрывается. Плотность кристаллов - 1,77 г/см³ . Легко прессуется до плотности 1,6 г/см³.
Восприимчивость к нагреванию и внешним воздействиям
Тпл 141 °С с разложением; tвсп около 205 °С. При нагревании разлагается с сильным самоускорением, часто со взрывом. При плавлении переходит в густое бесцветное масло, при охлаждении которого закристаллизовывается снова. Чувствителен к электрической искре, способен наэлектризовываться, поэтому на производстве его рекомендовано покрывать антистатиками. Максимальная электростатическая энергия, при которой ТЭН ещё не детонирует, составляет около 0,2 Дж.
- Чувствительность к удару: Детонирует безотказно при грузе 2 кг и высоте падения 17 см. Нижний порог — 10 см. Для груза 2,5 кг при 50%-й вероятности детонации 13-16 см (тротил — 148 см, гексоген — 28 см, октоген — 32 см).
- Чувствительность к трению: 4,5 кгс (тротил — 29,5 кгс, гексоген — 11,5 кгс, октоген — 10 кгс).
- Восприимчивость к детонации: 0,17 г для гремучей ртути, 0,05 г ТА и 0,03 г для азида свинца. Детонирует от детонатора № 8 даже при 40%-м содержании воды (влажности).
Взрывчатые свойства
ТЭН — Мощное ВВ:
- Теплота взрыва: 5,76 МДж/кг (1300 ккал/кг при 0,9 г/см³, 1350 ккал/кг при 1,7 г/см³).
- Теплота образования: −125,0 ккал/моль.
- Энтальпия образования: −407,4 ккал/кг.
- Температура взрыва: 4200 Кельвинов (примерно 3926°С).
- Скорость детонации: 6110 м/с при плотности 1,17 г/см³, 7520 м/с при плотности 1,51 г/см³, 8350 м/с при плотн. 1,72 г/см³ и 8590 м/с при плотности 1,77 г/см³.
- Бризантность: 129—141 % от тротила (песочная проба), 130 % (PDT).
- Фугасность в Pb-блоке: 500 мл при песочной забивке и 560 мл при водной (Нитроглицерин: 550 и 590 соответственно).
- Работоспособность в баллистической мортире: 137—145 % от тротила.
- Объём продуктов взрыва: 768 л/кг, (по другим данным 790 л/кг).
- Метательная способность: по октогену 93,7 % (плотн. 1,738 г/см³, торцевое метание), для гексогена 97 % (1,76 г/см³).
- Критический диаметр: 1 мм при плотности 1,0 г/см³ (по другим данным - 1,5 мм), при повышении плотности — уменьшение критического диаметра.
Применение

Впервые был получен в Германии в 1894 г. Интерес как к мощному ВВ был проявлен после 1-й мировой войны, ограниченно производился в 20-е и 30-е годы XX века. Крупномасштабное промышленное производство началось незадолго до 2-й Мировой войны, когда ацетальдегид и формальдегид стали доступными и дешевыми. Больше всего производился в Германии. В СССР промышленно начал изготавливаться в 1940 г. К концу второй мировой войны и после начал вытесняться из смесей более стойким и безопасным гексогеном. Применялся для снаряжения капсюлей-детонаторов (вторичный заряд), промежуточных детонаторов, детонирующих шнуров, в боеприпасах в смесях и сплавах с флегматизаторами, пластификаторами (ПВВ), тротилом (пентолит), алюминием и т. п., а также в медицине. Однако ТЭН не теряет важности в тех случаях, когда необходимо обеспечить малый критический диаметр (промышленные и военные детонаторы, детонирующие шнуры, промышленные пластичные ВВ и др.). Компонент взрывчатых пенопластов, использующихся для взрывной сварки и штамповки.
Получение

Получают нитрованием пентаэритрита пятикратным количеством 93-99 % азотной кислоты, свободной от окислов азота. В лабораторной практике часто используют азотную кислоту с добавлением мочевины, способствующей обесцвечиванию кислоты. Нитрование проходит энергично, поэтому необходимо следить, чтобы температура не превысила 20°С, иначе образуется смесь малостабильных и чувствительных нитроэфиров, к тому же возможно развитие опасных самоускоряющихся процессов окисления. ТЭН находится частично в растворенном состоянии, смесь выливают в воду со льдом, кристаллы отфильтровывают, промывают водой, затем теплым 1%-м раствором гидрокарбоната натрия и перекристаллизовывают из ацетона с добавкой гидрокарбоната натрия или карбоната аммония. Выход обычно 90-96 %. ТЭН, как и все другие нитроэфиры, необходимо тщательнейшим образом очищать от кислот. Любые примеси кислоты приводят к медленному самопроизвольному разложению продукта в процессе хранения, которое может носить самоускоряющийся характер. При хранении в значительных количествах это может привести к вспышке или взрыву. При этом обычной содовой промывки недостаточно, так как следы кислоты находятся внутри кристаллов, и необходима перекристаллизация из ацетона с добавкой карбоната натрия либо аммония. Производство ТЭНа в промышленности опасно, некристаллизованный продукт термически неустойчив, так как содержит некоторое количество кислоты, не поддающейся нейтрализации при содовой промывке. Однако некоторые сорта ТЭНа, предназначенного для изготовления детонационных шнуров, вместо перекристаллизации измельчают в присутствии воды и добавляют мел. Это позволяет удалить большую часть внутрикристаллической кислоты и обеспечить более низкую стоимость продукта из-за отсутствия операции перекристаллизации.
До 2-й Мировой войны ТЭН также получали по двухстадийному методу: на первой стадии к 90-95 % серной кислоте (бóльшая концентрация вызывает обугливание) добавляют пентаэритрит. На второй стадии добавляют концентрированную азотную кислоту и нитруют при 60°С образовавшиеся сульфоэфиры пентаэритрита. Этот способ в целом более безопасен, чем нитрование одной азотной кислотой, однако требует вдвое большего расхода кислот и специальной очистки ТЭНа от смешанных cульфоэфиров (кипячение в автоклаве в течение часа), поэтому по экономическим соображениям в настоящее время не используется.
ТЭН можно получать нитрованием серно-азотными нитросмесями в одну стадию при 10°С. При этом побочно образуются примеси сульфоэфиров, и необходимо продолжительное кипячение в 1%-м содовом растворе. Этот метод также не нашел широкого применения в промышленности.
Медицинское применение
Подобно нитроглицерину и другим органическим нитратам, применяется в качестве вазодилаторного средства[2][3].
Примечания
- ↑ 1 2 3 4 5 [www.xumuk.ru/spravochnik/721.html XuMuK.ru - Пентаэритриттетранитрат. Мини-справочник по химическим веществам (3340 веществ)]
- ↑ New Drugs (англ.) // CMAJ. — 1959. — Vol. 80, no. 12. — P. 997—998. — PMID 20325960.
- ↑ Пентаэритритила тетранитрат (Pentaerithrityl tetranitrate): инструкция, применение и формула. Дата обращения: 30 января 2014. Архивировано 2 февраля 2014 года.
Ссылки
- https://exploders.info/sprawka/88.html Архивная копия от 16 октября 2016 на Wayback Machine
- http://pirochem.net/index.php?id1=3&category=azgotov-prim-vv&author=shtetbaher-a&book=1936 Архивная копия от 12 июля 2017 на Wayback Machine
- https://exploders.info/books/14.html Архивная копия от 31 июля 2016 на Wayback Machine
- http://pirochem.net/index.php?id1=3&category=chemvvisost&author=hmelnickiy-li&book=19622 Архивная копия от 12 июля 2017 на Wayback Machine
- http://chemistry-chemists.com/N2_2013/P1/pirosprawka2012.pdf Архивная копия от 12 июля 2017 на Wayback Machine
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист |