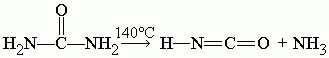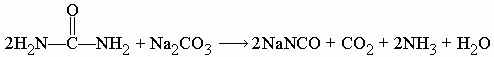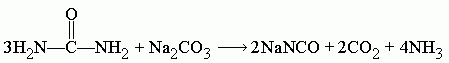Цианат натрия
| Цианат натрия | |
|---|---|
| | |
| Общие | |
| Хим. формула | NaOCN |
| Физические свойства | |
| Состояние | кристаллический |
| Молярная масса | 65,01[1] г/моль |
| Плотность | 1,893 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 550 °C |
| • разложения | 600 °C |
| Энтальпия | |
| • образования | -400 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 11,6 г/100 мл |
| Классификация | |
| Рег. номер CAS | 917-61-3 |
| PubChem | 517096 |
| Рег. номер EINECS | 213-030-6 |
| SMILES | |
| InChI | |
| ChEBI | 38906 |
| ChemSpider | 12922 |
| Безопасность | |
| ЛД50 | (крысы, перорально) 1500[источник не указан 4243 дня] |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Цианат натрия (натрий циановоки́слый) — неорганическое бинарное соединение, натриевая соль циановой кислоты с формулой NaNCO. Нелетуч, не имеет запаха. Представляет собой бесцветные кристаллы тригональной сингонии плотностью 1,893 г/см3. Температура плавления цианата натрия 550 °C, выше 700 °C разлагается. Хорошо растворим в воде — 11,6 г/100г при 25 °C.
Цианат натрия часто применяется в органическом синтезе.
Получение
Цианат натрия можно синтезировать несколькими способами, один из них заключается в сплавлении карбамида с карбонатом натрия. Этот метод наиболее простой и дешёвый.
При 140 °C мочевина разлагается на циановую кислоту и аммиак:
Далее циановая кислота реагирует с оставшейся частью мочевины, образуя биурет:
При сплавлении мочевины с карбонатом натрия Na2CO3 образуется цианат натрия NaNCO, углекислый газ CO2, аммиак NH3 и вода H2O:
Поскольку цианат натрия гидролизуется в присутствии H2O, которая образуется в ходе реакции, то следует добавить избыточное количество мочевины, при этом циановая кислота, которая образуется в ходе разложения мочевины, реагирует с водой, образуя CO2 и NH3.
Поэтому, если необходимо исключить воду из продуктов реакции и тем самым повысить выход конечного цианата, то расчёт пропорции следует проводить по следующему уравнению:
На этом и основан один из методов синтеза цианата натрия.
Возможен другой механизм синтеза, но приводящий к тому же конечному уравнению: пиролиз мочевины с образованием циануровой кислоты и аммиака, инверсия циануровой кислоты в её изомер - тример циановой кислоты с последующей деполимеризацией, и затем взаимодействие циановой кислоты с карбонатом натрия.
Физические свойства
Цианат натрия умеренно растворим в воде (10,4 % по массе при 25 °C), плохо растворим в этаноле (0,5 % при 78,4 °C), бензоле и жидком аммиаке, не растворим в диэтиловом эфире.
Химические свойства
В присутствии железа или никеля при 500-600 °C частично разлагается до цианида натрия, карбоната натрия, монооксида углерода и молекулярного азота[2]:
- .
Как и все цианаты щелочных металлов (и аммония), цианат натрия во влажном воздухе и в водных растворах постепенно гидролизуется до карбоната натрия, диоксида углерода и аммиака:
- .
При действии на цианат натрия растворов сильных кислот, он разлагается, например:
- .
Восстанавливается монооксидом углерода до цианида натрия:
- ,
и углеродом:
- .
С минеральными кислотами образует циановую кислоту HNCO и её тример — циануровую кислоту (HNCO)3.
Применение
В основном цианат натрия используется в органическом синтезе. Из него синтезируют органические изоцианаты.
Токсикология
Цианаты гораздо менее токсичны цианидов, что используется для дегазации последних. Так, например, для человека смертельная доза NaNCO составляет около 13 граммов.
В России класс опасности III, ПДК в воздухе рабочей зоны 1 мг/м³ (по цианат-анионам), ирритант (1998).
Примечания
- ↑ Sicherheitsdatenblatt Merck
- ↑ [www.xumuk.ru/encyklopedia/2/5150.html Цианаты неорганические — ХиМик.Ру]
Литература
- Химический энциклопедический словарь / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1983. — 792 с.
Этот раздел содержит материал неэнциклопедичного характера. |
В статье не хватает ссылок на источники (см. рекомендации по поиску). |
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист |