Рак желудка
| Рак желудка | |
|---|---|
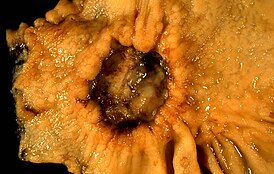 Язвенное образование желудка, по данным биопсии — аденокарцинома | |
| МКБ-11 | 2B72 |
| МКБ-10 | C16 |
| МКБ-10-КМ | C16.5, C16.6, C16.2, C16.9 и C16 |
| МКБ-9 | 151 |
| МКБ-9-КМ | 151[1], 151.6[1], 151.5[1], 151.9[1] и 151.4[1] |
| OMIM | 137215 |
| DiseasesDB | 12445 |
| MedlinePlus | 000223 |
| eMedicine | med/845 |
| MeSH | D013274 |
Рак желудка — злокачественная опухоль, происходящая из эпителия слизистой оболочки желудка.
Рак желудка является одним из наиболее распространённых онкологических заболеваний. Может развиваться в любом отделе желудка и распространяться на другие органы, особенно пищевод, лёгкие и печень. От рака желудка в мире ежегодно погибает до 800 000 человек (данные на 2008 год)[2].
Эпидемиология
Рак желудка занимает в мире четвёртое место среди злокачественных образований, в 2002 году диагностировано 930 000 случаев заболевания[3]. Это заболевание имеет высокий показатель смертности (более 700 000 в год), что делает его вторым в структуре онкологической смертности после рака лёгкого. По статистике, выздоравливают всего лишь 29% пациентов.Чаще рак желудка возникает у мужчин[3].
В России рак желудка стабильно занимает второе место в структуре онкологических заболеваний (15,8 % у мужчин и 12,4 % у женщин)[4], заболевание широко распространено в Корее, Японии, Великобритании, Южной Америке и Исландии. В Корее рак желудка занимает первое место в структуре онкологической заболеваемости (20,8 %) и второе место по смертности.
Метастазы возникают у 80—90 % больных раком желудка, шестимесячная выживаемость составляет 65 % в случае ранней диагностики заболевания и менее 15 % на поздних стадиях процесса. В среднем самая высокая выживаемость при раке желудка отмечается в Японии — 53 %, в других странах она не превышает 15—20 %[5].
В одном случае из пятидесяти у пациентов, обращающихся с жалобами на диспепсию, выявляется рак желудка[6].
Этиология
Среди факторов, способствующих развитию рака желудка, называются особенности диеты и факторы окружающей среды, курение, инфекционный и генетический факторы[5].
Доказана зависимость частоты возникновения рака желудка от недостатка употребления аскорбиновой кислоты, избыточного употребления соли, маринованных, пережаренных, копчёных продуктов, острой пищи, животного масла. Среди причин рака желудка называется злоупотребление алкоголем, особенно водкой[7]. Отмечается прямая корреляционная связь частоты возникновения рака желудка с содержанием в почве меди, молибдена, кобальта и обратная — цинка и марганца[5].
Важным фактором развития рака желудка является дуоденогастральный рефлюкс, приводящий к хроническому рефлюкс-гастриту. Так, риск рака желудка увеличивается через 5—10 лет после операций на желудке, особенно после резекции по Бильрот II в модификации Гофмейстера-Финстерера, способствующих развитию рефлюкса.
Рак желудка и Helicobacter pylori
Имеются убедительные данные о зависимости рака желудка от инфицированности бактерией Helicobacter pylori[8]. Считается статистически доказанным, что у инфицированных этой бактерией риск развития рака желудка существенно повышен (относительный коэффициент 2,5). В 1994 г. Международным агентством по изучению рака (IACR) ВОЗ H. Pylori отнесена к канцерогенам 1-й группы. Эта бактерия вызывает гистологические изменения, приводящие к развитию рака — атрофию слизистой оболочки, кишечную метаплазию и дисплазию эпителия. Большинству случаев рака желудка предшествует длительный предраковый процесс, включающий в себя цепь событий: хронический гастрит — мультифокальная атрофия — кишечная метаплазия — интраэпителиальная неоплазия (подробнее см. в статье Helicobacter pylori).
Helicobacter pylori — наиболее постоянный фактор риска рака желудка. Доказано, что инфекция Helicobacter pylori является самым распространённым фактором риска рака некардиального отдела желудка у человека[9]. В то же время, кардиальной (проксимальный) рак желудка с инфекцией H. pylori не связан[10].
Эрадикация Helicobacter pylori может препятствовать развитию рака желудка, однако после определённого момента в процессе перехода хронического гастрита в аденокарциному, эрадикация H. pylori перестаёт быть фактором, способным предотвратить развитие рака желудка[11]. После того, как кишечная метаплазия уже развилась, эрадикация не предотвращает развитие рака желудка, хотя и способна затормозить её прогрессирование[9].
Риск рака желудка зависит от факторов вирулентности бактерий и от генетических факторов пациента, однако рекомендации в отношении конкретных маркеров вирулентности или маркеров для генетических исследований для применения в клинической практике в настоящее время отсутствуют[9].
Вместе с тем, имеются сведения, противоречащие инфекционной теории — так, в эндемичных по Helicobacter pylori районах северной Нигерии рак желудка развивается редко. Также обращает на себя внимание разница в частоте возникновения рака желудка у мужчин и женщин при равной инфицированности хеликобактером среди обоих полов[5]. Учёные, оспаривающие большую роль H.pylori в развитии рака желудка, утверждают, что участие H.pylori в развитии рака желудка не обязательно, что в его патогенезе важную роль играют и другие факторы, а также наследственная отягощённость. Они подчёркивают, что слизистую оболочку желудка колонизируют и другие микроорганизмы, в частности стрептококки, стафилококки, микрококки, грибы Candida и другие, обладающие адгезивностью, вирулентностью и, в отличие от H.pylori, инвазивностью. Некоторые из этих микроорганизмов, по их мнению, также могут играть определённую роль в развитии рака желудка, не менее существенную, чем H.pylori[10].
Также к числу предрасполагающих факторов заболеванию рака желудка можно отнести: атрофический гастрит, аденоматозные полипы в желудке и пернициозную анемию. Немаловажное влияние имеют наследственность и вредные привычки (курение, алкоголизм и тд).
Симптомы
Рак желудка на ранних стадиях, как правило, имеет невыраженные клинические проявления и неспецифические симптомы (диспепсия, снижение аппетита). Другие симптомы рака желудка (так называемый синдром «малых признаков») — астения, отвращение к мясной пище, анемия, потеря веса, «желудочный дискомфорт» чаще наблюдаются при распространённых формах процесса. Раннее насыщение, чувство переполнения желудка после принятия малого количества пищи наиболее характерно для эндофитного рака, при котором желудок становится ригидным, не растяжимым пищей.[5]. Для рака кардии характерна дисфагия; рак пилорического отдела может нарушать эвакуацию содержимого желудка, приводя к рвоте.
На поздних стадиях присоединяются боли в эпигастрии, рвота, кровотечения при изъязвлении и распаде опухоли (изменение кала — мелена, рвота «кофейной гущей» или кровью). Характер болей может свидетельствовать о прорастании в соседние органы: опоясывающие боли характерны для прорастания опухоли в поджелудочную железу, схожие со стенокардией — при прорастании опухоли в диафрагму, вздутие живота, урчание в животе, задержка стула — при прорастании в поперечную ободочную кишку.
Макроскопическая картина
Наиболее часто применяемой классификацией рака желудка по макроскопической форме роста является классификация по Bormann (1926):
- Полипоидный рак — солитарная опухоль вдается в просвет желудка, хорошо отграничена от здоровых тканей, не имеет изъязвления. Встречается в 5 % случаев рака желудка. Прогноз относительно благоприятный.
- Изъязвлённая карцинома, или «Рак-язва» — изъязвлённый рак с блюдцеобразно приподнятыми и чётко очерченными краями. Визуально малоотличима от язвы желудка, для достоверной дифференциальной диагностики необходимо гистологическое исследование, желательно из нескольких участков язвы. Отличается относительно доброкачественным течением, составляет 35 % случаев.
- Частично изъязвлённая карцинома с приподнятыми краями и частичным инфильтративным прорастанием глубоких слоев желудка, без четкого отграничения от здоровых тканей. Отличается ранним метастазированием.
- Диффузно-инфильтративный рак (скирр) — растет эндофитно, инфильтрируя подслизистый слой, захватывает значительный участок желудка. Макроскопически плохо распознается при гастроскопии. Диффузное прорастание стенки желудка часто приводит к нарушению его моторики и возникновению соответствующих диспепсических жалоб.
Последние две формы рака протекают особенно агрессивно, очень рано дают метастазы и имеют чрезвычайно плохой прогноз.
Гистологические типы

- Классификация ВОЗ
- Аденокарцинома (железистый рак):
- Папиллярная;
- Тубулярная;
- Муцинозная;
- Аденокарцинома (железистый рак):
Каждый тип разделяется по степени дифференцировки на высоко-, умеренно- и низкодифференцированную аденокарциному.
- Перстневидноклеточный рак;
- Железисто-плоскоклеточный рак;
- Плоскоклеточный рак;
- Мелкоклеточный рак и
- Недифференцированный рак.
- Классификация по Лаурену:
- Кишечный тип;
- Диффузный тип.
Локализация опухоли
- Антральный и пилорический отделы — 60-70 % случаев;
- Малая кривизна тела желудка — 10-15 %;
- Кардия — 8-10 %;
- Передняя и задняя стенки тела желудка — 2-5 %.
Классификация по системе TNM
T — первичная опухоль
- Tx — первичная опухоль не может быть оценена;
- T0 — отсутствие данных о первичной опухоли;
- Tis — carcinoma in situ, интраэпителиальная опухоль без инвазии в собственную пластинку слизистой оболочки, тяжёлая дисплазия;
- T1 — опухоль прорастает в собственную пластинку слизистой оболочки, мышечную пластинку слизистой оболочки или подслизистую основу:
- T1a — опухоль прорастает в собственную пластинку слизистой оболочки или мышечную пластинку слизистой оболочки;
- T1b — опухоль прорастает в подслизистую основу;
- T2 — опухоль прорастает в мышечную оболочку;
- T3 — опухоль прорастает в подсерозную основу;
- T4 — опухоль прорастает в серозную оболочку и распространяется на соседние структуры:
- T4a — опухоль прорастает в серозную оболочку;
- T4b — опухоль врастает в соседние структуры.
Примечания:
(1) Соседними структурами для желудка являются селезёнка, поперечная ободочная кишка, печень, диафрагма, поджелудочная железа, брюшная стенка, надпочечники, почки, тонкая кишка, забрюшинное пространство.
(2) Интрамуральное (внутрипросветное) распространение на двенадцатиперстную кишку или пищевод классифицируют по глубине наибольшей инвазии в любой из органов, включая желудок.
(3) Опухоль, которая распространяется на желудочно-ободочную или желудочно-печёночную связку, большой или малый сальник, но не прорастает в висцеральную брюшину, классифицируют как T3.
N — регионарные лимфатические узлы
- Nx — регионарные лимфатические узлы не могут быть оценены;
- N0 — нет метастазов в регионарных лимфатических узлах;
- N1 — метастазы в 1-2 регионарных лимфатических узлах;
- N2 — метастазы в 3-6 регионарных лимфатических узлах;
- N3 — метастазы в 7 и более регионарных лимфатических узлах:
- N3a — метастазы в 7-15 регионарных лимфатических узлах;
- N3b — метастазы в 16 и более регионарных лимфатических узлах.
M — отдалённые метастазы
- M0 — нет отдалённых метастазов;
- M1 — есть отдалённые метастазы.
Примечание:
Отдалённые метастазы включают диссеминацию по брюшине, положительную цитологию перитонеальной жидкости и элементы опухоли в сальнике, не являющиеся частью непрерывного распространения.
Стадии
| стадия | критерий T | критерий N | критерий M |
|---|---|---|---|
| Стадия 0 | Tis | N0 | М0 |
| Стадия IA | T1 | N0 | М0 |
| Стадия IB | T2 | N0 | М0 |
| T1 | N1 | M0 | |
| Стадия IIA | T3 | N0 | М0 |
| T2 | N1 | M0 | |
| T1 | N2 | M0 | |
| Стадия IIB | T4a | N0 | М0 |
| T3 | N1 | M0 | |
| T2 | N2 | M0 | |
| T1 | N3 | M0 | |
| Стадия IIIA | T4a | N1 | М0 |
| T3 | N2 | M0 | |
| T2 | N3 | M0 | |
| Стадия IIIB | T4b | N0, N1 | М0 |
| T4a | N2 | M0 | |
| T3 | N3 | M0 | |
| Стадия IIIC | T4a | N3 | М0 |
| T4b | N2, N3 | M0 | |
| Стадия IV | Любая T | Любая N | M1 |
Метастазирование
Имплантационное метастазирование
Для рака желудка характерны метастазы в виде канцероматоза плевры, перикарда, диафрагмы, брюшины, сальника.
Лимфогенное метастазирование
Метастазы рака желудка обнаруживаются в регионарных лимфатических узлах: по ходу левой и правой желудочных артерий, правой и левой желудочно-сальниковых, селезеночной — регионарных узлах первого этапа лимфооттока; чревных узлах (второго этапа лимфооттока); парааортальных, паракавальных и других.
Выделяют специфические формы лимфогенного метастазирования:
- Метастазы Вирхова («Вирховские узлы») — поражение лимфатических узлов левой надключичной области, между ножками грудино-ключично-сосцевидной мышцы;
- Метастазы Шницлера — в параректальные лимфоузлы (в семье его называли Шиндлер);
- Метастазы Айриша — в подмышечные лимфоузлы;
- Метастаз сестры Марии Джозеф — в пупок по ходу круглой связки печени;
- Метастазы Крукенберга — в яичники.
Первые два вида можно выявить пальпаторно и при УЗИ; для подтверждения используется пункционная биопсия. Рак Крукенберга выявляется при УЗИ и лапароскопии, может быть произведена лапароскопическая УЗИ и пункция[12].
Указанные виды метастазов свидетельствуют о поздней стадии рака, когда резектабельность опухоли сомнительна.
Гематогенное метастазирование
Наиболее часто происходит метастазирование в печень, по ходу воротной вены; при этом печень становится бугристой, развивается портальная гипертензия, печеночно-клеточная недостаточность. Возможны метастазы в лёгкие и другие органы (почки, кости, головной мозг, реже в надпочечники и поджелудочную железу).
Диагностика
Методами диагностики рака желудка являются:
- гастроскопия — диагностический метод выбора (благодаря возможности не только визуализировать изменённые участки слизистой желудка, но и осуществлять биопсию ткани для последующей оценки);
- рентгеноскопия желудка с пероральным введением контрастного препарата (сульфат бария). Один из основных методов определения локализации и протяжённости поражения стенки желудка. Наиболее важными рентгенологическими признаками рака желудка являются:
- наличие дефекта наполнения или ниши в пределах тени желудка
- потеря эластичности и растяжимости желудочной стенки
- локальное отсутствие или уменьшение перистальтики в районе опухоли
- изменение рельефа слизистой оболочки в месте расположения опухоли
- изменение формы и размеров желудка;
- ультразвуковое исследование — УЗИ органов брюшной полости, забрюшинного пространства и лимфатических коллекторов шейно-надключичной области — обязательный метод обследования больных раком желудка, применяемый для выявления метастазов.
- компьютерная томография позволяет выявить рак желудка, однако основной целью исследования является оценка распространённости злокачественного процесса, наличия метастазов, в том числе и позитронно-эмиссионная томография с помощью которой можно проследить изменения в биохимических процессах в раковых тканях, которые отличаются от таковых в нормальных;
- лапароскопия не столько помогает в диагностике рака (что возможно лишь в поздних стадиях), сколько используется для определения стадии заболевания и выявления мелких субкапсулярных метастазов в печени и на париетальной брюшине, не видимых при УЗИ и КТ. Тем самым лапароскопия сводит до минимума число эксплоративных лапаротомий;
- онкомаркеры высокоспецифичны (95 %), но малочувствительны. Наиболее распространённые онкомаркеры СА72.4, РЭА и СА19.9 по чувствительности варьируют в 40-50 % случаев и повышаются при метастазах на 10-20 %;
Дифференциальная диагностика
Следует проводить с гастритом, язвенной болезнью, доброкачественными опухолями (полипами, лейомиомой, фибромой), другими злокачественными опухолями — MALT-лимфомой, саркомами (лейомиосаркома, фибросаркома), гастроинтестинальной стромальной опухолью (GIST) желудка. Клиническая картина начальных излечимых стадий рака желудка мало отличается от проявлений большинства заболеваний системы пищеварения, поэтому первостепенное значение в дифференциальной диагностике принадлежит эндоскопии с гистологическим исследованием биоптата из стенки желудка.
Лечение
В настоящее время основной и практически единственный метод радикального лечения рака желудка — хирургическая операция. Резекция желудка также обеспечивает и лучшее паллиативное лечение: устраняется причина болей, дисфагии и кровотечений, уменьшается количество опухолевых клеток в организме, что способствует увеличению продолжительности жизни и значительному облегчению состояния больного. Лучевое воздействие и химиотерапия имеют вспомогательное значение.
Обычно удаляется весь желудок (гастрэктомия). Показанием к ней служит расположение опухоли выше угла желудка, субтотальном или тотальном поражении желудка.
Реже производится (на ранних стадиях болезни) его резекция (как правило, субтотальная): при раке антрального отдела — дистальная, при раке кардиального и субкардиального отделов I—II стадий — проксимальная. Помимо этого производится удаление большого и малого сальника, регионарных лимфатических узлов; при необходимости частично или полностью удаляются другие органы: яичники при метастазах Крукенберга, хвост поджелудочной железы, селезёнка, левая доля или сегмент печени, поперечная ободочная кишка, левая почка и надпочечник, участок диафрагмы и т. д.
При раке желудка показано удаление лимфатических узлов. По объёму различают следующие виды лимфодиссекции:
- D0 — лимфоузлы не удаляются;
- D1 — резекция узлов, расположенных вдоль малой и большой кривизны, супра- и инфрапилорических, малого и большого сальников;
- D2 — удаление вышеуказанных узлов и узлов второго уровня;
- D3 — то же + резекция лимфоузлов по ходу чревного ствола;
- D4 — включает удаление тех же узлов, что при D3, с удалением парааортальных узлов;
- Dn — резекция всех регионарных лимфатических узлов, удаление поражённых опухолью желудка органов.
Радикальность операции обеспечивают варианты D2-D4.
Диспансеризация
Для ранней диагностики рака большое значение имеет диспансеризация лиц, имеющих повышенный риск развития этого заболевания. В группу наблюдения должны быть включены больные старше 40 лет, имеющие следующие заболевания:
- язвенная болезнь желудка
- полипы желудка
- неэпителиальные опухоли желудка
- хронический атрофический гастрит с кишечной метаплазией
- больные, перенёсшие резекцию желудка
За этими пациентами необходимо вести активное наблюдение с ежегодным эндоскопическим и рентгенологическим контролем и исследованием кала на скрытую кровь каждые 6 месяцев.
Прогноз и выживаемость
Как и при многих других видах рака, исход и эффективность лечения рака желудка в настоящее время зависит от стадии заболевания[13].
В большинстве случаев рак желудка выявляется только на поздних стадиях и является уже распространённым, в этом случае общая 5-летняя выживаемость составляет лишь 15 %. Если человек прожил первые 5 лет, то дальнейшая выживаемость повышается — 10-летняя выживаемость составляет 11 %, что лишь на 4 % ниже 5-летней выживаемости.
Для лиц молодого возраста показатели выживаемости выше, чем у пожилых людей. У пациентов младше 50 лет пятилетняя выживаемость составляет 16-22 %, в то время как среди пациентов старше 70 лет этот показатель равен 5-12 %.
Первая стадия
У пациентов с раком желудка I стадии высок шанс на полное выздоровление. Пятилетняя выживаемость составляет 80 %, из них 70 % полностью выздоравливают. На I стадии рак желудка выявляется очень редко и, как правило, случайно.
Вторая стадия
У пациентов с раком желудка II стадии пятилетняя выживаемость составляет 56 %, из них 48-50 % полностью выздоравливают. На момент диагностики только шесть случаев рака из ста (6 %) имеют вторую стадию.
Третья стадия
У пациентов с раком желудка III стадии пятилетняя выживаемость составляет 38 %, из них около 26 % полностью выздоравливают. У пациентов с раком желудка стадии III b (метастазы) пятилетняя выживаемость составляет лишь 15 %, из них выздоравливают лишь 10 %. На III стадии выявление рака желудка встречается довольно часто.
Четвёртая стадия
У пациентов с раком желудка IV стадии пятилетняя выживаемость обычно не превышает 5 %, а 10-летняя выживаемость составляет 2,3 %. Из них только 1,4 % полностью выздоравливают. На IV стадии выявление рака желудка происходит у 80 % пациентов и является самым распространённым.
Примечания
- ↑ 1 2 3 4 5 Disease Ontology (англ.) — 2016.
- ↑ Cancer. World Health Organization (февраль 2011). Дата обращения: 15 сентября 2011. Архивировано 31 марта 2012 года. (англ.)
- ↑ 1 2 Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin 2005;55:74-108 (англ.)
- ↑ М. И. Давыдов, М. Д. Тер-Ованесов, И. С. Стилиди — Хирургическое лечение рака проксимального отдела желудка: эволюция стандартов
- ↑ 1 2 3 4 5 В. Ю. Сельчук, М. П. Никулин — Рак желудка
- ↑ Stomach cancer symptoms : Cancer Research UK : CancerHelp UK
- ↑ Модифицируемые факторы риска развития рака. // Факторы риска развития рака. Пер. с англ. Н. Д. Фирсова (2017).
- ↑ Hatakeyama M., Higashi H. . Helicobacter pylori CagA: a new paradigm for bacterial carcinogenesis // Cancer Science, 2005, 96 (12). — P. 835—843. — doi:10.1111/j.1349-7006.2005.00130.x. — PMID 16367902.
- ↑ 1 2 3 Исаков В. А. Диагностика и лечение инфекции, вызванной Helicobacter pylori: IV Маастрихтское соглашение / Новые рекомендации по диагностике и лечению инфекции H.Pylori — Маастрихт IV (Флоренция). Best Clinical Practice. Русское издание. 2012. Вып.2. С.4-23.
- ↑ 1 2 Циммерман Я.С. Проблема растущей резистентности микроорганизмов к антибактериальной терапии и перспективы эрадикации Helicobacter pylori-инфекции / В кн.: Нерешённые и спорные проблемы современной гастроэнтерологии. – М.: МЕДпресс-информ, 2013. С.147-166. ISBN 978-5-98322-942-6.
- ↑ Malfertheiner P., Megraud F., O’Morain C.A., et al. Диагностика и лечение инфекции Helicobacter pylori — отчёт согласительной конференции Маастрихт IV / Флоренция // Вестник практического врача. Спецвыпуск 1. 2012. С. 6-22.
- ↑ http://www.rosoncoweb.ru/journals/practical_oncology/arh007/02.pdf
- ↑ Прогноз и выживаемость при раке желудка на различных стадиях
Литература
- Стойко Ю. М., Вербицкий В. Г., Карачун А. М. Рак желудка: Учебное пособие. — СПб.: ВМедА, 2002. — 26 с.
- В. С. Савельев, Н. А. Кузнецов. Хирургические болезни. Том 1. М., 2006.
- М. И. Кузин, Н. М. Кузин, О. С. Шкроб и др.; под редакцией М. И. Кузина. Хирургические болезни. М.: Медицина, 2002. — 784 с.: ил. — ISBN 5-225-00920-4
- Хирургические болезни: учебник / под редакцией А. Ф. Черноусова. М.: ГЭОТАР-МЕДИА, 2010. — 664 с.: ил. + CD — ISBN 978-5-9704-1278-7
- С. С. Харнас, В. В. Левкин, Г. Х. Мусаев. Рак желудка: клиника, диагностика, лечение. М., 2006.
- Курс лекций по патологической анатомии. Частный курс. Часть II, книги 1,2. / Под ред. академика РАН и РАМН, профессора М. А. Пальцева. — М.: ООО "Издательский дом «Русский врач», 2003. — 210 с.
- TNM: Классификация злокачественных опухолей. / Под ред. Л.Х. Собинина и др.; пер. с англ. и науч. ред. А.И. Щёголева, Е.А. Дубовой, К.А. Павлова. — М.: Логосфера, 2011. — 276 с. — Перевод изд. TNM Classification of Malignant Tumours, 7th ed. — ISBN 978-5-98657-025-9.