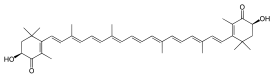
Астаксантин
| Астаксантин | |
|---|---|
   | |
| Общие | |
| Систематическое наименование |
(6S)-6-гидрокси-3-[(1E,3E,5E,7E,9E,11E,13E,15E,17E)-18-[(4S)-4-гидрокси-2,6,6-триметил-3-оксо-1-циклогексенил]-3,7,12,16-тетраметилоктадека-1,3,5,7,9,11,13,15,17-нонаенил]-2,4,4-триметил-1-циклогекса-2-енон |
| Хим. формула | C40H52O4 |
| Физические свойства | |
| Молярная масса | 596.84 г/моль |
| Классификация | |
| Рег. номер CAS | 472-61-7 |
| PubChem | 5281224 |
| Рег. номер EINECS | 207-451-4 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E161j |
| ChEBI | 40968 |
| ChemSpider | 4444636 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Астаксантин (лат. Astaxanthin) — каротиноид, имеющий по сравнению с бета-каротином два дополнительных атома кислорода на каждом из шестичленных колец. Астаксантин относится к ксантофиллам (от греч. ξανθός, «жёлтый», и φύλλον, «лист», поскольку пигмент этой группы, представитель семейства каротиноидов, был выделен из жёлтых листьев жёлтых растений). Наличие хромофорных групп (сопряжённых двойных связей и хиноидных группировок в кольцах) придаёт астаксантину насыщенный красный цвет.
Нахождение в природе
Впервые астаксантин был выделен из омаров в 1938 году[1]. Астаксантин присутствует в большинстве водных организмов, имеющих красную окраску, и был обнаружен в тканях различных рыб, креветок, птиц и растений. Красный цвет мяса лососёвых рыб обусловлен именно наличием в нём астаксантина. Содержание варьируется как между видами, так и между особями, поскольку оно сильно зависит от рациона питания и условий жизни. Астаксантин и другие химически родственные аста-каротиноиды также были обнаружены у ряда видов лишайников в арктической зоне[2].
Характерная окраска перьев фламинго, а также сетчатки перепелов обусловлена присутствием астаксантина[3].
Явление, известное как красный снег, также объясняется размножением водорослей, содержащих астаксантин.
Организм человека вырабатывать астаксантин не может[4][5].
Источники астаксантина


Основными природными источниками астаксантина являются следующие:
| Источник | Содержание астаксантина |
|---|---|
| Лососевые: | мг/кг |
| Нерка | 38[6] |
| Радужная форель | 25[6] |
| Кижуч | 20[6] |
| Кета, арктический голец | менее 10[6] |
| Планктон | ~ 60 ppm |
| Криль (Euphausia pacifica (тихоокеанский криль), Euphausia superba (антарктический криль)) | ~ 120 ppm |
| Северная креветка (Pandalus borealis) | ~ 1200 ppm |
| % на сухое вещество | |
| Tremellomycetes (Xanthophyllomyces dendrorhous) | 0,5 |
| Labyrinthulomycetes (Thraustochytrium sp.) | 0,2 |
| Зелёные водоросли (Chlorophyta): | |
| Haematococcus pluvialis | 3,8[7][8] |
| Neochloris wimmeri | 0,6[9] |
| Chlorococcum | 0,2[10][11] |
Водоросль Haematococcus pluvialis является важнейшим источником астаксантина для промышленного получения. При нормальных условиях она имеет зелёную окраску, но при уменьшении количества пищи переходит в состояние покоя, и для защиты от ультрафиолета и окисления начинает вырабатывать астаксантин[12].
Биосинтез
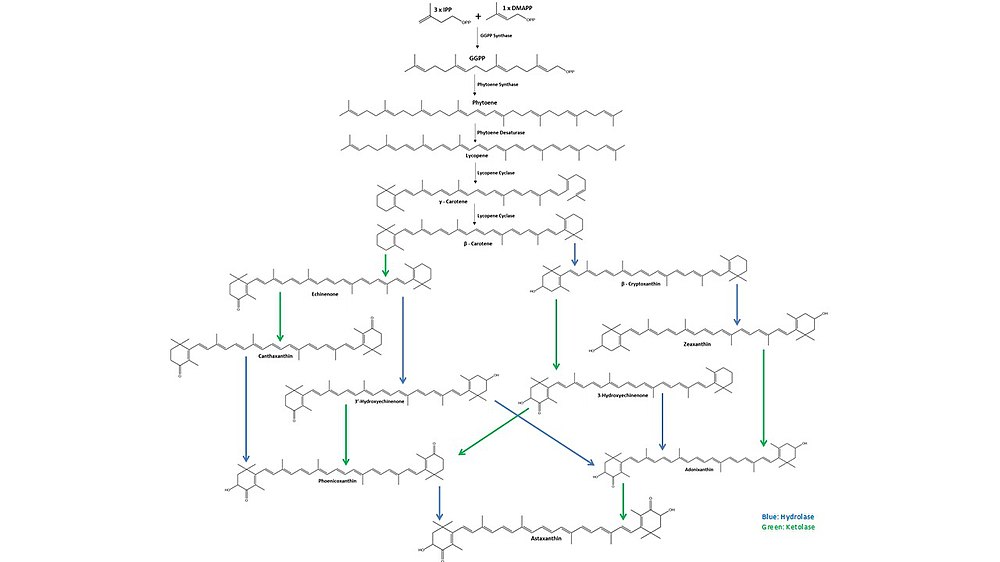
В процессе биосинтеза астаксантина три молекулы изопентенилпирофосфата (IPP) и одна молекула диметилаллилпирофосфата (DMAPP) объединяется изомеразой IPP и превращается в геранилгеранилпирофосфат (GGPP) синтазой GGPP. Две молекулы GGPP затем соединяются фитоинсинтазой с образованием фитоена. Затем под действием фитоендесатуразы в молекуле фитоена образуются четыре двойные связи с образованием ликопина. После десатурации ликопенциклаза сначала образует γ-каротин, превращая один из ациклических концов ликопина в β-кольцо, а затем превращает другой конец в форму β-каротина. Гидролазы (синие стрелочки) ответственны за включение двух 3-гидроксигрупп, а кетолазы (зелёные стрелочки) за добавление двух 4-кетогрупп, пока не будет получена конечная молекула, астаксантин[13].
Синтетический астаксантин имеет другой молекулярный профиль, чем природный — астаксантин может присутствовать не только в свободной форме, но и в форме моно- и диэфиров (так, в антарктическом криле до 65 % астаксантина содержится в виде диэфира, в водорослях — до 70 % в виде моноэфира, а в красных дрожжах — 100 % в свободной форме), при этом клиническая значимость данного факта не ясна[6][14].
Химический синтез астаксантина
В промышленном производстве используется эффективный синтез из изофорона (цис-3-метил-2-пентен-4-ин-1-ола) и симметричного C10-диальдегида в сочетании с реакцией Виттига в метаноле, этаноле или их смеси с выходом до 88 %[15].

Применение
Объём производства астаксантина в 2018 году составил приблизительно 600 млн долларов США[16]. Основными факторами, способствующими росту потребления астаксантина, стали расширение расширение индустрии кормов для животных, растущий спрос на натуральные корма для аквакультуры, рост рынка пищевых добавок и косметики[16].
Использование астаксантина в составе корма для рыб разрешено FDA[17].
Астаксантин находит применение при выращивании свиней и крупного рогатого скота, а также на птицефермах, и позволяет значительно увеличить выживаемость молодняка[18].
Влияние на организм человека
Антиоксидантная и противовоспалительная активность
Активность астаксантина как антиоксиданта почти в 10 раз выше активности зеаксантина, лютеина, кантаксантина и бета-каротина, и в 100 раз — альфа-токоферола. Астаксантин увеличивает устойчивость клеточных мембран, препятствуя проникновению через липидный слой веществ, способствующих перекисному окислению липидов[19], а также может обеспечивать дополнительную защиту от повреждений, вызываемых свободными радикалами[20].
При приёме астаксантина показан клинически значимый антиоксидантный эффект, особенно в группах, восприимчивых к окислительному стрессу (курильщики, лица с ожирением и избыточной массой тела)[21], и отмечена нормализация биохимических показателей окислительного стресса у людей с избыточным весом[22].
Имеются данные, показывающие, что астаксантин значительно уменьшает уровень С-реактивного белка (являющегося биомаркером системного воспаления), а также оказывает положительный терапевтический эффект при ревматоидном артрите[23].
Влияние на иммунную систему
Приём астаксантина увеличивал общее число Т- и В-клеток относительно плацебо, а также цитотоксическую активность естественных киллерных клеток[24].
Влияние на липидный профиль
При испытании на относительно здоровых добровольцах астаксантин значимо увеличивал уровень ЛПВП и способствовал снижению уровня триглицеридов[25].
Влияние на кровь и кровеносную систему
Астаксантин значительно снижал уровень гидроперекисей в эритроцитах[26], улучшал реологические показатели крови, что позволяет предположить положительное влияние на микроциркуляцию крови[27].
Влияние на когнитивные функции
Имеются данные о положительном влиянии астаксантина по таким показателям, как время реакции, улучшение внимания и рабочей памяти у людей[28], улучшение способности к запоминанию у мышей[29].
Влияние на кожу
В исследованиях на небольшой группе показано положительное влияние на разглаживание морщин, увлажнение, тон кожи, эластичность, гладкость, отёчность и пигментные пятна, отмечено увлажнение сухой кожи, исчезновение угрей[30].
Есть данные о том, что астаксантин может способствовать предотвращению появления возрастных пигментных пятен[31][32].
Влияние на зрение
Отмечено положительное влияние астаксантина на остроту зрения даже у здоровых людей, а также снижение утомляемости глаз[32], положительное влияние при старческой дальнозоркости благодаря улучшению сократительной способности папиллярной мышцы.
Безопасность и токсичность
В экспериментах на животных показано, что астаксантин в высоких дозах не проявляет каких-либо побочных эффектов, включая острую токсичность, тератогенность, эмбриотоксичность и репродуктивную токсичность[33].
В организме человека астаксантин не способен превращаться в витамин А, поэтому риск гипервитаминоза А при его избыточном потреблении отсутствует[5].
Примечания
- ↑ JH Chang, Y Chen, D Holland, J Grabowski. Estimating spatial distribution of American lobster Homarus americanus using habitat variables // Marine Ecology Progress Series. — 2010-12-16. — Т. 420. — С. 145–156. — ISSN 1616-1599 0171-8630, 1616-1599. — doi:10.3354/meps08849.
- ↑ Ranga Ambati, Siew-Moi Phang, Sarada Ravi, Ravishankar Aswathanarayana. Astaxanthin: Sources, Extraction, Stability, Biological Activities and Its Commercial Applications—A Review // Marine Drugs. — 2014-01-07. — Т. 12, вып. 1. — С. 128–152. — ISSN 1660-3397. — doi:10.3390/md12010128.
- ↑ Prakash Bhosale, Bogdan Serban, Da You Zhao, Paul S. Bernstein. Identification and Metabolic Transformations of Carotenoids in Ocular Tissues of the Japanese QuailCoturnix japonica† // Biochemistry. — 2007-08. — Т. 46, вып. 31. — С. 9050–9057. — ISSN 1520-4995 0006-2960, 1520-4995. — doi:10.1021/bi700558f.
- ↑ A. Kistler, H. Liechti, L. Pichard, E. Wolz, G. Oesterhelt. Metabolism and CYP-inducer properties of astaxanthin in man and primary human hepatocytes // Archives of Toxicology. — 2001. — 20 ноября (т. 75, вып. 11—12). — С. 665—675. — ISSN 1432-0738 0340-5761, 1432-0738. — doi:10.1007/s00204-001-0287-5.
- ↑ 1 2 Takuji Tanaka, Masahito Shnimizu, Hisataka Moriwaki. Cancer Chemoprevention by Carotenoids // Molecules. — 2012. — 14 марта (т. 17, вып. 3). — С. 3202—3242. — ISSN 1420-3049. — doi:10.3390/molecules17033202.
- ↑ 1 2 3 4 5 Opinion of the Scientific Panel on additives and products or substances used in animal feed (FEEDAP) on the safety of use of colouring agents in animal nutrition - PART I. General Principles and Astaxanthin // EFSA Journal. — 2005. — Декабрь (т. 3, вып. 12). — С. 291. — ISSN 1831-4732. — doi:10.2903/j.efsa.2005.291.
- ↑ A. Ranga Rao, V. Baskaran, R. Sarada, G. A. Ravishankar. In vivo bioavailability and antioxidant activity of carotenoids from microalgal biomass — A repeated dose study // Food Research International. — 2013. — Ноябрь (т. 54, вып. 1). — С. 711—717. — ISSN 0963-9969. — doi:10.1016/j.foodres.2013.07.067.
- ↑ Claude Aflalo, Yuval Meshulam, Aliza Zarka, Sammy Boussiba. On the relative efficiency of two- vs. one-stage production of astaxanthin by the green algaHaematococcus pluvialis // Biotechnology and Bioengineering. — 2007. — Т. 98, вып. 1. — С. 300—305. — ISSN 1097-0290 0006-3592, 1097-0290. — doi:10.1002/bit.21391.
- ↑ M. Orosa, E. Torres, P. Fidalgo, J. Abalde. Production and analysis of secondary carotenoids in green algae // Journal of Applied Phycology. — 2000. — Т. 12, вып. 3/5. — С. 553—556. — ISSN 0921-8971. — doi:10.1023/a:1008173807143.
- ↑ D. H. Zhang, Y. K. Lee. [No title found] // Journal of Applied Phycology. — 1997. — Т. 9, вып. 5. — С. 459—463. — doi:10.1023/A:1007902103419.
- ↑ D. H. Zhang, Y. K. Ng, S. M. Phang. [No title found] // Journal of Applied Phycology. — 1997. — Т. 9, вып. 2. — С. 147—155. — doi:10.1023/A:1007926528388.
- ↑ Gene A. Spiller, Antonella Dewell. Safety of an Astaxanthin-Rich Haematococcus pluvialis Algal Extract: A Randomized Clinical Trial // Journal of Medicinal Food. — 2003-03. — Т. 6, вып. 1. — С. 51—56. — ISSN 1557-7600 1096-620X, 1557-7600. — doi:10.1089/109662003765184741.
- ↑ Jose Barredo, Carlos García-Estrada, Katarina Kosalkova, Carlos Barreiro. Biosynthesis of Astaxanthin as a Main Carotenoid in the Heterobasidiomycetous Yeast Xanthophyllomyces dendrorhous // Journal of Fungi. — 2017-07-30. — Т. 3, вып. 3. — С. 44. — ISSN 2309-608X. — doi:10.3390/jof3030044.
- ↑ Opinion of the Scientific Panel on additives and products or substances used in animal feed (FEEDAP) on the safety of use of colouring agents in animal nutrition - PART I. General Principles and Astaxanthin // EFSA Journal. — 2005-12. — Т. 3, вып. 12. — С. 291. — ISSN 1831-4732. — doi:10.2903/j.efsa.2005.291.
- ↑ Krause, Wolfgang; Henrich, Klaus; Paust, Joachim; et al. Preaparation of Astaxanthin. DE 19509955. 9 March 18, 1995
- ↑ 1 2 Astaxanthin Market Growth Projections Statistics 2019-2026 (амер. англ.). Global Market Insights, Inc.. Дата обращения: 17 февраля 2020.
- ↑ CFR - Code of Federal Regulations Title 21. www.accessdata.fda.gov. Дата обращения: 17 февраля 2020.
- ↑ F. H. Comhaire, Y. El Garem, A. Mahmoud, F. Eertmans, F. Schoonjans. Combined conventional/antioxidant "Astaxanthin" treatment for male infertility: a double blind, randomized trial // Asian Journal of Andrology. — 2005-09. — Т. 7, вып. 3. — С. 257–262. — ISSN 1745-7262 1008-682X, 1745-7262. — doi:10.1111/j.1745-7262.2005.00047.x.
- ↑ Anna Wisniewska, Witold K Subczynski. Effects of polar carotenoids on the shape of the hydrophobic barrier of phospholipid bilayers // Biochimica et Biophysica Acta (BBA) - Biomembranes. — 1998-01. — Т. 1368, вып. 2. — С. 235–246. — ISSN 0005-2736. — doi:10.1016/s0005-2736(97)00182-x.
- ↑ Ruth Edge, Parimal Gaikwad, Suppiah Navaratnam, B.S. Madhava Rao, T. George Truscott. Reduction of oxidized guanosine by dietary carotenoids: A pulse radiolysis study // Archives of Biochemistry and Biophysics. — 2010-12. — Т. 504, вып. 1. — С. 100–103. — ISSN 0003-9861. — doi:10.1016/j.abb.2010.07.026.
- ↑ Jian-Ping Yuan, Juan Peng, Kai Yin, Jiang-Hai Wang. Potential health-promoting effects of astaxanthin: A high-value carotenoid mostly from microalgae // Molecular Nutrition & Food Research. — 2010-11-18. — Т. 55, вып. 1. — С. 150–165. — ISSN 1613-4125. — doi:10.1002/mnfr.201000414.
- ↑ Ignazio Grattagliano, Vincenzo O. Palmieri, Piero Portincasa, Antonio Moschetta, Giuseppe Palasciano. Oxidative stress-induced risk factors associated with the metabolic syndrome: a unifying hypothesis // The Journal of Nutritional Biochemistry. — 2008-08. — Т. 19, вып. 8. — С. 491–504. — ISSN 0955-2863. — doi:10.1016/j.jnutbio.2007.06.011.
- ↑ Jacques Genest. C-reactive protein: Risk factor, biomarker and/or therapeutic target? // Canadian Journal of Cardiology. — 2010-03. — Т. 26. — С. 41A–44A. — ISSN 0828-282X. — doi:10.1016/s0828-282x(10)71061-8.
- ↑ Jean Park, Jong Chyun, Yoo Kim, Larry L Line, Boon P Chew. Astaxanthin decreased oxidative stress and inflammation and enhanced immune response in humans // Nutrition & Metabolism. — 2010. — Т. 7, вып. 1. — С. 18. — ISSN 1743-7075. — doi:10.1186/1743-7075-7-18.
- ↑ Hiroshi Yoshida, Hidekatsu Yanai, Kumie Ito, Yoshiharu Tomono, Takashi Koikeda. Administration of natural astaxanthin increases serum HDL-cholesterol and adiponectin in subjects with mild hyperlipidemia // Atherosclerosis. — 2010-04. — Т. 209, вып. 2. — С. 520–523. — ISSN 0021-9150. — doi:10.1016/j.atherosclerosis.2009.10.012.
- ↑ Kiyotaka Nakagawa, Takehiro Kiko, Taiki Miyazawa, Gregor Carpentero Burdeos, Fumiko Kimura. Antioxidant effect of astaxanthin on phospholipid peroxidation in human erythrocytes // British Journal of Nutrition. — 2011-01-31. — Т. 105, вып. 11. — С. 1563–1571. — ISSN 1475-2662 0007-1145, 1475-2662. — doi:10.1017/s0007114510005398.
- ↑ Hiromi Miyawaki, Jiro Takahashi, Hiroki Tsukahara, Isao Takehara. Effects of Astaxanthin on Human Blood Rheology // Journal of Clinical Biochemistry and Nutrition. — 2008. — Т. 43, вып. 2. — С. 69–74. — ISSN 0912-0009 1880-5086, 0912-0009. — doi:10.3164/jcbn.2008048.
- ↑ Akira Satoh, Shinji Tsuji, Yumika Okada, Nagisa Murakami, Maki Urami. Preliminary Clinical Evaluation of Toxicity and Efficacy of A New Astaxanthin-rich Haematococcus pluvialis Extract // Journal of Clinical Biochemistry and Nutrition. — 2009. — Т. 44, вып. 3. — С. 280–284. — ISSN 0912-0009 1880-5086, 0912-0009. — doi:10.3164/jcbn.08-238.
- ↑ Xiaoli Zhang, Lishan Pan, Xiaoli Wei, Hong Gao, Jianguo Liu. Impact of astaxanthin-enriched algal powder of Haematococcus pluvialis on memory improvement in BALB/c mice // Environmental Geochemistry and Health. — 2007-08-25. — Т. 29, вып. 6. — С. 483–489. — ISSN 1573-2983 0269-4042, 1573-2983. — doi:10.1007/s10653-007-9117-x.
- ↑ Kumi Tominaga, Nobuko Hongo, Mariko Karato, Eiji Yamashita. Cosmetic benefits of astaxanthin on humans subjects. // Acta Biochimica Polonica. — 2012-03-17. — Т. 59, вып. 1. — ISSN 0001-527X 1734-154X, 0001-527X. — doi:10.18388/abp.2012_2168.
- ↑ Jian-Ping Yuan, Juan Peng, Kai Yin, Jiang-Hai Wang. Potential health-promoting effects of astaxanthin: A high-value carotenoid mostly from microalgae // Molecular Nutrition & Food Research. — 2010-11-18. — Т. 55, вып. 1. — С. 150–165. — ISSN 1613-4125. — doi:10.1002/mnfr.201000414.
- ↑ 1 2 Nicolantonio D’Orazio, Eugenio Gemello, Maria Gammone, Massimo de Girolamo, Cristiana Ficoneri. Fucoxantin: A Treasure from the Sea // Marine Drugs. — 2012-03-07. — Т. 10, вып. 12. — С. 604–616. — ISSN 1660-3397. — doi:10.3390/md10030604.
- ↑ Navideh Anarjan, Chin Ping Tan. Chemical stability of astaxanthin nanodispersions in orange juice and skimmed milk as model food systems // Food Chemistry. — 2013-08. — Т. 139, вып. 1—4. — С. 527–531. — ISSN 0308-8146. — doi:10.1016/j.foodchem.2013.01.012.
Статья является кандидатом в добротные статьи с 1 марта 2020. |