Пероксисома
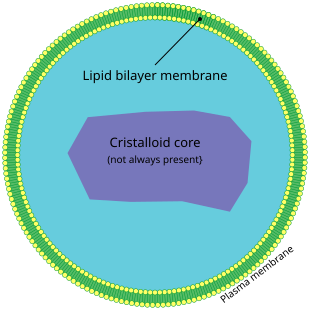
Пероксисо́ма — клеточная органелла, окружённая единственной мембраной и не содержащая ДНК и рибосом (в отличие от митохондрий и хлоропластов). Пероксисомы присутствуют во всех эукариотических клетках. Они содержат ферменты, которые при помощи молекулярного кислорода окисляют некоторые органические вещества. В пероксисомах также происходит β-окисление жирных кислот. В них также протекают первые этапы образования плазмалогенов. У растений пероксисомы клеток листьев участвуют в процессе фотодыхания. Импорт белков в пероксисомы происходит при участии короткой сигнальной последовательности.
История изучения
[править | править код]Как отдельная структура пероксисома впервые была описана в 1954 году Йоханнесом Родином (швед. Johannes A. G. Rhodin) в клетках почки мыши. Эти структуры были окружены одной мембраной и содержали хорошо выраженный гранулярный матрикс. Из-за малого размера и неопределённого облика исследователь назвал их «микротельцами». В 1960 году и позднее Кристианом де Дювом (фр. Christian René de Duve) с соавторами было показано, что пероксисомы содержат такие ферменты, как уратоксидаза, каталаза, оксидаза D-аминокислот. Оказалось, что в пероксисомах молекулярный кислород под действием оксидазы превращается в пероксид водорода, который каталаза разлагает на воду и кислород. Это открытие позволило де Дюву назвать эту органеллу «пероксисомой». Параллельно другая группа исследователей во главе с Гарри Биверсом[англ.] (англ. Harry Beevers) показала, что глиоксилатный цикл в прорастающих семенах протекает в неизвестных доселе цитоплазматических частицах, которые они назвали «глиоксисомами». Глиоксисомы по своим свойствам очень напоминали пероксисомы. Было установлено, что в глиоксисомах также протекает β-окисление жирных кислот. Позднее было открыто, что этот процесс происходит и в пероксисомах печени крысы[1]. В настоящее время глиоксисомы считают видоизменёнными пероксисомами[2].
Морфология и локализация
[править | править код]
Пероксисомы представляют собой небольшие мембранные пузырьки размером 0,3—1,5 мкм, содержащие внутри гранулярный матрикс. В центре матрикса находится сердцевина, или нуклеоид. В этой зоне нередко (особенно в печёночных клетках) видны кристаллоподобные структуры, состоящие из регулярных фибрилл, или трубочек[3].
Пероксисомы присутствуют во всех эукариотических клетках[4]. Размер, количество и белковый состав пероксисом различен в клетках различных тканей, а также может меняться под действием внешнего стимула[5]. Например, у дрожжей, растущих на сахаре, пероксисомы маленькие. Однако у дрожжей, растущих на метаноле, имеются крупные пероксисомы, окисляющие метанол. Если дрожжи выращиваются на жирных кислотах, то они имеют большие пероксисомы, в которых интенсивно протекает β-окисление жирных кислот[6]. У высших позвоночных животных особенно богаты пероксисомами клетки печени и почек. Так, каждый гепатоцит крысы содержит от 70 до 100 пероксисом[7].
Функции
[править | править код]Функции пероксисом чрезвычайно разнообразны в разных группах организмов. Однако практически у всех видов пероксисомы содержат фермент каталазу, а также ферменты β-окисления жирных кислот[5]. Ниже рассмотрены известные функции пероксисом.
Окисление органических веществ
[править | править код]В пероксисоме обычно присутствуют ферменты, использующие молекулярный кислород для отщепления атомов водорода от некоторых органических субстратов () с образованием пероксида водорода ():
- [8].
К числу таких ферментов можно отнести различные оксидазы: уратоксидаза, оксидаза D-аминокислот[7].
Каталаза использует образующуюся для окисления множества субстратов, например, фенолов, муравьиной кислоты, этанола и формальдегида:
- .
С помощью этой реакции в печени и почках происходит обезвреживание различных ядовитых веществ, находящихся в кровотоке. Около 25 % потребляемого этанола пероксисомы окисляют до ацетальдегида[8].
Когда в клетке накапливается слишком много пероксида водорода, каталаза переводит его в воду в следующей реакции:
- [8].
Окисление жирных кислот
[править | править код]В пероксисомах всех организмов протекает β-окисление жирных кислот. На каждом этапе этого процесса алкильная цепь жирной кислоты укорачивается на два атома углерода с высвобождением ацетил-КоА. Далее пероксисомы экспортируют его в цитозоль. У млекопитающих β-окисление протекает не только в пероксисомах, но и в митохондриях, однако у дрожжей и растений этот процесс проходит только в пероксисомах[8].
В пероксисомах также протекает α-окисление жирных кислот, которые не могут подвергаться β-окислению из-за наличия метильной группы у β-атома углерода[9].
Другие функции
[править | править код]
У животных в пероксисомах протекают первые реакции биосинтеза плазмалогенов — самых распространённых фосфолипидов миелина[8]. Широко обсуждается роль пероксисом в биосинтезе изопреноидов и холестерина у животных[10].
На пероксисомы приходится около 10 % активности двух ферментов пентозофосфатного пути: глюкозо-6-фосфатдегидрогеназы и 6-фосфоглюконатдегидрогеназы[англ.], которые, как предполагается, по мере нужды пополняют пул NADPH вне пероксисомы[10].
Показано, что в пероксисомах локализуется белок NDR2 — серин/треониновая киназа[англ.], участвующая в развитии ресниц[11].
Предполагается, что пероксисомы играют важную роль в регуляции системного воспаления, однако функциональная роль этих органелл в воспалительном ответе, который опосредован миелоидными иммунными клетками, в значительной мере неизвестна[12].
В листьях растений пероксисомы участвуют в процессе фотодыхания. Этот процесс является следствием недостаточной специфичности главного фермента, фиксирующего углекислоту, — рубиско, который может связываться не только с углекислым газом, но и с кислородом. При взаимодействии кислорода с рибулозо-1,5-бисфосфатом под действием рубиско образуется 3-фосфоглицерат и 2-фосфогликолат. Фотодыхание убыточно для клетки, так как фиксации углекислого газа при этом не происходит, но образуется 2-фосфогликолат, усвоение которого для клетки энергетически невыгодно[13]. Кроме того, в пероксисомах образуется ряд растительных гормонов[14].
У растений и некоторых других организмов в видоизменённых пероксисомах — глиоксисомах — заключены ферменты глиоксилатного пути. В ходе этого процесса ацетил-КоА, образующийся при окислении жиров (например, запасённых в семени) превращается в глиоксисоме в четырёхуглеродное промежуточное соединение цикла лимонной кислоты — сукцинат, которое выводится в цитозоль и далее используется для синтеза сахаров[15].
У некоторых простейших (например, трипаносом) имеется особая мембраносвязанная органелла, содержащая ферменты гликолиза — гликосома. Предполагается, что она происходит от пероксисомы[16].
У некоторых грибов, таких как Aspergillus nidulans и Penicillium chrysogenum последний этап биосинтеза пенициллина происходит в пероксисомах. У A. nidulans и A. fumigatus пероксисомы задействованы в синтезе сидерофоров[англ.]. Кроме того, тельца Воронина сумчатых грибов, служащие для закупорки пор повреждённых клеток и отделяющие их от нормальных клеток, являются видоизменёнными пероксисомами[17].
Импорт белков
[править | править код]Поскольку пероксисомы не содержат собственной ДНК и рибосом, все их белки должны импортироваться внутрь пероксисом из цитозоля. Некоторые белки пероксисом направляются в них с участием С-концевого сигнала пероксисомального адресования (PTS1). Последовательности PTS1 гораздо короче, чем сигналы импорта других органелл, и часто состоят всего из трёх аминокислотных остатков. Каноническая последовательность PTS1 содержит серин, цистеин или аланин, после которого идёт остаток основной аминокислоты, а затем лейцин. Наличие дополнительных аминокислот вне PTS1 может усиливать адресный сигнал, особенно если последовательность PTS1 сильно отличается от канонической. Гораздо реже пероксисомные белки имеют сигнальную последовательность PTS2, которая находится на N-конце белка и имеет большую длину, чем PTS1. PTS2 являются частью более крупного пептида, который отщепляется после окончания импорта. Процесс импорта белков в пероксисомы изучен недостаточно, но известно, что в нём задействованы растворимые рецепторы в цитозоле, которые узнают сигнальную последовательность, и белки докинга на обращённой к цитозолю стороне пероксисом. Процесс импорта сопровождается гидролизом АТФ, и в нём принимают участие около 23 различных белков, называемых пероксинами[англ.]. Белки с PTS1 позиционируются на пероксисомах с участием рецептора Pex5p, а с PTS2 — Pex7p. У млекопитающих адресование белков с PTS2 происходит с участием белка, который представляет собой вариант альтернативного сплайсинга Pex5p[18]. Комплекс из 6 разных пероксинов образует мембранный транслокатор[19].
Процесс импорта белков пероксисом коренным образом отличается от транслокации белков в ЭПР, митохондрии и хлоропласты в том отношении, что белки пероксисом импортируются после того, как они приобрели в цитозоле нативную или даже олигомерную структуру. В этом отношении транспорт белков в пероксисомы напоминает перенос белков в ядро. При транспорте в ядро и в перокисому рецептор, узнающий сигнальную последовательность, переносится с субстратом через мембрану, потом рецептор отделяется и экспортируется в цитозоль для дальнейшего использования[20].
Биогенез
[править | править код]Механизм образования новых пероксисом в клетке является предметом дискуссий. Доподлинно неизвестно, возникают ли пероксисомы из ранее существующих путём их роста и деления (подобно митохондриям и пластидам), или же они образуются путём отщепления от эндоплазматического ретикулума (ЭПР). Скорее всего, обе точки зрения могут соответствовать действительности, а механизм биогенеза пероксисом, вероятно, выглядит следующим образом. Среди белков пероксисом есть такие, которые сначала интегрируются в мембрану ЭПР, где они могут входить в состав особых везикул — предшественников пероксисом. Отщепление от ЭПР этих везикул и их дальнейшее слияние приводит к образованию пероксисомы, которая импортирует оставшиеся пероксисомальные белки при помощи собственного аппарата импорта. Далее пероксисома может расти и делиться с образованием дочерних пероксисом[21].
В 2017 году была предложена новая модель образования пероксисом de novo. Известно, что пероксисомы и митохондрии функционируют совместно во многих метаболических путях — таких, как β-окисление жирных кислот. Кроме того, в отсутствие пероксисом в клетках многие белки пероксины импортируются в митохондрии. В связи с этим предполагается, что пероксисомы представляют собой гибридный продукт слияния пре-пероксисомных везикул, отделившихся как от ЭПР, так и от митохондрий[22].
Насчёт происхождения пероксисом имеется ряд альтернативных гипотез. Поскольку пероксисомы разных организмов содержат ряд белков, одинаковых для всех, была предложена гипотеза эндосимбиотического происхождения пероксисом. Согласно этой гипотезе, пероксисомы происходят от внутриклеточных бактерий[23]. Есть версия, что пероксисомы происходят от актинобактерий[24]. Впрочем, в последнее время эти гипотезы были опровергнуты[25][26].
Клиническое значение
[править | править код]Первым заболеванием, для которого была установлена связанная с пероксисомами причина, стал синдром Зельвегера[англ.]. У пациентов с синдромом Зельвегера нарушен процесс импорта белков в пероксисомы, что ведёт к тяжёлой пероксисомной недостаточности. Их клетки содержат «пустые» пероксисомы. Пациенты страдают от тяжёлых нарушений мозга, печени и почек и умирают вскоре после рождения. Одна форма заболевания вызвана мутацией в пероксине Pex2, а дефект N-концевого сигнала импорта вызывает более слабую форму заболевания[19].
С момента установления причин синдрома Зельвегера в 1973 году было получено много новых сведений о различных заболеваниях, вызванных нарушениями в функционировании пероксисом: к настоящему моменту выявлено 14 генов, мутации в которых приводят к пероксисомным расстройствам[англ.][27]. Их подразделяют на две группы: заболевания, вызванные нарушениями в работе одного фермента, и заболевания, связанные с биогенезом пероксисом. К первой группе относятся такие заболевания, как X-связанная адренолейкодистрофия[англ.] (ALD) и rhizomelic chondrodysplasia punctata[англ.] (RCDP) типов 2 и 3. У пациентов с X-связанной ALD накапливаются жирные кислоты с очень длинными алкильными цепями из-за мутации в ABC-переносчике[англ.] D1, который необходим для транспорта этих соединений внутрь пероксисом. RCDP типов 2 и 3 вызывается дефектами в двух ключевых ферментах биосинтеза плазмалогенов[28].
Ко второй группе относятся болезни, вызванные нарушениями в биогенезе пероксисом, поэтому они характеризуются более сложной этиологией, чем болезни, вызванные нарушениями в конкретных ферментах. К числу таких болезней относится уже упоминавшийся синдром Зельвегера, неонатальная ALD, а также детская болезнь Рефсума[29].
Примечания
[править | править код]- ↑ Brocard et al., 2014, p. 3—4.
- ↑ Нельсон, Кокс, 2014, с. 213.
- ↑ Ченцов, 2005, с. 320.
- ↑ Альбертс и др., 2013, с. 1107.
- ↑ 1 2 Brocard et al., 2014, p. 4.
- ↑ Альбертс и др., 2013, с. 1108—1109.
- ↑ 1 2 Ченцов, 2005, с. 321.
- ↑ 1 2 3 4 5 Альбертс и др., 2013, с. 1108.
- ↑ Нельсон, Кокс, 2014, с. 250.
- ↑ 1 2 Wanders R. J., Waterham H. R. Biochemistry of mammalian peroxisomes revisited. (англ.) // Annual review of biochemistry. — 2006. — Vol. 75. — P. 295—332. — doi:10.1146/annurev.biochem.74.082803.133329. — PMID 16756494.
- ↑ Abe S., Nagai T., Masukawa M., Okumoto K., Homma Y., Fujiki Y., Mizuno K. Localization of NDR2 to peroxisomes and its role in ciliogenesis. (англ.) // The Journal of biological chemistry. — 2017. — doi:10.1074/jbc.M117.775916. — PMID 28122914.
- ↑ Vijayan V., Srinu T., Karnati S., Garikapati V., Linke M., Kamalyan L., Mali S. R., Sudan K., Kollas A., Schmid T., Schulz S., Spengler B., Weichhart T., Immenschuh S., Baumgart-Vogt E. A New Immunomodulatory Role for Peroxisomes in Macrophages Activated by the TLR4 Ligand Lipopolysaccharide. (англ.) // Journal of immunology (Baltimore, Md. : 1950). — 2017. — doi:10.4049/jimmunol.1601596. — PMID 28179495.
- ↑ Нельсон, Кокс, 2014, с. 420.
- ↑ Fahy D., Sanad M. N., Duscha K., Lyons M., Liu F., Bozhkov P., Kunz H. H., Hu J., Neuhaus H. E., Steel P. G., Smertenko A. Impact of salt stress, cell death, and autophagy on peroxisomes: quantitative and morphological analyses using small fluorescent probe N-BODIPY. (англ.) // Scientific reports. — 2017. — Vol. 7. — P. 39069. — doi:10.1038/srep39069. — PMID 28145408.
- ↑ Нельсон, Кокс, 2014, с. 212—213.
- ↑ Parsons M. Glycosomes: parasites and the divergence of peroxisomal purpose. (англ.) // Molecular microbiology. — 2004. — Vol. 53, no. 3. — P. 717—724. — doi:10.1111/j.1365-2958.2004.04203.x. — PMID 15255886.
- ↑ Камзолкина О. В., Дунаевский Я. Е. Биология грибной клетки. — М.: Товарищество научных изданий КМК, 2015. — С. 130—131, 135. — 239 с. — ISBN 978-5-9906564-1-3.
- ↑ Кассимерис и др., 2016, с. 349.
- ↑ 1 2 Альбертс и др., 2013, с. 1110.
- ↑ Кассимерис и др., 2016, с. 349—350.
- ↑ Альбертс и др., 2013, с. 1110—1111.
- ↑ Sugiura A., Mattie S., Prudent J., McBride H. M. Newly born peroxisomes are a hybrid of mitochondrial and ER-derived pre-peroxisomes. (англ.) // Nature. — 2017. — Vol. 542, no. 7640. — P. 251—254. — doi:10.1038/nature21375. — PMID 28146471.
- ↑ Lazarow P. B., Fujiki Y. Biogenesis of peroxisomes. (англ.) // Annual review of cell biology. — 1985. — Vol. 1. — P. 489—530. — doi:10.1146/annurev.cb.01.110185.002421. — PMID 3916321.
- ↑ Duhita N., Le H. A., Satoshi S., Kazuo H., Daisuke M., Takao S. The origin of peroxisomes: The possibility of an actinobacterial symbiosis. (англ.) // Gene. — 2010. — Vol. 450, no. 1-2. — P. 18—24. — doi:10.1016/j.gene.2009.09.014. — PMID 19818387.
- ↑ Fagarasanu A., Fagarasanu M., Rachubinski R. A. Maintaining peroxisome populations: a story of division and inheritance. (англ.) // Annual review of cell and developmental biology. — 2007. — Vol. 23. — P. 321—344. — doi:10.1146/annurev.cellbio.23.090506.123456. — PMID 17506702.
- ↑ Gabaldón T., Capella-Gutiérrez S. Lack of phylogenetic support for a supposed actinobacterial origin of peroxisomes. (англ.) // Gene. — 2010. — Vol. 465, no. 1-2. — P. 61—65. — doi:10.1016/j.gene.2010.06.004. — PMID 20600706.
- ↑ Taylor R. L., Handley M. T., Waller S., Campbell C., Urquhart J., Meynert A. M., Ellingford J. M., Donnelly D., Wilcox G., Lloyd I. C., Mundy H., FitzPatrick D. R., Deshpande C., Clayton-Smith J., Black G. C. Novel PEX11B Mutations Extend the Peroxisome Biogenesis Disorder 14B Phenotypic Spectrum and Underscore Congenital Cataract as an Early Feature. (англ.) // Investigative ophthalmology & visual science. — 2017. — Vol. 58, no. 1. — P. 594—603. — doi:10.1167/iovs.16-21026. — PMID 28129423.
- ↑ Brocard et al., 2014, p. 5.
- ↑ Brocard et al., 2014, p. 5—6.
Литература
[править | править код]- Molecular Machines Involved in Peroxisome Biogenesis and Maintenance / Cecile Brocard, Andreas Hartig. — Springer Vienna, 2014. — ISBN 978-3-7091-1788-0. — doi:10.1007/978-3-7091-1788-0.
- Кассимерис Л., Лингаппа В. Р., Плоппер Д. . Клетки по Льюину. — М.: Лаборатория знаний, 2016. — 1056 с. — ISBN 978-5-906828-23-1.
- Ченцов Ю. С. Введение в клеточную биологию. — М.: ИКЦ «Академкнига», 2005. — 495 с. — ISBN 5-94628-105-4.
- Альбертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. Молекулярная биология клетки: в 3-х томах. Т. 2. — М.: Ижевск: НИЦ «Регулярная и хаотическая динамика», Институт компьютерных исследований, 2013. — 992 с. — ISBN 978-5-4344-0113-5.
- Нельсон Д., Кокс М. Основы биохимии Ленинджера. — М.: БИНОМ. Лаборатория знаний, 2014. — Т. 2. — 636 с. — ISBN 978-5-94774-366-1.
- Панченко Л. Ф., Герасимов А. М., Антоненков В. Д. Роль пероксисом в патологии клетки. — М.: Медицина, 1981. — 208 с. — 1671 экз.
Эта статья входит в число хороших статей русскоязычного раздела Википедии. |




