Фторид иода(VII)
| Фторид иода(VII) | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Фторид иода(VII) | ||
| Традиционные названия | семифтористый иод, гептафторид иода | ||
| Хим. формула | IF7 | ||
| Рац. формула | IF7 | ||
| Физические свойства | |||
| Молярная масса | 259,89 г/моль | ||
| Плотность | 3,62 г/см3 (при −145 °C)[1]; 2,7 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 6,45 °C[1]; 4,5 °C | ||
| • сублимации | 4,77[1] °C | ||
| • разложения | 200 °C[1] | ||
| Мол. теплоёмк. | 135,6[1] Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | −961,5[1] кДж/моль | ||
| • плавления | 4,55 кДж/моль[1] | ||
| • сублимации | 27,1 кДж/моль[1] | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | реагирует | ||
| Классификация | |||
| Рег. номер CAS | 16921-96-3 | ||
| PubChem | 85645 | ||
| Рег. номер EINECS | 240-981-4 | ||
| SMILES | |||
| InChI | |||
| ChemSpider | 21477354 | ||
| Безопасность | |||
| Предельная концентрация | 0,5 мг/м3 | ||
| ЛД50 | 14,24 мг/кг (крысы, внутривенно) | ||
| Токсичность | Чрезвычайно ядовит, СДЯВ | ||
| Пиктограммы ECB |
|
||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Фтори́д ио́да(VII) (гептафтори́д ио́да, семифто́ристый ио́д), IF7 — бесцветный чрезвычайно ядовитый тяжёлый газ (при 20 °C) с резким неприятным запахом, высший фторид иода, в котором атом иода проявляет степень окисления +7. Тяжелее воздуха почти в 9 раз.
Физические свойства
До сегодняшнего дня нет единого мнения о температурах фазового перехода соединения, поскольку его сложно очистить от примеси IOF5, который занижает температуру плавления. По некоторым данным, температура плавления соединения находится в пределах 6,4 ± 0,1 °C[2]. По другим данным, вещество возгоняется при 4,77 °C[1].
| Свойство | Значение[3] |
|---|---|
| Энтальпия образования (298 К, в газовой фазе) | −122,22 кДж/моль; по другим данным −229,80 кДж/моль[4] или −961,5 кДж/моль[1]; |
| Энтропия образования (300 К, в газовой фазе) | 355,16 Дж/(моль·К); по другим данным 353,0 Дж/(моль·К)[1] |
| Теплоёмкость при постоянном давлении (300 К, в газовой фазе) | 137,09 Дж/(моль·К); по другим данным 135,6 Дж/(моль·К)[1] |
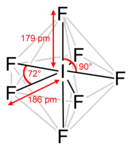
Кристаллизуется в двух модификациях, из которых выше −125 °C устойчивы кристаллы кубической сингонии, пространственная группа Im3m, параметры ячейки a = 0,628 нм, Z = 2.
Строение
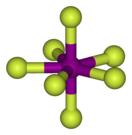
Пентагонально-бипирамидальное строение молекулы подтверждено спектроскопически при помощи ИК, КР и ЯМР-19F спектроскопии.
Методы получения
- Известен метод получения гептафторида взаимодействием иода с фторидами металлов, например, фторидом серебра. Такую реакцию впервые наблюдал Каммерер. Однако в таких условиях также получается пентафторид иода:
- Также применяется метод получения из простых веществ. Для этого фтор пропускают над иодом в платиновом реакторе. Сначала образуется пентафторид иода, который при 270 °C реагирует с фтором и образует гептафторид.
- Чаще всего применяют взаимодействие пентафторида иода с фтором, при этом проходят процессы, аналогичные второй стадии предыдущего метода.
- Продукт, полученный вышеописанными методами, обычно загрязнён примесью IOF5 за счёт гидролиза IF7 следами воды, содержащейся в иоде. Поэтому для получения чистого продукта можно применять метод взаимодействия фтора с тщательно обезвоженными иодидами (их легче осушить, чем элементный иод)[2] при 150—300 °C[1]. Например:
Химические свойства
Химические свойства гептафторида иода во многом схожи со свойствами трифторида хлора. Химически чрезвычайно активен и агрессивен к большинству материалов. Сильный окислитель.
- Достаточно часто в начале реакции молекула гептафторида отщепляет 2 атома фтора, которые участвуют в дальнейшей реакции, а IF5 выделяется с продуктами:
- Углекислый газ сгорает в присутствии IF7 с образованием элементного иода:
- Гидролизуется водой, при этом образуется ортоиодная кислота и фтороводород:
- Реагирует с диоксидом кремния и стеклом с образованием оксопентафторида иода и тетрафторида кремния:
- С некоторыми фторидами (AsF5, SbF5, BF3)[5] образует комплексные соединения, которые вполне устойчивы до температуры около 140 °C. Предположительно, структура таких соединений ионная: IF6+·AsF6−.
- При нагревании до 200 °C медленно диссоциирует на низшие фториды иода и F2[1].
- Органические соединения при контакте с гептафторидом иода воспламеняются или взрываются с образованием множества различных продуктов, которые обычно не полностью идентифицированы.
Применение
Нашёл некоторое применение в органическом синтезе[6].
Токсикология
Гептафторид иода — едкое, весьма токсичное вещество, обладающее удушающим действием. Как и все производные иода со степенью окисления +7, является сильным окислителем. В высоких концентрациях фторид иода(VII) очень сильно раздражает кожу и слизистые оболочки.
ПДК в рабочей зоне — 0,5 мг/м³ (по фтору).
Литература
- Николаев Н. С., Сухоруков В. Ф., Шишков Ю. Д., Аленчикова И. Ф. Химия галоидных соединений фтора. — М.: Наука, 1968. — С. 344.
- Раков Э. Г. Галогенфториды // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 1: А — Дарзана. — С. 496. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
Примечания
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Раков Э. Г. Галогенфториды // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 1: А — Дарзана. — С. 496. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
- ↑ 1 2 Bartlett N., Levchuk L. E. Iodine Oxide Pentafluoride and Iodine Heptafluoride (англ.) // Proceedings of the Chemical Society. — 1963. — Iss. November. — P. 342—343. — doi:10.1039/PS9630000325.
- ↑ Khanna R. K. Force constants and thermodynamic functions of iodine heptafluoride (англ.) // Journal of Molecular Spectroscopy. — 1962. — Vol. 8, iss. 1—6. — P. 134—141. — doi:10.1016/0022-2852(62)90014-0.
- ↑ Settle J. L. et al. The enthalpies of formation of iodine pentafluoride and iodine heptafluoride (англ.) // Journal of Inorganic and Nuclear Chemistry. — 1976. — Vol. 28 Suppl.1. — P. 135—140. — doi:10.1016/0022-1902(76)80614-8.
- ↑ Adams C. J. Acceptor properties of iodine heptafluoride: octafluoroperiodates(VII) (англ.) // Inorganic and Nuclear Chemistry Letters. — 1974. — Vol. 10, iss. 10. — P. 831—835. — doi:10.1016/0020-1650(74)80084-X.
- ↑ Богуславская Л. С. Фториды галогенов в органическом синтезе // Успехи химии. — 1984. — Т. 53, вып. 12. — С. 2024—2055. — doi:10.1070/RC1984v053n12ABEH003147.








![{\displaystyle {\mathsf {IF_{7}+AsF_{5}\rightarrow IF_{6}[AsF_{6}]}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/9962b0e8e186b0cf7ba41a31eefc61a80e18efa9)