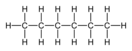
Гексан
| Гексан | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
гексан | ||
| Хим. формула | C6H14 | ||
| Рац. формула | C6H14 | ||
| Физические свойства | |||
| Состояние | бесцветная жидкость | ||
| Молярная масса | 86,17848 г/моль | ||
| Плотность | 0,6548 г/см³ | ||
| Энергия ионизации | 10,18 ± 0,01 эВ[1] и 10,13 эВ[4] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −95 °С (н-гексан) | ||
| • кипения | 68 °С (н-гексан) °C | ||
| • вспышки | −7 ± 1 ℉[1] | ||
| • самовоспламенения | 240 °C | ||
| Пределы взрываемости | 1,1 ± 0,1 об.%[1] | ||
| Критическая точка | |||
| • давление | 29,61 атм | ||
| Давление пара | 124 ± 1 мм рт.ст.[1] | ||
| Классификация | |||
| Рег. номер CAS | 110-54-3 | ||
| PubChem | 8058 | ||
| Рег. номер EINECS | 203-777-6 | ||
| SMILES | |||
| InChI | |||
| RTECS | MN9275000 | ||
| ChEBI | 29021 | ||
| Номер ООН | 1208 | ||
| ChemSpider | 7767 | ||
| Безопасность | |||
| Предельная концентрация | 300 мг/м3[2] | ||
| ЛД50 | 28710 мг/кг (крысы, орально)[3] | ||
| Токсичность | Класс опасности по ГОСТ 12.1.007: 4-й | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Гекса́н — насыщенный углеводород, химическая формула , относящийся к классу алканов.
Существует 5 изомеров гексана — изомер линейного строения — н-гексан, и 4 изомера разветвлённого строения. Обычно под термином «гексан» подразумевается изомер линейного строения. Изомеры немного различаются по физическим свойствам, в частности, по температурам плавления и кипения.
Свойства
Бесцветная жидкость со слабым запахом (напоминающим дихлорэтан)[5]. Показатель преломления
Н-гексан имеет низкое значение октанового числа, около 24—26[6] и является нежелательной составной частью синтетического бензина, снижающего его октановое число.
Получение гексана
Н-гексан содержится в значительных количествах в бензине прямой перегонки. Большие количества его изомеров содержатся в бензине каталитического крекинга и в алкилированном бензине.
Применение
- Гексан входит в состав бензина.
- В условиях ароматизации нефтепродуктов и каталитического риформинга гексан дегидроциклизуется в бензол.
- 2,2-Диметилбутан и 2,3-диметилбутан используются как добавки к моторному топливу, улучшающие его качество.
- Применяется при экстрагировании растительных масел из семян растений.
- Органический растворитель[7] (в частности, хорошо растворяет и отмывает термоклей[уточнить] для этикеток).
- Активатор для цианоакрилатного клея в форме спрея в наборах для экспресс-склеивания.[источник не указан 1597 дней]
Изомеры
Гексан имеет пять изомеров:
| Традиционное название |
Название по IUPAC | Химическая формула | Структурная формула |
|---|---|---|---|
| гексан н-гексан |
гексан | ||
| изогексан | 2-метилпентан | 
| |
| — | 3-метилпентан | 
| |
| диизопропил' | 2,3-диметилбутан | 
| |
| неогексан | 2,2-диметилбутан | 
|
Примечания
- ↑ 1 2 3 4 http://www.cdc.gov/niosh/npg/npgd0322.html
- ↑ по ГОСТ 12.1.005-88
- ↑ Шаблон:IDLH
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Газоанализатор гексан. Дата обращения: 22 августа 2020. Архивировано 29 ноября 2020 года.
- ↑ И. Л. Кнунянц, Краткая химическая энциклопедия Архивная копия от 28 мая 2015 на Wayback Machine: «Октановое число», стр. 720 «Углеводороды: н-Гексан, Октановое число: 26,0 24,8»
- ↑ Congress Should Protect Workers—and Families—from a Nerve-damaging Toxic: Hexane Архивная копия от 29 августа 2014 на Wayback Machine // NRDC, 2010
Литература
- Вайсбергер А., Проскауэр Э., Риддик Дж., Тупс Э.. Органические растворители. — М.: Издатинлит, 1958.
Ссылки
- HEXANES // FAO, 51st JECFA 1998 («Combined Compendium of Food Additive Specifications») (англ.)
- National Pollutant Inventory - n-hexane fact sheet