Трансляция (биология)
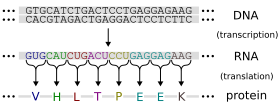

Трансля́ция (от лат. translatio — «перенос, перемещение») — осуществляемый рибосомой процесс синтеза белка из аминокислот на матрице информационной (матричной) РНК (иРНК, мРНК), происходящий на клеточном уровне; реализация генетической информации.
Механизм

Инициация.
1. Узнавание стартового кодона (AUG), сопровождается присоединением тРНК, аминоацилированной метионином (М), и сборкой рибосомы из большой и малой субъединиц.
Элонгация.
2. Узнавание текущего кодона соответствующей ему аминоацил-тРНК (комплементарное взаимодействие кодона мРНК и антикодона тРНК увеличено).
3. Присоединение аминокислоты, принесённой тРНК, к концу растущей полипептидной цепи.
4. Продвижение рибосомы вдоль матрицы, сопровождающееся высвобождением молекулы тРНК.
5. Аминоацилирование высвободившейся молекулы тРНК соответствующей ей аминоацил-тРНК-синтетазой.
6. Присоединение следующей молекулы аминоацил-тРНК, аналогично стадии (2).
7. Движение рибосомы по молекуле мРНК до стоп-кодона (в данном случае UAG).
Терминация.
Узнавание рибосомой стоп-кодона сопровождается (8) отсоединением новосинтезированного белка и в некоторых случаях (9) диссоциацией рибосомы.
Синтез белка является основой жизнедеятельности клетки. Для осуществления этого процесса в клетках имеются специальные немембранные органеллы — рибосомы. Это рибонуклеопротеидные комплексы, построенные из 2 субъединиц: большой и малой. Их функция - узнавание трёхбуквенных (трехнуклеотидных) кодонов мРНК, сопоставление соответствующих им антикодонов тРНК, несущих аминокислоты, и присоединение этих аминокислот к растущей белковой цепи. Двигаясь вдоль молекулы мРНК, рибосома синтезирует белок в соответствии с информацией, заложенной в молекуле мРНК.[1]
Для узнавания аминокислот в клетке есть специальные «адаптеры», молекулы транспортной РНК (тРНК). Эти молекулы, имеющие форму клеверного листа, имеют участок (антикодон), комплементарный кодону мРНК, а также другой участок, к которому присоединяется аминокислота, соответствующая этому кодону. Присоединение аминокислот к тРНК осуществляется в энерго-зависимой реакции ферментами аминоацил-тРНК-синтетазами, а получившаяся молекула называется аминоацил-тРНК. Таким образом, специфичность трансляции определяется взаимодействием между кодоном мРНК и антикодоном тРНК, а также специфичностью аминоацил-тРНК-синтетаз, присоединяющих аминокислоты строго к соответствующим им тРНК (например, кодону GGU будет соответствовать тРНК, содержащая антикодон CCA, а к этой тРНК будет присоединяться только аминокислота глицин).
Механизмы трансляции прокариот и эукариот существенно отличаются, поэтому многие вещества, подавляющие трансляцию прокариот, меньше действуют на трансляцию эукариот, что позволяет использовать их в медицине как антибактериальные средства, безопасные для организма млекопитающих.
Процесс трансляции разделяют на
- инициацию — узнавание рибосомой стартового кодона и начало синтеза.
- элонгацию — собственно синтез белка.
- терминацию — узнавание терминирующего кодона (стоп-кодона) и отделение продукта.
Рамка считывания
Так как каждый кодон содержит три нуклеотида, один генетический текст можно прочитать тремя способами (начиная с первого, второго и третьего нуклеотидов), то есть в трех разных рамках считывания. Обычно значимой является информация, закодированная только в одной рамке считывания. Поэтому правильная инициация трансляции (позиционирование на стартовом AUG-кодоне) крайне важна для синтеза белка рибосомой.
Инициация

Синтез белка в большинстве случаев начинается с AUG-кодона, кодирующего метионин. Этот кодон обычно называют стартовым или инициаторным. Инициация трансляции предусматривает узнавание рибосомой этого кодона и привлечение инициаторной аминоацил-тРНК. Для инициации трансляции необходимо также наличие определённых нуклеотидных последовательностей в районе стартового кодона (последовательность Шайна — Дальгарно у прокариот и последовательность Козак у эукариот). Немаловажная роль в защите 5'-конца мРНК принадлежит 5'-кэпу. Существование последовательности, отличающей стартовый AUG от внутренних совершенно необходимо, так как в противном случае инициация синтеза белка происходила бы хаотично на всех AUG-кодонах.
Процесс инициации обеспечивается специальными белками — факторами инициации (англ. initiation factors, IF; инициаторные факторы эукариот обозначают eIF, от англ. eukaryotes).
Механизмы инициации трансляции у про- и эукариот существенно отличаются: прокариотические рибосомы потенциально способны находить стартовый AUG и инициировать синтез на любых участках мРНК, в то время как эукариотические рибосомы обычно присоединяются к мРНК в области кэпа и сканируют её в поисках стартового кодона.
У прокариот

Начальная стадия предусматривает связывание малой рибосомной субъединицы (30S) с мРНК. Это может происходить двумя способами: либо сначала к мРНК присоединяется комплекс, содержащий рибосомную субчастицу (1), а затем к нему привлекается тРНК в комплексе с IF2 и ГТФ (2), либо 30S субъединица изначально связывается с тРНК, а уже потом садится на мРНК (3). К образовавшемуся комплексу приходит большая (50S) рибосомная субъединица (4), инициаторные факторы отсоединяются от 30S субчастицы, что сопровождается гидролизом ГТФ белком IF2 (5), и собранная рибосома начинает элонгировать цепь (6). В правом нижнем углу дана схема инициаторного участка прокариотической мРНК. Отмечены 5' и 3' концы молекулы. RBS — сайт связывания рибосомы, SD — последовательность Шайна — Дальгарно, AUG — инициаторный кодон
Малая рибосомная субъединица (30S) прокариот, если она не вовлечена в данный момент в трансляцию, существует в комплексе с инициаторными факторами IF1, IF3, и, в некоторых случаях, IF2. Рассмотрим основные функции этих белков:
- IF3, связанный с 30S-субъединицей, предотвращает ассоциацию с большой (50S) субъединицей рибосомы, тем самым сохраняя её свободное состояние до связывания с матричной РНК. Этот белок также принимает участие в связывании мРНК и тРНК, а также IF2.
- IF2 взаимодействует с тРНК, а также обладает способностью расщеплять ГТФ.
- IF1 является, по-видимому, не обязательным фактором (у некоторых видов он отсутствует), повышающим сродство малой субчастицы к IF2 и IF3.
Комплекс 30S субчастицы с инициаторными факторами способен узнавать специальные последовательности мРНК, так называемые участки связывания рибосомы (англ. RBS, ribosome-binding site). Эти участки содержат, во-первых, инициаторный AUG, и, во-вторых, специальную последовательность Шайна — Дальгарно, с которой комплементарно связывается рибосомная 16S РНК. Последовательность Шайна — Дальгарно служит для того, чтобы отличать инициаторный AUG от внутренних кодонов, кодирующих метионин. После того, как 30S-субъединица связалась с мРНК, к ней привлекается инициаторная аминоацил-тРНК и IF2, если они ещё не были включены в комплекс. Затем присоединяется 50S-субчастица, происходит гидролиз ГТФ и диссоциация инициаторных факторов. Собранная рибосома начинает синтезировать полипептидную цепь.
У эукариот
У эукариот существуют два основных механизма нахождения рибосомой стартового AUG: кэпзависимый (сканирующий) и кэпнезависимый (внутренняя инициация).
- При сканирующем механизме рибосома (точнее, её малая субъединица) садится на 5'-конец мРНК в области кэпа и двигается вдоль молекулы мРНК, «сканируя» один кодон за другим, пока не наткнётся на инициаторный AUG. Для привлечения рибосомы к 5'-концу мРНК требуется специальная структура, кэп — 7-метилгуанин, прикреплённый к 5'-концевому нуклеотиду мРНК.
- При механизме внутренней инициации, называемом у эукариот также IRES-зависимым механизмом, рибосома садится на внутренний участок мРНК, называемый IRES (англ. Internal Ribosomal Entry Site, участок внутренней посадки рибосомы) — участок мРНК, обладающий выраженной вторичной структурой, позволяющей ему направлять рибосомы на стартовый AUG. По IRES-зависимому механизму инициируется синтез лишь на небольшой части клеточных мРНК, а также на РНК некоторых вирусов.[2]
В дополнение к основным механизмам инициации, при наличии перед стартовым кодоном поли(А)-лидера (например, в мРНК вирусов семейства оспы) реализуется нестандартный механизм инициации. В этом случае инициаторный комплекс не содержит факторов IF3 и eIF4F, и после сборки на 5'-нетранслируемой области осуществляет не последовательное сканирование мРНК, а т.н. АТФ-независимое "бесфазное блуждание". При этом инициация протекает значительно быстрее, чем в случае работы по классическому сканирующему механизму.[3]
Также у эукариот возможна реинициация трансляции, когда после окончания трансляции рибосома с белковыми факторами не диссоциирует от мРНК, а перескакивает с 3' на 5'-конец мРНК и начинает инициацию ещё раз. Это возможно благодаря т.н. циклизации мРНК в цитоплазме, то есть физическому сближению старт- и стоп-кодонов с помощью специальных белков.
Кэпзависимый механизм
В отличие от прокариот, инициация трансляции у которых обеспечивается лишь тремя белковыми факторами, трансляция подавляющего большинства мРНК эукариот, содержащих 5'-кэп [m7G(5')ppp(5')N] и 3'-поли(А)-хвост, требует участия, по крайней мере, 13 общих эукариотических факторов инициации (eIF), представленных 31 полипептидом. Инициация трансляции включает события между диссоциацией рибосомы во время терминации в предыдущем цикле трансляции и сборкой рибосомы, готовой к элонгации, на старт-кодоне мРНК. Во время инициации аппарат трансляции решает следующие задачи:
- диссоциация и антиассоциация рибосомных субъединиц;
- выбор инициаторной метионил-тРНК (Met-tRNAiMet);
- связывание 5'-кэпа, связывание поли(А), сканирование;
- выбор правильного старт-кодона;
- объединение рибосомных субъединиц на старт-кодоне[4][5][Л 1][Л 2][6]
Диссоциация и антиассоциация субъединиц рибосом
Диссоциация рибосомных субъединиц в конце терминации — активный процесс, в котором участвуют eIF, а также факторы элонгации и терминации. Антиассоциация уже диссоциированных субъединиц обеспечивается eIF и служит для предотвращения преждевременного объединения рибосомных субъединиц.[4][5][Л 2][6] Главная роль в выполнении этой задачи принадлежит eIF3, мультисубъединичному фактору, состоящему из 13 различных субъединиц (общей молекулярной массой 800 кДа) у млекопитающих, 11 субъединиц у растений и шести субъединиц у дрожжей Saccharomyces cerevisiae.[7][8] eIF3 связывается с 40S субъединицей рибосомы (40S) посредством своей j-субъединицы, которая, в свою очередь, взаимодействует с «каркасной» (scaffolding) b-субъединицей и предотвращает ассоциацию 40S с 60S рибосомной субъединицей (60S).[9][10] Эти активности eIF3 зависят от его взаимодействия с eIF1 и тройственным комплексом eIF2/GTP/Met-tRNAiMet.[11] Связывание eIF1 с 40S является кооперативным с eIF3[12][13], так же как и связывание eIF1 с eIF1А (гомологом бактериального IF1)[14]. Таким образом, eIF1А, вероятно, также участвует в антиассоциации, по крайней мере, непрямым образом.
Селекция инициаторной метионил-тРНК (Met-tRNAiMet)
Этот этап включает в себя следующие процессы:
- узнавание и метионилирование tRNAiMet специфичной метионил-тРНК-синтетазой;
- дискриминацию против Met-tRNAiMet эукариотическими факторами элонгации;
- дискриминацию против неметионилированной или неправильно аминоацилированной tRNAiMet eIF;
- дискриминацию против элонгаторных тРНК eIF.
В ходе процесса (а), метионил-тРНК-синтетаза взаимодействует как с акцепторным концом тРНК, так и с антикодоном.
Процесс (б) у растений и дрожжей осуществляется с помощью посттранскрипционной модификации tRNAiMet, которая делает её отличной от элонгаторной метионин-специфичной тРНК с помощью присоединения 2'-О-фосфорибозила к рибозе нуклеотида А64. У позвоночных процесс (б) осуществляется путём дискриминации между специфическими особенностями нуклеотидных последовательностей tRNAiMet и элонгаторной метиониновой тРНК.
Элонгация

В процессе наращивания полипептидной цепи принимают участие два белковых фактора элонгации. Первый (EF1a у эукариот, EF-Tu — у прокариот) переносит аминоацилированную («заряженную» аминокислотой) тРНК в А (аминоацил)-сайт рибосомы. Рибосома катализирует перенос пептида, связанного с тРНК в Р-сайте, в А-сайт и образование пептидной связи с находящимся там аминокислотным остатком. Таким образом растущий пептид удлиняется на один аминокислотный остаток. Затем второй белок (EF2 у эукариот, EF-G — у прокариот) катализирует так называемую транслокацию. Транслокация — перемещение рибосомы по мРНК на один триплет (примерно 20 ангстрем), в результате которого пептидил-тРНК оказывается вновь в Р-сайте, а «пустая» тРНК из P-сайта переходит в Е-сайт (от слова exit). тРНК из E-сайта диссоциирует спонтанно, после чего рибосома готова к новому циклу элонгации[15].
Терминация
Терминация — окончание синтеза белка, осуществляется, когда в А-сайте рибосомы оказывается один из стоп- кодонов — UAG, UAA, UGA. Из-за отсутствия тРНК , соответствующих этим кодонам, пептидил-тРНК остаётся связанной с Р-сайтом рибосомы. Здесь в действие вступают специфические белки RF1 или RF2, которые катализируют отсоединение полипептидной цепи от мРНК, а также RF3, который вызывает диссоциацию мРНК из рибосомы. RF1 узнаёт в А-участке UAA или UAG; RF-2 — UAA или UGA. С UAA терминация эффективнее, чем с другими стоп-кодонами.
Компартментализация у эукариот
В отличие от прокариот, у которых биосинтез белка происходит непосредственно во время транскрипции соответствующих мРНК, для эукариот характерна строгая компартментализация всех процессов, происходящих во время биосинтеза белка, в том числе и компартментализация трансляции.
Трансляция мРНК секреторных и мембранных белков (обычно они составляют 3—15 % от всех синтезируемых клеткой белков) происходит на рибосомах, связанных с гранулярной эндоплазматической сеткой.[16] По классическим представлениям, ещё 35—45 % рибосом связаны с цитоскелетом, а оставшиеся 20—40 % рибосом находятся в несвязанном состоянии в цитозоле.[17] Однако высказываются предположения, что свободные рибосомы являются артефактом, и в клетке они связаны с так называемой микротрабекулярной решеткой, образованной особым типом филаментов.[18] Впрочем, по другим данным, само существование микротрабекулярной решетки ставится под сомнение,[19] так что вопрос о существовании активных несвязанных рибосом остаётся открытым.
В настоящее время высказывается гипотеза, что трансляция у эукариот происходит не во всей цитоплазме клетки, а в отдельных областях цитоплазмы, условно называемых «трансляционными компартментами».[20] Предположительно, в состав трансляционного компартмента входят следующие структуры:
- рибосомы с присоединенными к ним белковыми факторами, матричной и транспортными РНК;
- так называемые кодосомы — сложные белковые комплексы, в которые входят 7-9 аминоацил-тРНК синтетаза, пирофосфатаза, циклические нуклеотиды, ионы магния и липиды;[21]
- eEF1H — тяжёлая (англ. heavy), или полная, форма фактора элонгации 1. Он содержит 4 фактора элонгации (eEF1A, eEF1Bα, eEF1Bβ, eEF1Bγ).[22]
Компартментализация трансляции обеспечивает высокую скорость биосинтеза белка и широкие возможности регуляции этого процесса.[20]
См. также
Примечания
- Литература
- Другие источники
- ↑ Spirin A.S. Ribosomes. Kluwer Academic/Plenum Publishers, New York. 1999.
- ↑ Hellen C.U., Sarnow P. Internal ribosome entry sites in eukaryotic mRNA molecules (англ.) // Genes Dev. : journal. — 2001. — Vol. 15, no. 13. — P. 1593—1612. — doi:10.1101/gad.891101. — PMID 11445534. Архивировано 27 сентября 2007 года.
- ↑ Shirokikh N.E., Spirin A.S. Poly(A) leader of eukaryotic mRNA bypasses the dependence of translation on initiation factors. (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2008. — Vol. 105, no. 31. — P. 10738—10743. — doi:10.1073/pnas.0804940105. — PMID 18658239. Архивировано 15 декабря 2016 года.
- ↑ 1 2 Gallie D. R. Translational control in plants and chloroplasts // Control, 2007, pp. 747—774
- ↑ 1 2 Hinnebusch A. G., Dever T. E., Asano K. Mechanism of translation initiation in the yeast Saccharomyces cerevisiae // Control, 2007, pp. 225-268
- ↑ 1 2 Pestova T. V., Hellen C. U., Shatsky I. N. The mechanism of translation initiation in eukaryotes // Control, 2007, pp. 87-128
- ↑ Hinnebusch A.G. (2006) «eIF3: A versatile scaffold for translation initiation complexes», Trends in Biochemical Science 31, 553—562
- ↑ Wei Z., Zhang P., Zhou Z., Cheng Z., Wan M. and Gong W. (2004) «Crystal structure of human eIF3k, the first structure of eIF3 subunits», Journal of Biological Chemistry 279, 34983-34990
- ↑ ElAntak L., Tzakos A.G., Locker N. and Lukavsky P.J. (2007) «Structure of eIF3b RNA recognition motif and its interaction with eIF3j: structural insights into the recruitment of eIF3b to the 40S ribosomal subunit», Journal of Biological Chemistry 282, 8165-8174
- ↑ Fraser C.S., Lee J.Y., Mayeur G.L., Bushell M., Doudna J.A. and Hershey J.W. (2004) «The j-subunit of human translation initiation factor eIF3 is required for the stable binding of eIF3 and its subcomplexes to 40S ribosomal subunits in vitro», Journal of Biological Chemistry 279, 8946-8956
- ↑ Kolupaeva V.G., Unbehaun A., Lomakin I.B., Hellen C.U.T. and Pestova T.V. (2005) «Binding of eukaryotic initiation factor 3 to ribosomal 40S subunits and its role in ribosomal dissociation and antiassociation», RNA 11, 470—486
- ↑ Lomakin I.B., Kolupaeva V.G., Marintchev A., Wagner G. and Pestova T.V. (2003) «Position of eukaryotic initiation factor eIF1 on the 40S ribosomal subunit determined by directed hydroxyl radical probing», Genes and Development 17, 2786—2797
- ↑ Pestova T.V. and Kolupaeva V.G. (2002) «The roles of individual eukaryotic translation initiation factors in ribosomal scanning and initiation codon selection», Genes and Development 16, 181—186
- ↑ Maag D. and Lorsch J.R. (2003) «Communication between eukaryotic translation initiation factors 1 and 1A on the yeast small ribosomal subunit», Journal of Molecular Biology 330, 917—924
- ↑ Chen J., Tsai A., O'Leary S. E., Petrov A., Puglisi J. D. Unraveling the dynamics of ribosome translocation // Curr Opin Struct Biol. — 2012. — Т. 22, вып. 6. — С. 804—814. — doi:10.1016/j.sbi.2012.09.004. — PMID 23142574.
- ↑ Adesnik M., Mashio F. Segregation of specific classes of messenger RNA into free and membrane-bound polysomes // Eur. J. Biochem. — 1981. — V.114. — P.271-284)
- ↑ Hesketh J. Translational cytoskeleton mechanism for targeted protein synthesis // Mol. Biol. Rep. — 1994. — 19, N.3. — P.233-244)
- ↑ Wolosewick J.J., Porter K.R. Microtrabecular lattice of the cytoplasmic ground substance // J. Cell Biol. — 1979. — V.82. — P.114-139
- ↑ Heuser J. Whatever happened to the 'microtrabecular concept'? (англ.) // Biol Cell[англ.] : journal. — 2002. — Vol. 94, no. 9. — P. 561—596. — doi:10.1016/S0248-4900(02)00013-8. — PMID 12732437.
- ↑ 1 2 Негруцький Б. С. Організація білкового синтезу у вищих еукаріотів. Київ, Обереги, 2001, 165с.
- ↑ Filonenko V.V., Deutscher M.P. Evidence for similar structural organization of the multienzyme aminoacyl-tRNA synthetase complex in vivo and in vitro // J. Biol. Chem. — 1994. — 269, N.26. — P.17375-17378
- ↑ Janssen G.M.C., van Damme H.T.F., Kriek J. et al. The subunit structure of elongation factor 1 from Artemia. Why two alpha-chains in this complex? // J. Biol. Chem. — 1994. — 269, N.50. — P.31410-31417
Литература
- Лимборская С. А. Трансляция в биологии // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б. В. Петровский. — 3-е изд. — М. : Советская энциклопедия, 1985. — Т. 25 : Тениус — Углекислота. — 544 с. : ил.
- Трансля́ция в биологии / Богданов А. А. // Тихоходки — Ульяново. — М. : Советская энциклопедия, 1977. — С. 150—151. — (Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров ; 1969—1978, т. 26).
- Acker M. G., Lorsch J. R. Mechanism of ribosomal subunit joining during eukaryotic translation initiation // Biochemical Society Transactions. — 2008. — № 36. — P. 653—657.
- Benelli D., Londei P. Begin at the beginning: evolution of translational initiation // Research in Microbiology. — 2009. — № 160. — P. 493—501.
- Jackson R. J., Hellen C. U. T., Pestova T. V. The mechanism of eukaryotic translation initiation and principles of its regulation // Nature Reviews Molecular Cell Biology. — 2010. — № 10. — P. 113—127.
- Kapp L. D., Lorsch J. R. The molecular mechanics of eukaryotic translation // Annual Review of Biochemistry. — 2004. — № 73. — P. 657—704.
- Marintchev A., Wagner G. Translation initiation: structures, mechanisms and evolution // Quarterly Review of Biophysics. — 2004. — № 37. — P. 197—284.
- Mitchell S. F., Lorsch J. R. Should I stay or should I go? Eukaryotic translation initiation factors 1 and 1A control start codon recognition // Journal of Biological Chemistry. — 2008. — № 283. — P. 27345—27349.
- Schmitt E., Naveau M., Mechulam Y. Eukaryotic and archaeal translation initiation factor 2: A heterotrimeric tRNA carrier // FEBS Letters. — 2010. — № 584. — P. 405—412.
- Sonenberg N., Hinnebusch A. G. Regulation of translation initiation in eukaryotes: mechanisms and biological targets (англ.) // Cell. — Cell Press, 2009. — No. 136. — P. 731—745.
- Translational Control in Biology and Medicine / Ed. by N. Sonenberg, J. W. B. Hershey and M. B. Mathews. — Cold Spring Harbor, NY: Cold Spring Harbor Press, 2007. — 934 p.
- Van Der Kelen K., Beyaert R., Inze D., De Veylder L. Translational control of eukaryotic gene expression // Critical Reviews in Biochemistry and Molecular Biology. — 2009. — № 44. — P. 143—168.
Для улучшения этой статьи желательно:
|