Циануровая кислота
| Циануровая кислота | |
|---|---|
 | |
| Общие | |
| Хим. формула | C3H3N3O3 |
| Физические свойства | |
| Молярная масса | 129,1 г/моль |
| Плотность | 1,758 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | (с разложение) >360 °C |
| Мол. теплоёмк. | 176,6 Дж/(моль·К) |
| Энтальпия | |
| • образования | -690,8 кДж/моль |
| Классификация | |
| Рег. номер CAS | 108-80-5 |
| PubChem | 7956 |
| Рег. номер EINECS | 203-618-0 |
| SMILES | |
| InChI | |
| RTECS | XZ1800000 |
| ChEBI | 38028 и 17696 |
| ChemSpider | 7668 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Циануровая кислота (2,4,6-тригидрокси-1,3,5-триазин) - гетероциклическая карбоновая кислота
Свойства
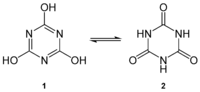
Циануровая кислота состоит из двух таутомерных форм: лактимной (собственно циануровая кислота, формула I) и лактамной (изоциануровая кислота, триазинотрион, формула II). Константы ионизации лактамной формы: K1 = 6,3·10-7, K2 = 7,8·10-11, K3 = 3,2·10-14 (водные растворы при 25oC).
Растворим в ряде растворителей:
| Растворитель (25oC) | Растворимость 9 (г/л) |
|---|---|
| Вода | 2,7 |
| Бензол | 67 |
| Диметилсульфоксид | 115 |
Малотоксичен (ПДК в воде 0,5 мг/см3). Производные циануровой кислоты более ядовиты.
Химические свойства
При нагревании выше 360oC циануровая кислота превращается в циановую кислоту. При реакции с аммиаком при 200—250oC и повышенном давлении образуется моноаммониевая соль. При взаимодействии выше 250oC образуется циурамид.
При взаимодействии с гидроксидами металлов I, II и IV групп Периодической таблицы образуются соответствующие одно-, двух- и тризамещённые соли — цианураты.
Реакция циануровой кислоты с PCl5 даёт цианурхлорид.
Получение
Синтез циануровой кислоты осуществляется в основном методом пиролиза мочевины:
При втором способе получения мочевина нагревается в присутствии хлорирующего агента (хлор, фосген COCl2, сульфурилхлорид SO2Cl2:
Циануровая кислота образуется также при гидролизе цианурхлорида и меламина.
Применение
Циануровая кислота и ряд её производных используются для производства эффективных отьеливающих и дезинфицирующих средств, полимеров. Применяется как фунгицид, гербицид, антипирен, клей.
Литература
- Триптофан-Ятрохимия // Химическая энциклопедия в 5 томах. — М.: Большая Российская Энциклопедия, 1998. — Т. 5. — 784 с.

