Атом водорода
Водородный атом является атомом химического элемента водорода. Он состоит из положительно заряженного протона, который является ядром водородного атома и единственного отрицательно заряженного электрона. В общем случае, атом водорода описывается двухчастичной матрицей плотности или двухчастичной волновой функцией. Часто в квантовой механике рассматривается электрон в электростатическом поле атомного ядра. В этом случае, электрон описывается редуцированной одночастичной матрицей плотности или волновой функцией. Из-за своей простоты как проблема двух тел атом водорода имеет специальное значение в квантовой механике и релятивистской квантовой механике поскольку соответствующие уравнения допускают точное или приближенное аналитическое решения.
В 1913 Нильс Бор получил спектральные частоты водородного атома в его модели атома водорода, имеющей множество предположений и упрощений. Эти предположения не были полностью правильны, но действительно приводили к правильным значениям энергии. Результаты расчёта Бора для частот и основных значений энергии были подтверждены в 1925/26 полным квантовым-механическим анализом, который использовал уравнение Шрёдингера. Решение уравнения Шрёдингера для электрона в электростатическом поле атомного ядра может быть найдено в аналитической форме. Из него получают уровни энергии электрона и, таким образом, его частоты. Решение уравнения Шрёдингера даёт больше информации и о форме атомных орбиталей (их анизотропии) атома водорода.
Интересно отметить, в 2008 году ученые из США и Австрии опубликовали в Physical Review Letters, журнале Американского физического общества (APS), статью под названием Realization of Localized Bohr-Like Wave Packets, в которой на примере ионизованных атомов калия, показали физическую адекватность планетарной модели атома водорода Бора. То есть движение электрона осуществляется по круговым орбитам, а переход с одной разрешенной орбиты на другую осуществляется скачкообразно. Данную статью на английском можно заказать на сайте журнала Physical Review Letters. Подобное теоретическое исследование на русском языке можно посмотреть здесь
Уравнение Шрёдингера также применяется к более сложным атомам и молекулам, однако, в большинстве таких случаев, решение не является аналитическим, и необходимы компьютерные вычисления, или должны быть сделаны какие-нибудь упрощающие предположения.
Решение уравнения Шрёдингера
Решение уравнения Шрёдингера для водородного атома использует факт, что кулоновский потенциал является изотропным, то есть не зависит от направления в пространстве, другими словами обладает сферической симметрией. Хотя конечные волновые функции (орбитали) не обязательно сферически симметричны непосредственно, их зависимость от угловой координаты следуют полностью из этой изотропии основного потенциала: собственные значения оператора Гамильтона можно выбрать в виде собственных состояний оператора углового момента. Это соответствует тому факту, что угловой момент сохраняется при орбитальном движении электрона вокруг ядра. Отсюда следует, что собственные состояния гамильтониана задаются двумя квантовыми числами углового момента l и m (целые числа). Квантовое число углового момента l может принимать значения 0, 1, 2… и определяет величину углового момента. Магнитное квантовое число может принимать m = −l, .., +l определяет проекцию углового момента на (произвольно выбранную) ось z.
В дополнение к математическим выражениям для волновых функций полного углового момента и проекции углового момента, нужно найти выражение для радиальной зависимости волновой функции. В потенциале 1/r радиальные волновые функции записываются с использованием полиномов Лагерра). Это приводит к третьему квантовому числу, которое называется основное квантовое число n и может принимать значения 1, 2, 3… Основное квантовое число в атоме водорода связано с полной энергией атома. Заметим, что максимальное значение квантового числа углового момента ограничена основным квантовым числом: оно может изменяться только до n − 1, то есть l = 0, 1, …, n−1.
Из-за сохранения углового момента, состояния с тем же l, но различными m имеют ту же самую энергию (это выполняется для всех проблем с аксиальной симметрией. Кроме того, для водородного атома, состояния с тем же самым n, но разными l также вырождены (то есть, они имеют ту же самую энергию). Однако, это — определенная особенность атома водорода и не верно для более сложных атомов, которые имеют (эффективный) потенциал, отличающийся от кулоновского (из-за присутствия внутренних электронов, экранирующих потенциал ядра).
Если мы примем во внимание спин электрона, то появится последнее квантовое число, проекция углового момента собственного вращения электрона на ось Z, которая может принимать два значения. Поэтому, любое собственное состояние электрона в водородном атоме описывается полностью четырьмя квантовыми числами. Согласно обычным правилам квантовой механики, фактическое состояние электрона может быть любой суперпозицией этих состояний. Это объясняет также, почему выбор оси Z для квантования направления вектора углового момента является несущественным: орбиталь для данных l и m ', полученных для другой выделенной оси Z ', всегда представляется как подходящая суперпозиция различных состояний с разными m (но тем же самым l), которые были получены для Z.
Рассмотрим сейчас решение уравнения Шредингера для атома водорода. Так как потенциальная функция электрона в атоме водорода имеет вид , где — заряд электрона (и протона), — радиус вектор, уравнение Шредингера запишется следующим образом:
Здесь — волновая функция электрона в системе отсчёта протона, — масса электрона, где , — постоянная Планка, — полная энергия электрона, — оператор Лапласа. Так как потенциальная функция зависит от , а не от координат по отдельности, удобно будет записать лапласиан в сферической системе координат . В ней он выглядит следующим образом:
И уравнение Шредингера в сферических координатах:
В этом уравнении — функция трех переменных . Разделим его на три более простых уравнения. Для этого представим функцию как произведение трех функций: Эти функции будем обозначать просто . Тогда
- .
После подстановки значений частных производных в уравнение Шредингера получим:
Умножим уравнение на :
Второе слагаемое тут зависит только от . Перенесем его в правую часть равенства.
Равенство возможно, когда обе части равны какой-то постоянной величине. Обозначим ее . Следовательно,
Решением этого уравнения являются функции
Угол может изменяться от до Функция должна быть периодической с периодом Это возможно только если Таким образом, из решения уравнения Шредингера получаем значение одного из квантовых чисел (конечно, можно получить из него их все). Число называется магнитным квантовым числом.
Далее, интегрируя квадрат модуля функции от до и приравнивая полученное выражение получим что .
Далее рассмотрим левую часть уравнения . Она, конечно, равна :
Разделим уравнение на :
После аналогичного вышеуказанному перенесению второго слагаемого в правую часть и обозначения величины, которой равны эти части, через , получаем
Решение этих двух последних уравнений приводит к значениям и соответственно. 3 квантовых числа в совокупности полностью описывают состояния электрона в атоме водорода.
Модуль полной энергии электрона в стационарном состоянии в атоме водорода обратно пропорционален . Число называется главным квантовым числом. Оно может иметь значения от до . Его связь с энергией см. ниже.
Число называется азимутальным квантовым числом и определяет момент количества движения электрона и форму электронного облака; может иметь значения от до ( здесь относится к энергетическом уровню, на котором находится рассматриваемый электрон).
Магнитное квантовое число определяет проекцию момента количества движения на выбранную ось в магнитном поле. Эта проекция равна .
Математическое описание атома водорода
Энергетический спектр
Энергетические уровни атома водорода, включая тонкую структуру записываются в виде
- где
- — постоянная тонкой структуры
- — собственное значение оператора углового момента
Энергию можно найти в простой модели Бора, с массой электрона и зарядом электрона :
где электронвольты, джоули, постоянная Планка, диэлектрическая проницаемость вакуума.
Волновые функции
В сферических координатах волновые функции имеют вид:
где:
- — Боровский радиус.
- — обобщённые полиномы Лагерра степени — функции от .
- — сферические функции.
Угловой момент
Собственные значения для оператора углового момента:
Нахождение энергии электрона из модели Бора
Вычислим уровни энергии атома водорода без учета тонкой структуры, используя простую модель атома Бора. Для этой цели можно сделать грубое допущение электрона, двигающегося по круговой орбите на фиксированном расстоянии. Происходит это под действием кулоновской силы, равной . Тогда, после сокращения на ,
Здесь масса электрона, его скорость на орбите радиуса , диэлектрическая проницаемость вакуума (электрическая постоянная).
Отсюда кинетическая энергия электрона
где расстояние от электрона до ядра.
Потенциальная его энергия
Полная энергия, соответственно, равна
Для нахождения радиуса стационарной орбиты с номером рассмотрим систему уравнений, в которой второе есть математическое выражение первого постулата Бора :
Отсюда получаем выражение для радиуса стационарной орбиты с номером :
Радиус первой орбиты оказывается равным метра. Эта константа называется боровским радиусом.
Подставляя это значение в выражение для энергии, получим, что
Отсюда мы можем найти волновое число (по определению это обратная длина волны или число длин волн, укладывающихся на 1см) фотона, излучаемого атомом водорода за один переход из возбужденного состояния с главным квантовым числом в состояние с неким фиксированным главным квантовым числом .
где постоянная Ридберга (имеет размерность см-1).
Визуализация орбиталей атома водорода
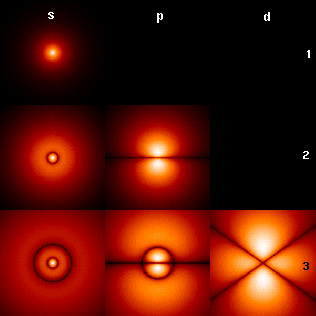
Изображение справа показывает первые несколько орбиталей атома водорода (собственные функции гамильтониана). Они представляют собой поперечные сечения плотности вероятности, величина которой отражена цветом (чёрный цвет соответствует минимальной плотности вероятности а белый — максимальной). Квантовое число углового момента l обозначено в каждой колонке, используя обычные спектроскопические обозначения (s означает l = 0; p: l = 1; d: l = 2). Главное квантовое число n (= 1, 2, 3…) отмечено справа от каждого ряда. Для всех картин магнитное квантовое число m равно 0, и сечение взято в плоскости — XZ , Z — вертикальная ось. Плотность вероятности в трёхмерном пространстве получается при вращении картинки вокруг оси Z.
Основное состояние, то есть состояние самой низкой энергии, в которой обычно находится электрон, является первым, состояние 1s (n = 1, l = 0). Изображение с большим количеством орбиталей доступно до более высоких чисел n и l. Отметим, наличие чёрных линий, которые появляются на каждой картинке за исключением первой. Они — узловые линии (которые являются фактически узловыми поверхностями в трёх измерениях). Их общее количество всегда равно n − 1, которое является суммой числа радиальных узлов (равного n — l — 1) и числа угловых узлов (равного l).
См
- Водород
- Водородоподобный атом
- Квантовая механика
- Квантовая химия
- Квантовая теория поля
- Квантовое состояние
Ссылки
- Griffiths, David J. Introduction to Quantum Mechanics. — Upper Saddle River, NJ : Prentice Hall, 1995. — ISBN ISBN 0-13-111892-7.
Параграф 4.2 описывает атом водорода, а вся глава 4 имеет отношение к теме.
- Bransden, B.H. Physics of Atoms and Molecules. — London : Longman, 1983. — ISBN ISBN 0-582-44401-2.
- Физика атома водорода на Scienceworld
- Графическое представление орбиталей
- Апплет изображающий орбитали атома водорода
- Японские ученые сфотографировали атом водорода\\ИТАР-ТАСС



























































![{\displaystyle \psi _{nlm}(r,\theta ,\phi )={\sqrt {{\left({\frac {2}{na_{0}}}\right)}^{3}{\frac {(n-l-1)!}{2n[(n+l)!]^{3}}}}}{\cdot }\exp {\left({-{\frac {r}{na_{0}}}}\right)}{\cdot }{\left({\frac {2r}{na_{0}}}\right)}^{l}L_{n-l-1}^{2l+1}{\left({\frac {2r}{na_{0}}}\right)}\cdot Y_{l,m}(\theta ,\phi )}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/7d4671f9d13cb005c8266ddef7faf55d706bb24b)



























