Чёрная субстанция
| Чёрная субстанция | |
|---|---|
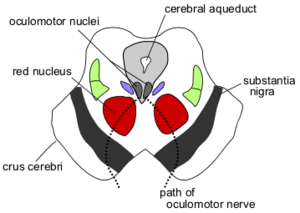 Поперечное сечение среднего мозга на уровне четверохолмия (точнее Superior colliculus). Отчетливо видны красные ядра (nuclei rubri), ядро глазодвигательного нерва (nucleus nervus oculomotorius), водопровод мозга (aqueductus cerebri), пунктиром отмечен путь глазодвигательного нерва(nervus oculomotorius). | |
| Часть | Среднего мозга, базальные ганглии. |
| Система | Экстрапирамидная |
| Каталоги | |
Чёрная субстанция (лат. Substantia nigra) — является составной частью экстрапирамидной системы, находящаяся в области четверохолмия среднего мозга. Играет важную роль в регуляции моторной функции, тонуса мышц, осуществлении статокинетической функции участием во многих вегетативных функций: дыхания, сердечной деятельности, тонуса кровеносных сосудов[1].
Несмотря на то, что чёрная субстанции представляет собой непрерывную полосу в срезах среднего мозга, анатомические исследования показали, что на самом деле, она состоит из двух частей с очень различными связями и функциями: pars compacta и pars reticulata. Pars compacta служит в основном в качестве приёмника — в цепи базальных ганглиев, поставляя дофамин полосатому телу. Pars reticulata, с другой стороны, служит в основном в качестве трансмиттера, передавая сигналы от базальных ганглиев к другим многочисленным структурам мозга.
Анатомия
Представляет собой скопление нервных клеток. Расположена в дорсальной части ножки на границе с базальной частью среднего мозга. Substantia nigra простирается на всем протяжении ножки мозга от моста до промежуточного мозга. Люди имеют две Substantiae nigrae, по одной, на каждую сторону (левую и правую) от средней линии мозга.
Клетки этой субстанции богаты пигментом меланином, который и придаёт ей характерный тёмный цвет. В чёрной субстанции различают дорсально расположенный компактный слой (pars compacta) и вентральный (pars reticulata) — сетчатый слой[2]. Pars compacta лежит медиальнее pars reticulata. Иногда упоминается и третий латеральный слой — pars lateralis, хотя его обычно классифицируют как часть pars reticulata. Pars reticulata и внутренняя часть бледного шара разделяются внутренней капсулой.
Нейроны substantia nigra получают многочисленные проекции от нервных клеток базальных ганглиев. В свою очередь они образуют синаптические связи с нейронами ретикулярных ядер ствола мозга и базальных ганглиев[3]. Нейроны, составляющие компактный отдел имеют полихимическую природу. В ретикулярной части чёрной субстанции выявлено большое количество нейронов, содержащих ГАМК, в компактной части — дофамин. Кроме того, в чёрной субстанции имеются различные нейропептиды. Данная структура широко связана с различными отделами центральной нервной системы. Но особенно тесно чёрная субстанция функционально связана с базальными ганглиями (полосатое тело и бледный шар), а также анатомически — со зрительными буграми.
Чёрная субстанция, являясь филогенетически довольно древним образованием, имеет сложную структуру и обильное кровоснабжение, что говорит о высокой роли её компонентов в системе координации жизнедеятельности[4].
Pars reticulata
Pars reticulata имеет сильное сходство, как структурное, так и функциональное, с внутренней частью бледного шара. Нейроны бледного шара, как и в pars reticulata в основном ГАМКергические.
Афферентные пути
Pars reticulata связана с полосатым телом. Связь представлена двумя маршрутами, известные как прямой и косвенный (непрямой) пути. Прямой путь от стриатума к сетчатой части чёрной субстанции и медиальному бледному шару образован тормозными ГАМКергическими волокнами. Непрямой путь организован сложнее. Функция его заключается в подавлении возбуждающего влияния таламуса на другие отделы моторной коры. Первое звено этого пути — тормозные ГАМКергические проекции стриатума на латеральный бледный шар. Латеральный бледный шар посылает тормозные ГАМКергические волокна к субталамическому ядру. Выходы субталамического ядра представлены возбуждающими глутаматергическими волокнами — часть их возвращается к латеральному бледному шару, другие направляются к сетчатой части чёрной субстанции и медиальному бледному шару. Прямые и косвенные пути происходят из различных подмножеств клеток полосатого тела: они тесно перемешаны, но выражают различные типы дофаминовых рецепторов, а также показывают что, у них имеются нейрохимические различия.
Эфферентные пути
Существуют значительные проекции в таламусе (вентрально-латеральных и передних вентральных ядер), четверохолмии, хвостатых ядрах, происходящие из Pars reticulata(нигроталамические пути), которые используют ГАМК в качестве нейротрансмиттера.
Pars compacta
Pars compacta чёрной субстанции состоит из дофаминергических нейронов. Эти нейроны афферентные и связываются с другими структур мозга: хвостатым ядром и скорлупой, которые входят в группу под названием полосатое тело. Это позволяет высвобождение дофамина в этих структурах.
Физиология
Чёрная субстанции играет важную роль, благодаря ей осуществляются функции: движения глаз, она регулирует и координирует мелкие и точные движения, в частности, пальцев; координирует процессы жевания и глотания. Имеются данные о роли чёрной субстанции в регуляции многих вегетативных функций: дыхания, сердечной деятельности, тонуса кровеносных сосудов. Электростимуляция чёрной субстанции вызывает увеличение артериального давления, частоты сердечных сокращений, частоты дыхательных движений.
Pars reticulata
Pars reticulata чёрной субстанции является важным процессовым центром в базальных ганглиях. ГАМКергические нейроны в Pars reticulata передают окончательные обработанные сигналы базальных ганглиев в таламус и четверохолмие. Кроме того, Pars reticulata ингибирует дофаминергическую активность в Pars compacta через коллатерали аксонов, хотя и функциональная организация этих связей остается неясным.
Pars compacta
Наиболее известная функции Pars compacta является — управление движениями, однако роль чёрной субстанции в управлении движениями тела является косвенной; электрическая стимуляция чёрной субстанции не приводит к движениям тела. Также, это ядро отвечает за обеспечение производства дофамина, который поставляется другим структурам мозга, посредством дофаминергических нейронов. Функция дофаминовых нейронов в Pars compacta чёрной субстанции является сложной.
Патологическая физиология
Чёрная субстанция имеет решающее значение в развитии многих заболеваний, включая болезнь Паркинсона. В чёрной субстанции расположены тела нейронов, аксоны которых, составляющие нигростриарный путь, проходят через ножки мозга, внутреннюю капсулу и оканчиваются в неостриатуме в виде широкого сплетения терминальных микровезикул с высоким содержанием дофамина. Именно этот путь является тем местом в мозге, поражение которого приводит к формированию синдрома паркинсонизма[5].
Болезнь Паркинсона

Болезнь Паркинсона является нейродегенеративным заболеванием, характеризующееся в гибели дофаминергических нейронов в pars compacta чёрной субстанции. Для болезни Паркинсона характерны двигательные нарушения: тремор, гипокинезия, мышечная ригидность, постуральная неустойчивость, а также вегетативные и психические расстройства[6] — результат снижения тормозящего влияния бледного шара (паллидума), расположенного в переднем отделе головного мозга, на полосатое тело (стриатум). Повреждение нейронов паллидума приводит к «торможению торможения» периферических двигательных нейронов[6] (мотонейронов спинного мозга). На данный момент болезнь неизлечима, однако существующие методы консервативного и оперативного лечения позволяют значительно улучшить качество жизни больных[6]. С помощью позитронно-эмиссионной томографии доказано, что темпы дегенерации нейронов чёрной субстанции при болезни Паркинсона намного выше, чем при нормальном старении[7].
До сих пор неизвестны причины смерти дофаминергических нейронов в pars compacta.
Шизофрения
Известно, что повышение уровня дофамина участвует в развитии шизофрении. Однако, большая дискуссия продолжается и по сей день вокруг этой теории, которая широко известна как «дофаминовая теория шизофрении». Несмотря на разногласия, антагонисты дофамина остаются стандартными и успешными средствами лечения шизофрении. Эти антагонисты включают препараты первого поколения (типичные) антипсихотики, такие как производные бутирофенон, фенотиазин, и тиоксантена. Эти препараты были в значительной степени заменены препаратами второго поколения (атипичные) нейролептиками, такими как клозапин и палиперидон. Следует отметить, что эти препараты вообще не действуют на дофамин-продуцирующих нейроны, также и на рецепторы постсинаптических нейронов.
Другие, немедикаментозные доказательства в поддержку гипотезы дофамина, связанны с чёрной субстанции включающие структурные изменения в pars compacta, такие как сокращение размеров синаптических терминалов. Другие изменения в чёрной субстанции включают повышенную экспрессию NMDA-рецепторов в структуре и снижение экспресии дисбиндина. Дисбиндин, который был (спорно), связан с шизофренией, может регулировать высвобождение дофамина и показатель низкаой экспрессией дисбиндина в чёрной субстанции может иметь важное значение в этиологии шизофрении.

Различные независимые исследования показали, что многие лица, страдающие шизофренией, имеют повышенный поток дофамина и серотонина, поступающего в постсинаптические нейроны мозга.[8][9][10][11] Эти нейромедиаторы являются частью так называемой «системы поощрения» и вырабатываются в больших количествах во время позитивного по представлению пациента опыта типа секса, наркотиков, алкоголя, вкусной еды, а также стимуляторов ассоцированных с ними.[12] Нейробиологические эксперименты показали, что даже воспоминания о позитивном поощрении могут увеличить уровень дофамина[13][14][15], поэтому данный нейромедиатор используется мозгом для оценки и мотивации, закрепляя важные для выживания и продолжения рода действия.[16] Например, мозг лабораторных мышей вырабатывал дофамин уже даже во время предвкушения ожидаемого удовольствия.[17] Однако некоторые пациенты умышленно перенапрягают эту систему поощрения, искусственно вызывая приятные для них воспоминания и мысли снова и снова, поскольку таким образом натурально производятся нейромедиаторы хорошего настроения, теряя при этом самоконтроль.[11] Это похоже на наркотическую зависимость,[18] ведь практически все наркотики прямо или косвенно нацелены на «систему поощрения» мозга и насыщают его структуры дофамином.[19][20] Если пациент продолжает перестимулировать свою «систему поощрения», то постепенно мозг адаптируется к чрезмерному потоку дофамина производя меньше гормона и уменьшая количество рецепторов в «системе поощрения».[21] В результате, химическое воздействие на мозг уменьшается, понижая способность пациента наслаждаться вещами от которых он раньше получал удовольствие.[20] Это понижение заставляет пациента зависимого от дофамина усиливать свою «мыслительную деятельность» пытаясь привести уровень нейромедиаторов в нормальное для него состояние[11] — этот эффект известен в фармакологии как толерантность. Дальнейшее развитие толерантности может постепенно привести к очень тяжелым изменениям в нейронах и других структурах мозга, и потенциально может в долговременной перспективе нанести серьёзный ущерб здоровью мозга.[22] Современные антипсихотические препараты нацелены на блокировку функций дофамина. Но, к сожалению, эта блокировка иногда также вызывает и приступы депрессии, что может усилить зависимое поведение пациента.[23] Когнитивно-поведенческая психотерапия (КПТ), проводимая профессиональным психологом, также может помочь пациентам эффективно контролировать свои настойчивые мысли, поднять самооценку, понять причины депрессии и объяснить им долговременные негативные последствия дофаминовой зависимости.[24][25] «Дофаминовая теория» шизофрении стала очень популярной в психиатрии в связи с эффективностью атипичных антипсихотиков, блокирующих нейромедиаторы, однако многие психологи не поддерживают эту теорию, считая её «упрощенной», также существует несколько различных течений внутри сторонников теории.[8]
Повреждения чёрной субстанции
Так при перерезке билатеральные путей, идущих из чёрной субстанции в стриатум, вызывают у животных неподвижность, отказ от еды и питья, отсутствие ответов на раздражение из внешнего мира. Повреждение чёрной субстанции человека, приводит к произвольным движениям головы и рук, когда больной сидит спокойно (болезнь Паркинсона)[26]. Нередко, возникает т. н. экстрапирамидный синдром — проявление дисфункции экстрапирамидной (стриопаллидарной) системы в виде:
- мышечной гипертонии,
- гипокинезии (олигокинезии), то есть уменьшением двигательной инициативы и затруднениями при переходе из состояния покоя в состояние движения и наоборот,
- брадикинезии, замедлением движений и уменьшением их амплитуды,
- преобладанием сгибательной позы (согнутая спина, наклонённая к груди голова, согнутые в логтях и лучезапястных руки и в коленях — ноги),
- гипомимией,
- монотонной, тихой и глухой речью,
- отсутствием содружественных движений,
- гиперкинезами (тремор, торсионный спазм, атетоз, хорея, миоклонии, локализованный спазм.
При этом некоторые гиперкинезы (хореические) связаны с мышечной гипотонией[27].
Химические воздействия на чёрную субстанцию
Химические воздействия и изменения чёрной субстанции играет важную роль в области нейрофармакологии и токсикологии. Различные соединения, такие как леводопа и МФТП (метилфенилтетрагидропиридин) используются для лечения и изучения болезни Паркинсона, а также многие другие препараты оказывают влияние на substantia nigra.
Леводопа
Чёрная субстанция является главной целью химической терапии, при лечении болезни Паркинсона. Леводопа (L-ДОФА), предшественник дофамина, является наиболее часто назначаемым противопаркинсоничесим препаратом. Особенно эффективна леводопа в лечении пациентов на ранних стадиях болезни Паркинсона, хотя препарат не теряет своей эффективности с течением времени. Благодаря прохождению через ГЭБ, леводопа повышает уровень необходимого дофамина в чёрной субстанции, таким образом, облегчая симптомы болезни Паркинсона. Недостатком лечения леводопы является то, что она устраняет симптомы болезни Паркинсона, при котором регистрируется низкий уровень дофамина, а не с причиной — смертью дофаминергических нейронов чёрной субстанции.
МФТП
МФТП (метилфенилтетрагидропиридин) — является нейротоксином, действующим на дофаминергические клетки головного мозга, в частности в чёрной субстанции. МФТП стал широко известен в 1982 году, когда у небольшой группы людей из округа Санты-Клары (Калифорния, США) был диагностирован паркинсонизм, после использования метилфенилпропиноксипиридина (МФПП) загрязненный МФТП. Нейротоксичность МФТП объясняется нарушением обмена веществ в митохондриях дофаминергических нейронов, в результате которого образуются свободные радикалы[28].
В 1984 году Лэнгстоном (Langston) и сотрудниками были проведены опыты, доказывающие прямое влияние МФТП на блокаду образования дофамина, приводящее к болезни Паркинсона. В настоящее время это вещество используется для моделирования болезни Паркинсона, с целью её изучения и возможного лечения в лаборатории. Опыты на мышах показали, что восприимчивость к МФТП увеличивается с возрастом[29].
Кокаин
Механизм действия кокаина в мозгу человека включает в себя ингибирование обратного захвата дофамина и блокаду дофаминового транспортёра, приводящий к состоянию эйфории и психической зависимости. У лабораторных животных после однократного введения кокаина плотность дофаминовых рецепторов на постсинаптической мембране возрастала в среднем на 37 %, при повторном введении плотность рецепторов продолжала увеличиваться. В связи с постепенным нарастанием тяжести нарушения обмена дофамина при употреблении кокаина могут развиваться специфические психозы, по клиническому течению напоминающие шизофрению. Тем не менее кокаин является более активным в дофаминергических нейронах вентральной части покрышки, нежели чем в чёрной субстанции.
Инактивация чёрной субстанции может оказаться возможным для лечения кокаиновой зависимости. В исследованиях кокаиновой зависимости у крыс, инактивация чёрной субстанции с помощью имплантированных канюль позволила значительно сократить рецидивы кокаиновой зависимости.
Амфетамины
Как и кокаин, амфетамины увеличивают концентрацию дофамина в синаптической щели, тем самым усиливая реакцию постсинаптических нейронов. Кроме того, как и кокаин, вызывают нарушения функций дофамина, что способствует к привыканию.
Механизм, посредством которого амфетамины увеличивают дофамин на синаптическом уровне, является его освобождение из пресинаптических пузырьков и повышение концентрации дофамина в цитозоле пресинаптических нейронов. Высокая концентрация дофамина в пресинаптических терминалах приводит к тому, что обратный транспорт дофамина осуществляется посредстовом переносчика дофамина (DAT) и из синаптической щели.
Примечания
- ↑ Худайбердиев, Х. Х. Нейрохирургическая анатомия чёрного вещества головного мозга: автореф. дисс. … канд. мед наук / Х. Х. Худайбердиев. — Ленинград, 1970. — 15 стр
- ↑ http://www.nedug.ru/library/анатомия_головного_мозга/АНАТОМИЯ-ГОЛОВНОГО-МОЗГА-ЛЕКЦИЯ-СРЕДНИЙ
- ↑ Черная субстанция - Большая Энциклопедия Нефти и Газа, статья. Дата обращения: 17 марта 2013. Архивировано 8 апреля 2013 года.
- ↑ ОСОБЕННОСТИ МОРФОЛОГИИ ЧЕРНОЙ СУБСТАНЦИИ СРЕДНЕГО МОЗГА КРЫС. Дата обращения: 19 марта 2013. Архивировано 8 апреля 2013 года.
- ↑ Биохимия нигро-стриарной системы. Черная субстанция при паркинсонизме. Дата обращения: 19 марта 2013. Архивировано 8 апреля 2013 года.
- ↑ 1 2 3 Яхно Н. Н., Штульман Д. Р. Болезни нервной системы. — М.: Медицина, 2001. — Т. 2. — С. 76-95. — 744 с. — ISBN 5-225-04540-5
- ↑ Яхно Н. Н., Штульман Д. Р. Болезни нервной системы. — М.: Медицина, 2001. — Т. 2. — С. 76-95. — 744 с.
- ↑ 1 2 The Dopamine Hypothesis of Schizophrenia: Version III—The Final Common Pathway. Архивировано 23 августа 2011 года.
- ↑ Increased Striatal Dopamine Transmission in Schizophrenia: Confirmation in a Second Cohort. Архивировано 23 августа 2011 года.
- ↑ Presynaptic Regulation of Dopamine Transmission in Schizophrenia. Архивировано 23 августа 2011 года.
- ↑ 1 2 3 Dysconnection in Schizophrenia: From Abnormal Synaptic Plasticity to Failures of Self-monitoring. Архивировано 23 августа 2011 года.
- ↑ Ваш мозг во время секса. Архивировано 22 августа 2011 года.
- ↑ Удовольствие: дофамин. Архивировано 24 января 2012 года.
- ↑ It's all about dopamine. Архивировано 22 августа 2011 года.
- ↑ Placebo and Nocebo Effects Are Defined by Opposite Opioid and Dopaminergic Responses. Архивировано 24 января 2012 года.
- ↑ Dopamine and desire. Архивировано 22 августа 2011 года.
- ↑ Кокаиновые наркоманы могут получать удовольствие только от одного ожидания этого удовольствия. Архивировано 24 января 2012 года.
- ↑ Dopamine supersensitivity correlates with D2High states, implying many paths to psychosis. Архивировано 23 августа 2011 года.
- ↑ Мозг и наркотики. Архивировано 22 августа 2011 года.
- ↑ 1 2 Understanding Drug Abuse and Addiction. Архивировано 23 августа 2011 года.
- ↑ Addiction and Dopamine (D2) Receptor Levels (2006). Архивировано 22 августа 2011 года.
- ↑ The Science Behind Drug Use and Addiction. Архивировано 22 августа 2011 года.
- ↑ Dopamine. Архивировано 23 августа 2011 года.
- ↑ Cognitive Behavior Therapy for Schizophrenia. Архивировано 23 августа 2011 года.
- ↑ Cognitive Behavioural Therapy for OCD. Архивировано 23 августа 2011 года.
- ↑ Средний мозг - Строение и органы центральной нервной системы - Биология - BiologyGuide.ru. Дата обращения: 27 марта 2013. Архивировано 8 апреля 2013 года.
- ↑ Экстрапирамидный синдром. Дата обращения: 27 марта 2013. Архивировано 8 апреля 2013 года.
- ↑ Schmidt, N; Ferger, B (2001). "Neurochemical findings in the MPTP model of Parkinson's disease". J Neural Transm 108 (11): 1263–82. doi:10.1007/s007020100004. PMID 11768626.
- ↑ cite journal | last1 = Jackson-Lewis | first1 = V. | last2 = Przedborski | first2 = S. | year = 2007 | title = Protocol for the MPTP Mouse Model of Parkinson's Disease | journal = Nature Protocols | volume = 2 | issue = 1 | pages = 141–151 | doi = 10.1038/nprot.2006.342 | pmid = 17401348 | url = http://www.nature.com/nprot/journal/v2/n1/full/nprot.2006.342.html