Хлорсульфоновая кислота
| Хлорсульфоновая кислота | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Хлорсульфоновая кислота | ||
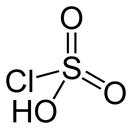
| Хим. формула | HSO3Cl | ||
| Физические свойства | |||
| Состояние | бесцветная дымящаяся жидкость | ||
| Молярная масса | 116.52 г/моль | ||
| Плотность | 1,77 (18 °C) | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -80.5 °C | ||
| • кипения | 151 °C | ||
| • разложения | 151 °C | ||
| Энтальпия | |||
| • образования | -555,2 (ж) кДж/моль | ||
| Классификация | |||
| Рег. номер CAS | [7790-94-5] | ||
| PubChem | 24638 | ||
| Рег. номер EINECS | 232-234-6 | ||
| SMILES | |||
| InChI | |||
| RTECS | FX5730000 | ||
| Номер ООН | 1754 | ||
| ChemSpider | 23040 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
[[Категория:Химические вещества с шаростержневыми моделями для экспорта на Викиданные|
 ]]
]]
Хлорсульфо́новая кислота, HSO3Cl — монохлорангидрид cерной кислоты, бесцветная, дымящая на воздухе и резко пахнущая жидкость.
Свойства
Хлорсульфоновая кислота не образует солей. Она бурно реагирует с водой, распадаясь на серную кислоту и хлороводород:
С органическими соединениями хлорсульфоновая кислота взаимодействует, образуя, в зависимости от условий, сульфоновые кислоты или их хлориды:
Благодаря этим реакциям, ClSO2OH широко применяется в качестве сульфурирующего агента в органической химии.
Родственные соединения
- Фторосульфоновая кислота FSO3H — очень сильная кислота, в незначительной степени гидролизующаяся водой.
- Бромсульфоновая кислота BrSO3H — нестабильная кислота, разлагающаяся при температуре плавления 8 °C на Br2, SO2 и H2SO4.
- Йодсульфоновая кислота неизвестна.
Получение
Получают хлосульфоновую кислоту непосредственно при взаимодействии хлороводорода с оксидом серы(VI):
или при взаимодействии концентрированной серной кислоты с трихлоридом или пентахлоридом фосфора:
Литература
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
- Ф. Коттон, Дж. Уилкинсон «Современная неорганическая химия» М.: Мир, 1969
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |