Оксид олова(II)
| Оксид олова(II) | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
оксид олова(II) | ||
| Традиционные названия | монооксид олова; олово окись(II); олово закись; олово одноокись | ||
| Хим. формула | SnO | ||
| Физические свойства | |||
| Состояние | чёрный порошок | ||
| Молярная масса | 134.71 г/моль | ||
| Плотность | 6.45 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | (при 80 кПа) 1080 °C | ||
| • кипения | 1425 °C | ||
| • разложения | 1976 ± 1 ℉[1] | ||
| • вспышки | негорюч °C | ||
| Мол. теплоёмк. | 47,8 Дж/(моль·К) | ||
| Теплопроводность | 47,8 Вт/(м·K) | ||
| Энтальпия | |||
| • образования | -285,98 кДж/моль | ||
| Давление пара | 0 ± 1 мм рт.ст.[1] | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | нерастворим | ||
| Структура | |||
| Кристаллическая структура | тетрагональная | ||
| Классификация | |||
| Рег. номер CAS | 21651-19-4 | ||
| PubChem | 88989 | ||
| Рег. номер EINECS | 244-499-5 | ||
| SMILES | |||
| InChI | |||
| RTECS | XQ3700000 | ||
| ChemSpider | 80298 | ||
| Безопасность | |||
| Токсичность | при вдыхании вызывает кашель[2] | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Оксид олова(II) — это неорганическое бинарное химическое соединение, которое существует в двух формах: стабильная, имеющая черно-синий (по другим данным коричневато-чёрный[2]) цвет и метастабильная — красный цвет[источник не указан 5363 дня]. Химическая формула — SnO. В этом соединении олово имеет степень окисления равную +2, а кислород –2.
Физические свойства
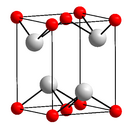
Темно-синее (почти чёрное) кристаллы, тетрагональная сингония, структура типа РbО (а = 0,3802 нм, с = 0,4837 нм, Z = 2, пространственная группа P42/nmm). При давлении выше 90 ГПа (900 тыс. атм) переходит в ромбическую модификацию (а = 0,382 нм, b = 0,361 нм, с = 0,430 нм, Z = 2, пространственная группа Рm2n).
Оксид олова является полупроводником, тип проводимости которого зависит от примесей и способа получения.
Получение
Оксид олова получают осторожным разложением в инертной атмосфере гидроокиси олова:
Из диоксида олова:
В лабораторных условиях оксид олова часто получают осторожным нагревом оксалата олова(II) в инертной атмосфере:
С помощью твёрдотельной реакции из хлорида олова(II):
Метастабильный красный оксид олова(II) можно приготовить подогревая на малом огне водный раствор аммиака с оловом2+, в результате получится осадок, состоящий из красного оксида олова(II)[источник не указан 5363 дня].
Химические свойства
Оксид олова(II) устойчив на воздухе, амфотерен с преобладанием основных свойств. Мало растворим в воде и разбавленных растворах щелочей. Растворяется в разбавленных кислотах:
и концентрированных кислотах:
Он также растворяется в сильных кислотах, давая ионные комплексы, например Sn(OH2)32+ или Sn(OH)(OH2)2+, также в менее кислотных растворах — Sn3(OH)42+.
Растворяется в концентрированных растворах щелочей и их расплавах:
Также известны другие безводные оловосодержащие соединения, например, K2Sn2O3, K2SnO2.
Диспропорционирует при нагревании:
Окисляется кислородом воздуха:
Восстанавливается до металлического олова водородом, углеродом, кремнием, бором и парами этилового спирта.[3]:
Sn и O могут образовывать соединения нестехиометрического состава.
Применение
Оксид олова(II) в подавляющем большинстве случаев используется в качестве исходного продукта в производстве других, как правило, двухвалентных, соединений олова. Может применяться также в качестве восстановителя и в создании рубинового стекла. В незначительных количествах используется в качестве этерификаторного катализатора.
Оксид церия(III) с оксидом олова(II) используется в осветительных приборах как люминофор.
Примечания
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0615.html
- ↑ 1 2 Информационный источник №1. Дата обращения: 29 марта 2010.
- ↑ Сайт www.onx.distant.ru. Дата обращения: 29 марта 2010. Архивировано 13 декабря 2007 года.






![{\displaystyle ~{\mathsf {SnO+3HCl{\xrightarrow {}}H[SnCl_{3}]+H_{2}O}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/0d888b44613e13126825fc78acdd7ef99217b83c)
![{\displaystyle ~{\mathsf {SnO+NaOH+H_{2}O{\stackrel {20^{o}C}{\rightleftarrows }}Na[Sn(OH)_{3}]}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/0afdabf8b52d2e909f28dd9f177b9a6a0ce357a0)



