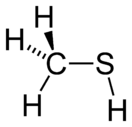
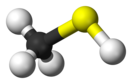
Метантиол
| Метантиол | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
метантиол | ||
| Традиционные названия | метилмеркаптан | ||
| Хим. формула | CH4S | ||
| Рац. формула | CH3SH | ||
| Физические свойства | |||
| Состояние | Газ | ||
| Молярная масса | 48.11 г/моль | ||
| Плотность | 0,9 ± 0,01 г/см³[1] | ||
| Энергия ионизации | 9,44 ± 0,01 эВ[1][3] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -123 °C | ||
| • кипения | 5.9 °C | ||
| • вспышки | 0 ± 1 ℉[1] | ||
| Пределы взрываемости | 3,9 ± 0,1 об.%[1] | ||
| Давление пара | 1,7 ± 0,1 атм[1] | ||
| Химические свойства | |||
| Константа диссоциации кислоты | ~ 10.4 | ||
| Растворимость | |||
| • в вода | 2% | ||
| • в | этанол, диэтиловый эфир | ||
| Структура | |||
| Дипольный момент | 5,1E−30 Кл·м[3] | ||
| Классификация | |||
| Рег. номер CAS | 74-93-1 | ||
| PubChem | 878 | ||
| Рег. номер EINECS | 200-822-1 | ||
| SMILES | |||
| InChI | |||
| RTECS | PB4375000 | ||
| ChEBI | 16007 | ||
| ChemSpider | 855 | ||
| Безопасность | |||
| Предельная концентрация | 0,006[2] | ||
| Фразы риска (R) | R12, R23, R50/53 | ||
| Фразы безопасности (S) | S16, S25, S33S60, S61 | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Метантиол (метилмеркаптан) CH3SH— простейший представитель тиолов, бесцветный газ с сильным отвратительным запахом, напоминающий запах гнилой капусты.
Свойства
Труднорастворим в воде, растворим в этаноле и диэтиловом эфире. Весьма огнеопасен. При высоких концентрациях негативно воздействует на центральную нервную систему. Человек способен почувствовать запах метантиола даже при концентрации 1 частица на миллион.[4]
Нахождение в природе
Метантиол образуется при различных процессах деградации серосодержащих органических соединений, в первую очередь — при гниении белков, в состав которых входят серосодержащие аминокислоты. Он находится также в человеческих испражнениях, являясь вместе со скатолом причиной их неприятного запаха.
Синтез
В промышленности метантиол синтезируют из метанола и сероводорода, используя в качестве катализатора диоксид тория, нанесенный на оксид алюминия в количестве 5 — 12 %, или кобальт — диоксид тория, при температуре 316—468 °С.
Применение
Метантиол используется в производстве аминокислоты метионина, использующейся в качестве кормовой добавки, из акролеина. На первой стадии присоединением метантиола к акролеину синтезируют 3-метилтиопропионовый альдегид:
- CH3SH + H2C=CH-CHO CH3SCH2CH2CHO
который далее используется в качестве карбонильного компонента синтеза Штреккера:
- CH3SCH2CH2CHO + HCN + NH3 CH3SCH2CH2CH(NH2)CN
- CH3SCH2CH2CH(NH2)CN + H2O CH3SCH2CH2CH(NH2)COOH
Метантиол применяется при синтезе пестицидов и фунгицидов.
Метантиол также применяется в качестве одорирующей добавки к природному газу.[5]
См. также
Примечания
- ↑ 1 2 3 4 5 http://www.cdc.gov/niosh/npg/npgd0425.html
- ↑ ГН 2.1.6.2326-08 Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест. Дополнение N 4 к ГН 2.1.6.1338-03
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Devos, M; F. Patte, J. Rouault, P. Lafort, L. J. Van Gemert (1990). Standardized Human Olfactory Thresholds. Oxford: IRL Press. p. 101. ISBN 0199631468
- ↑ Methyl Mercaptan // Schlager N., Weisblatt J., Newton D.E. — Chemical Compounds. — Thomson Gale. — 2006. — vol.2 — p.455-457
Для улучшения этой статьи желательно:
|
Это заготовка статьи по органической химии. Помогите Википедии, дополнив её. |