Целиакия
| Целиакия | |
|---|---|
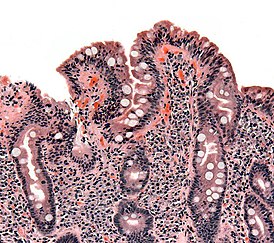 Биопсия тонкого кишечника у больного с целиакией. Видна уплощенная форма ворсинок, лейкоцитарная инфильтрация и гиперплазия крипт. | |
| МКБ-11 | DA95 |
| МКБ-10 | K90.0 |
| МКБ-10-КМ | K90.0 |
| МКБ-9 | 579.0 |
| МКБ-9-КМ | 579.0[1][2] |
| OMIM | 212750 |
| DiseasesDB | 2922 |
| MedlinePlus | 000233 |
| eMedicine | med/308 |
| MeSH | D002446 |
Целиаки́я (глютеновая энтеропатия) — мультифакториальное заболевание, нарушение пищеварения, вызванное повреждением ворсинок тонкой кишки некоторыми пищевыми продуктами, содержащими определённые белки — глютен (клейковина) и близкие к нему белки злаков (авенин, гордеин и др.) — в таких злаках, как пшеница, рожь, ячмень и овёс. Имеет смешанный аутоиммунный, аллергический, наследственный генез, наследуется по аутосомно-доминантному типу.
Синонимы: болезнь Ги—Гертера—Гейбнера, глютенэнтеропатия, кишечный инфантилизм.
В первом столетии нашей эры Аретей из Каппадокии и Целий Аврелиан описали хроническую диарею и стеаторею у детей и женщин и назвали болезнь morbus coeliacus, «кишечная болезнь». Классические симптомы целиакии у детей — диарею, истощение, анемию и отставание в развитии — опубликовал в 1888 году Сэмюэль Ги, врач Бартоломеевского госпиталя в Лондоне. В 1950 году голландский педиатр Виллем Дике впервые связал причину целиакии у детей с глютеном — растворимой в алкоголе фракцией белка, содержащейся в пшенице. В 1952 году G. McIver и J. French впервые успешно применили аглютеновую диету для лечения этого заболевания.
Общие сведения
Ранее считалось, что целиакия встречается довольно редко — с частотой 1:3000. Современные исследования населения показали, что ген, ответственный за предрасположенность к целиакии, встречается довольно часто, а само заболевание имеется примерно у 0,5-1 % населения[3]. Типичная целиакия с тяжёлыми нарушениями всасывания действительно встречается редко. У преобладающего большинства выявляются внекишечные манифестации: железодефицитная анемия, афтозный стоматит, дерматит Дюринга, остеопороз, маленький рост, задержка полового развития, бесплодие, аутоиммунный сахарный диабет 1 типа и др.[источник не указан 3025 дней] Подобная скрытая и субклиническая формы встречаются примерно на порядок чаще типичной классической целиакии.
Этиология
Механизм патологического взаимодействия глютена со слизистой оболочкой до конца не ясен. Предполагается наличие ферментного дефекта — отсутствие или недостаточность глиадинаминопептидазы или другого фермента, участвующего в расщеплении глютена. Важную роль играет иммунологическая реакция (гуморальная и клеточная) на глютен, происходящая в собственном слое слизистой оболочки тонкой кишки.
Согласно научным представлениям, сложившимся в XX столетии, целиакия (глютеновая энтеропатия) является определенным генетически заболеванием тонкой кишки, связанным с одной из фракций растительного белка глютена — глиадином. У лиц, предрасположенных к целиакии, глиадин повреждает слизистую оболочку тонкой кишки и приводит к атрофии и тяжелому нарушению всасывания. Имеются доказательства, что овёс при длительном употреблении не вызывает атрофии и может включаться в диету больных целиакией. При целиакии нарушена структура HLA-области на хромосоме 6. У больных целиакией имеется почти идентичный HLA DQ2 половой гетеродимер. Люди, имеющие DR17, несут ассоциированные с заболеванием DQ аллели на той же хромосоме, что и DR17. Установлено, что Т-лимфоциты слизистой оболочки тонкой кишки узнают только те пептиды глиадина, которые относятся к DQ молекулам и обладают свойствами антигенов. В ответ на присутствие последних значительно возрастает количество глиадин-специфических интраэпителиальных g/l форм Т-лимфоцитов CD4+ и СD8+. Узнавание антигена ведет к повышению продукции цитокинов. В биоптатах тощей кишки больных нелеченной целиакией повышена концентрация IL-10 mRNA, а содержание интерферона mRNA увеличено на 2-3 порядка.
Патофизиология
Целиакия по-видимо является мультифакторным заболеванием. Большинство людей (95 %) с диагнозом целиакия являются носителями HLA-DQ2 аллельного варианта гена, и в меньшей степени HLA-DQ8 алельного варианта гена[4]. Однако, приблизительно 20-30 % популяции без целиакии также являются носителями этих аллельных вариантов[5]. Это указывает на необходимость дополнительных факторов для развитии целиакии. Наличие рискового аллеля HLA является благоприятствующим, но не единственным условием для развития заболевания. Кроме того, приблизительно 5 % людей, у которых развивается целиакия не являются носителями вариантов HLA-DQ2 или HLA-DQ8 аллелей[6].
Генетика
Большинство людей с целиакией являются носителями одного из вариантов белка HLA-DQ[5]. Этот белок является частью рецептора главного комплекса гистосовместимости MHC II, которая участвует в иммунологическом распознавании клеток[7]. Две субъединицы HLA-DQ белка кодируются HLA-DQA1 и HLA-DQB1 генами локализованными на коротком плече шестой хромосомы человека[8].
В этой локализации присутствуют семь вариантов гена HLA-DQ (DQ2 и DQ4-DQ9). Более 95 % людей больных целиакией обладают вариантами DQ2 или DQ8. Причина, почему эти гены увеличивают риск целиакии состоит в том что рецепторы координирующиеся этими генами связываются с глиадиновыми белками более прочно, в сравнении с другими формами антиген-презентирующих рецепторов. Кроме этого, эти формы рецепторов в большей степени активируют Т-лимфоциты и приводят к активации аутоиммунных реакций[9].
Большинство людей с целиакией несут два гена гаплотипа HLA-DQ2. Этот вариант называется DQ2.5 гаплотипом. Этот гаплотип состоит из двух cходных аллелей DQA1*0501 и DQB1*0201, которые соответственно кодируют две субъединицы DQ α5 и DQ β2. У большинства людей это DQ2.5 изоформа, которая кодируется двумя хромосомами 6. Большинство людей с целиакией обладают одной копией DQ2.5 гаплотипа, если эта у человека присутствует в двух копиях то эти люди особенно подержаны целиакии, и восприимчивы к серьезным осложнениям[10].
Некоторые люди наследуют DQ2.5 от одного из родителей и дополнительный вариант гаплотипа (либо DQB1*02 или DQA1*05) от другого родителя, это увеличивает риск. В меньшей вероятность люди наследующие вариант DQA1*05 от одного родителя и DQB1*02 от другого родителя. Этот вариант DQ2.5trans, называется транс-гаплотипной ассоциации. Представители этой групы имеют сходны риск для целиакии, что и носители одиночной формы DQ2.5, но такой вариант не может быть семейным. Среди 6 % европейцев, больных целиакией не имеет формы DQ2.5 (цис или транс) или DQ8 кодируемым гаплотипом (DQA1*03:DQB1*0302), 4 % имеют DQ2.2 изоформу, и остальные 2 % не являются носителями ни DQ2 ни DQ8 гаплотипа[11].
У этих генов различная географическая распространенность. DQ2.5 распространен среди людей северной и западной Европы (Автотомия Басков и Ирландия[12] с наибольшей встречаемостью) части Африки и Индии[13], но не найдена вокруг западного тихоокеанского кольца. DQ8 более широк распространен в сравнении DQ2.5 и практически являются основным в Южной и Центральной Африки. Более 90 % людей в центральных индейцев являются носителями DQ8[14].
Также существуют сообщения о других генетических влияющих на целиакию, однако вовлеченость в патогенез заболевания изменяется в различных географических районах. Только HLA-DQ гаплотип увеличивает риск заболевания в глобальной популяции.[15] Многие из этих локусов ассоциированы с другими аутоуимнными заболеваниями. Один локус, LPP вовлечен в адгезию внеклеточного матрикса на клеточной поверхности и менее распростанненый вариант (SNP = rs1464510) увеличивает риск заболевания порядка 30 %. Этот ген достоверно ассоциирован с целиакией (p < 10−39) в Европейской популяции и США.[15]
Не полностью ясна распространенность генотипов больных целиакией в современной популяции. Характеристики заболевания и их особенности имеют большую степень наследования, должно было ожидаться что эти генотипы будут подвергаться негативной селекции в обществе где длительно развивалось сельское хозяйство (в сравнении с этим лактозная недостаточность подвергалась негативному обору, Её распространенность ~100 % в предковой получции уменьшилась до 5 % в некоторые Европейских странах. Это предположение было впервые опубликовано Симунсом в 1981 г.[16] Но сейчас эта гипотиза не подтверждается: напротив очевидна негативная селекция целиакии. Полагается частично проявление этого заболевания было предпочтительно в силу обеспечения защиты против бактериальной инфекции[17][18].
Клиническая картина
Целиакия характеризуется нарушением кишечного всасывания, суб- или атрофией слизистой оболочки тонкой кишки, положительной реакцией на аглютеновую диету (исключение из пищи продуктов из злаков, содержащих глютен). Среди клинических вариантов следует выделять истинную целиакию и синдром целиакии, который может развиться при самых разнообразных заболеваниях кишечника (аномалии развития, инфекции, продолжительный приём антибиотиков и др.). Начало целиакии нередко совпадает с введением в пищевой рацион ребенка прикормов, содержащих мучные изделия. Поэтому заболевают чаще дети в возрасте 6-12 мес. Этот период особенно опасен в плане провокации целиакии.
Появляется учащённый пенистый стул, обильный, с резким запахом, светлый или с сероватым оттенком, жирный. В кале, как правило, не обнаруживается патогенная кишечная микрофлора. Лечение диспепсии обычными средствами (антибиотики, ферментные препараты, редукция в питании и др.) эффекта не дает. Ребёнок становится вялым, бледным, теряет массу тела, снижается аппетит. Постепенно развивается дистрофия и дети приобретают типичный для целиакии вид: резкое истощение, потухший взгляд, яркие слизистые оболочки, огромных размеров живот. В ряде случаев развиваются отёки на нижних конечностях, нередки спонтанные переломы костей. Определяется псевдоасцит (скопление жидкости в атоничном кишечнике). Далее присоединяются симптомы поливитаминной недостаточности (сухость кожи, стоматит, дистрофия зубов, ногтей, волос и др.).
Как правило, при целиакии, особенно при длительном её течении, имеет место нарушенное всасывание дисахаров, жиров, витаминов, железа, кальция, нарушается транспорт цистина, обмен триптофана, то есть речь идет об универсальной мальабсорбции. В связи с этим понятен полиморфизм клинической картины. Дети страдают не только физически, но и психически (лабильность настроения, замкнутость, повышенная возбудимость, негативизм). Важным признаком заболевания при длительном его течении является низкорослость.
Течение целиакии волнообразное, нередко присоединяется вторичная инфекция, в ряде случаев — летальный исход.
Распространённость
До 1970-х годов целиакия считалась редким заболеванием, встречающимся главным образом у европейцев. Распространенность её по данным эпидемиологических исследований варьировала от 1:6000 до 1:1000 населения. Представления о распространенности целиакии изменились, когда в 1980-е годы для её диагностики стали применять серологические методы. Сначала они основывались на определении антиглиадиновых антител (АГА) в IgG, IgM и IgA. Этот метод использовали для выявления целиакии в группах с высоким риском болезни в общей популяции населения. Они недорогие, имеют достаточно высокую чувствительность, но не могут считаться полностью специфичными для целиакии. Поэтому всем лицам с повышенным титром АГА проводят биопсию, результаты которой позволяют выявлять у некоторых из них целиакию. Вскоре появились более специфические и чувствительные способы, основанные на определении антител к ретикулину и эндомизию — тканям слизистой оболочки тонкой кишки. Например, тест с IgA эндомизиальными антителами (ЭMA) очень чувствительный (93-98 %) и специфический (99-100 %). Однако он не нашел широкого применения из-за сложности получения материала, содержащего эндомизий, от приматов. Поэтому идентифицирована тканевая трансглютаминаза (ТТГ) — основной антиген эндомизия. Тест с ТТГ имеет чувствительность 95-98 % и специфичность 94-95 %, которые сравнимы со стандартным ЭMA-тестом. Для теста с ТТГ используется ТТГ-антиген, получаемый у морской свинки. Тесты с ЭМА и ТТГ считаются строго специфичными для целиакии, но окончательный диагноз болезни, учитывая необходимость пожизненного соблюдения аглютеновой диеты, должен быть обязательно подтвержден гистологическим исследованием слизистой оболочки тонкой кишки.
Массовые исследования АГА, АЭА или антител к ТТГ с последующим гистологическим изучением дуоденальных биоптатов у лиц с положительными серологическими тестами показали, что на самом деле целиакия должна быть отнесена к довольно распространенным заболеваниям тонкой кишки. Частота её достигает 1:200 — 1:100. Типичная целиакия с тяжелыми нарушениями всасывания действительно встречается редко. У преобладающего большинства диарея и симптомы малабсорбции отсутствуют, но выявляется внекишечные манифестации: железодефицитная анемия, афтозный стоматит, дерматит Дюринга, остеопороз, маленький рост, задержка полового развития, бесплодие, инсулин-зависимый диабет и др. Подобная скрытая и субклиническая формы встречаются примерно на порядок чаще типичной классической целиакии.
С помощью серологических тестов установлено, что особенно часто скрытая или малосимптомная целиакия встречается у ближайших родственников больных глютеновой энтеропатией. У части из них выявляется так называемая потенциальная целиакия (предболезнь), при которой единственным признаком являлось повышенное количество Т-лимфоцитов в поверхностном эпителии тонкой кишки с большой долей среди них и субпопуляций. Обследование больных инсулин-зависимым диабетом позволило выявить у 6,4 % из них бессимптомную целиакию[19].
Диагностика
Состояние часто диагностируется с большим опозданием, несмотря на принципиальную несложность: совокупность данных анамнеза, характерного вида больного, и, если на фоне безглютеновой диеты улучшается состояние больного, а отклонение от диеты приводит к появлению характерного для целиакии стула, предположительный диагноз может быть поставлен с определённой степенью надёжности. Для уточнения диагноза требуются: копрологическое исследование, показывающее наличие в кале большого количества жирных кислот и мыла; биохимическое исследование крови, показывающее гипопротеинемию, гипоальбуминемию, снижение концентрации холестерина и липидов, гипокальциемию, гипофосфатемию, гипосидеринемию, рентгенологическое исследование, показывающее остеопороз, горизонтальные уровни в петлях кишок, дискинезия кишечника. Окончательный диагноз устанавливается при металогическом анализе биоптатов слизистой оболочки тонкой кишки.
Дифференциальный диагноз проводят с кишечной формой муковисцидоза, дисахаридазной недостаточностью, аномалиями желудочно-кишечного тракта.
Чаще всего ложно-положительный диагноз встречается при таких заболеваниях, как диарея, синдром раздражённого кишечника.
Объективные исследования

Золотой стандарт в диагностике целиакии — эндоскопия с биопсией и серодиагностика: антиглиадиновые антитела, IgA-антитела к эндомизию, антиретикулиновые антитела[20]. В настоящее время антиглиадиновые антитела, ввиду низкой чувствительности и специфичности не рекомендуется использовать для диагностики целиакии.
Лечение
Лечение целиакии комплексное. Основа лечения — пожизненное соблюдение аглютеновой диеты (исключаются содержащие глютен хлеб, сухари, печенье, кондитерские мучные и макаронные изделия, продукты из ячменя, овса, пшеницы, ржи). Больные целиакией могут безопасно употреблять в пищу рис, бобовые, гречку, кукурузу, мясо, рыбу, птицу, овощи, фрукты, яйца и молочные продукты. Следует избегать продуктов, содержащих в составе скрытый глютен, например, некоторые колбасные изделия, йогурты, майонезы, крабовые палочки.[21]
При соблюдении аглютеновой диеты масса тела больных начинает восстанавливаться через 3 недели. Гистологические изменения в кишечнике начинают исчезать спустя 2-2,5 года. Одновременно с назначением аглютеновой диеты проводят симптоматическую терапию: витамины, препараты кальция, железа, ферментные препараты, пробиотики, массаж, гимнастика и др. Дети, страдающие целиакией, должны находиться на диспансерном наблюдении. Прогноз при соблюдении диеты и правильном лечении благоприятный.
Следует учитывать, что крахмал, содержащий следы глютена, может быть компонентом многих пищевых продуктов и лекарственных средств. Поэтому при жёсткой диете необходим контроль и за отсутствием крахмала в составе оболочек таблеток, принимаемых для терапии тех или иных проблем.
Глютен может содержаться в крупах или бобовых, которые проходят различную обработку на предприятиях (шлифовка, удаление оболочек семян и т. д.). Например, некоторые производители обычного сухого гороха указывают на упаковке о возможном содержании глютена в их продукте. Предположительно, в таких случаях попадание глютена в безопасные продукты происходит из-за использования одного и того же оборудования для обработки семян различных растений.

Общества
В разделе не хватает ссылок на источники (см. рекомендации по поиску). |
В последние десятилетия больные метаболическими заболеваниями объединяются в общества, цель которых — помочь друг другу путём обмена информацией, оказание материальной поддержки, лоббирование интересов данной категории больных в обществе. Первой общественной организацией в России, которая начала заниматься популяризацией информации о целиакии и поддержкой людей с этим заболеванием, стало Санкт-Петербургское общество больных целиакией «Эмилия» (создано в 1997 г.). Первые газеты «Жизнь без глютена» (1998—2006 гг.) http://www.celiac.spb.ru/nasha-deyatelnost/periodicheskie-izdaniya/zhizn-bez-glyutena, первый сайт на русском языке о всех аспектах целиакии и социальных проблемах больных целиакией работает с 2001 года www.celiac.spb.ru, в 2006 году издается первый журнал «Жизнь без глютена» http://www.celiac.spb.ru/nasha-deyatelnost/periodicheskie-izdaniya/zhurnal-zhizn-bez-glyutena. В 1998 году с целью информирования медицинского сообщества Санкт-Петербурга и России общество «Эмилия» организует и проводит первую международную научно-практическую конференцию, посвященную целиакии. Летом 1998 года общество «Эмилия» организует впервые отдых для семей с детьми на безглютеновой диете, создав первое 10-ти дневное безглютеновое меню для загородного оздоровительного учреждения http://www.celiac.spb.ru/nasha-deyatelnost/periodicheskie-izdaniya/detskaya-gazeta-glyuff/100-glyuf-1. По инициативе общества в Санкт-Петербурге в конце 90-х годов открываются группы с безглютеновым меню в детских садах (сегодня они есть почти во всех районах города), вводится компенсация на бесплатное питание школьников с диагнозом «целиакия». С 2012 года по инициативе общества в «Социальном кодексе» Санкт-Петербурга появляется статья о социальной поддержке детей с диагнозом «целиакия» (ежегодное единовременное пособие), с 2013 года — в «Социальный кодекс» вносится дополнение о выплате ежемесячных пособий детям, больным целиакией http://assembly.cdnvideo.ru/images/content/законопроекты/7604.pdf.
С 2001 года Санкт-Петербургское общество больных целиакией "Эмилия" является членом Европейской ассоциации обществ больных целиакией AOECS http://www.aoecs.org/members
Съезды и конференции
- 20 мая 2006 года в г. Санкт-Петербурге впервые проводился Международный день целиакии, который стал для города традиционным http://www.celiac.spb.ru/celiacday/2006.html.
См. также
Литература
- Ревнова М. О., Романовская И. Э. Целиакия: болезнь или образ жизни? — СПб.: Ольга, 2003. — 156 с.
- Лазебник Л. Б., Ткаченко Е. И., Орешко Л. С., Ситкин С. И., Карпов А. А., Немцов В. И., Осипенко М. Ф., Радченко В. Г., Федоров Е. Д., Медведева О. И., Селиверстов П. В., Соловьева Е. А., Шабанова А. А., Журавлева М. С. Рекомендации по диагностике и лечению целиакии взрослых // Экспериментальная и клиническая гастроэнтерология. — 2015. — № 5 (117). — С. 3—12.
Примечания
- ↑ Disease Ontology (англ.) — 2016.
- ↑ Monarch Disease Ontology release 2018-06-29 — 2018-06-29 — 2018.
- ↑ (Catassi C; G. Fanciulli; A. R. D’Appello et al. Antiendomysium versus Antigliadin Antibodies in Screening the General Population for Coeliac Disease. Am. J. Gastroenterol. 2000; 95: 7: 732—736)
- ↑ D. A. van Heel, J. West. Recent advances in coeliac disease (англ.) // Gut. — 2006-07-01. — Vol. 55, iss. 7. — P. 1037–1046. — ISSN 1468-3288. — doi:10.1136/gut.2005.075119.
- ↑ 1 2 Muhammed Hadithi, B. Mary E. von Blomberg, J. Bart A. Crusius, Elisabeth Bloemena, Pieter J. Kostense. Accuracy of serologic tests and HLA-DQ typing for diagnosing celiac disease // Annals of Internal Medicine. — 2007-09-04. — Т. 147, вып. 5. — С. 294–302. — ISSN 1539-3704.
- ↑ D A van Heel, J West. Recent advances in coeliac disease // Gut. — 2006-07-01. — Т. 55, вып. 7. — С. 1037–1046. — ISSN 0017-5749. — doi:10.1136/gut.2005.075119.
- ↑ Janeway CA Jr, Travers P, Walport M, et al. Immunobiology: The Immune System in Health and Disease.. — 5th edition. — New York: Garland Science, 2001.
- ↑ HLA-DQA1 major histocompatibility complex, class II, DQ alpha 1. Genetics Home Reference (25 мая 2016).
- ↑ D. A. van Heel, J. West. Recent advances in coeliac disease // Gut. — 2006-07-01. — Т. 55, вып. 7. — С. 1037–1046. — ISSN 0017-5749. — doi:10.1136/gut.2005.075119.
- ↑ Rita-Désirée Jores, Fulvia Frau, Francesco Cucca, Maria Grazia Clemente, Sandra Orrù. HLA-DQB1*0201 homozygosis predisposes to severe intestinal damage in celiac disease // Scandinavian Journal of Gastroenterology. — 2007-01-01. — Т. 42, вып. 1. — С. 48–53. — ISSN 0036-5521. — doi:10.1080/00365520600789859.
- ↑ Kati Karell, Andrew S. Louka, Simon J. Moodie, Henry Ascher, Fabienne Clot. HLA types in celiac disease patients not carrying the DQA1*05-DQB1*02 (DQ2) heterodimer: results from the European Genetics Cluster on Celiac Disease // Human Immunology. — 2003-04-01. — Т. 64, вып. 4. — С. 469–477. — ISSN 0198-8859.
- ↑ J. P. Michalski, C. C. McCombs, T. Arai, R. C. Elston, T. Cao. HLA-DR, DQ genotypes of celiac disease patients and healthy subjects from the West of Ireland (англ.) // Tissue Antigens. — 1996-02-01. — Vol. 47, iss. 2. — P. 127–133. — ISSN 1399-0039. — doi:10.1111/j.1399-0039.1996.tb02525.x.
- ↑ Gurvinder Kaur, N. Sarkar, S. Bhatnagar, S. Kumar, C. C. Rapthap. Pediatric celiac disease in India is associated with multiple DR3-DQ2 haplotypes // Human Immunology. — 2002-08-01. — Т. 63, вып. 8. — С. 677–682. — ISSN 0198-8859.
- ↑ Z. Layrisse, Y. Guedez, E. Domínguez, N. Paz, S. Montagnani. Extended HLA haplotypes in a Carib Amerindian population: the Yucpa of the Perija Range // Human Immunology. — 2001-09-01. — Т. 62, вып. 9. — С. 992–1000. — ISSN 0198-8859.
- ↑ 1 2 Patrick C. A. Dubois, Gosia Trynka, Lude Franke, Karen A. Hunt, Jihane Romanos. Multiple common variants for celiac disease influencing immune gene expression // Nature Genetics. — 2010-04-01. — Т. 42, вып. 4. — С. 295–302. — ISSN 1546-1718. — doi:10.1038/ng.543.
- ↑ Walcher, Dwain N.; Kretchmer, Norman. Food, nutrition, and evolution: food as an environmental factor in the genesis of human variability.. — Papers presented at the International Congress of the International Organization for the Study of Human Development. — USA: Masson Pub, 1981. — С. 179–199. — ISBN 0-89352-158-2.
- ↑ Carlo Catassi. Where Is Celiac Disease Coming From and Why? // Journal of Pediatric Gastroenterology and Nutrition. — Т. 40, вып. 3. — С. 279–282. — doi:10.1097/01.mpg.0000151650.03929.d5.
- ↑ Alexandra Zhernakova, Clara C. Elbers, Bart Ferwerda, Jihane Romanos, Gosia Trynka. Evolutionary and functional analysis of celiac risk loci reveals SH2B3 as a protective factor against bacterial infection // American Journal of Human Genetics. — 2010-06-11. — Т. 86, вып. 6. — С. 970–977. — ISSN 1537-6605. — doi:10.1016/j.ajhg.2010.05.004.
- ↑ Современная концепция целиакии
- ↑ van der Windt, Daniëlle A. W. M. et al. Diagnostic Testing for Celiac Disease Among Patients With Abdominal Symptoms (англ.) // Journal of the American Medical Association. — American Medical Association, 2010. — Vol. 6, iss. 306, no. 639. — doi:10.1001/jama.2010.1109.
- ↑ [Guidelines for diagnosis and treatment of celiac disease] (PDF Download Available)