Нитрат уранила
| Нитрат уранила | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Уранила нитрат | ||
| Традиционные названия | Азотнокислый уранил | ||
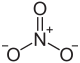
| Хим. формула | UO8N2 | ||
| Рац. формула | UO2(NO3)2 | ||
| Физические свойства | |||
| Состояние | твёрдое, кристаллическое | ||
| Молярная масса | 394,04(безводн.); 502,13(гексагидрат) г/моль | ||
| Плотность | 3,35 г/см3 (дигидрат) | ||
| Термические свойства | |||
| Температура | |||
| • разложения | 100°C | ||
| Энтальпия | |||
| • образования | 1987 кДж/моль кДж/моль | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде, 20°C | 119 г/100 мл | ||
| • в воде, 30°C | 138 г/100 мл | ||
| • в ацетоне | растворим | ||
| • в этаноле | растворим | ||
| Классификация | |||
| Рег. номер CAS | 10102-06-4 | ||
| PubChem | 24933 и 25199613 | ||
| Рег. номер EINECS | 233-266-3 | ||
| SMILES | |||
| InChI | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Урани́л азотноки́слый — неорганическое соединение, азотнокислая окись урана. Имеет формулу UO2(NO3)2 (безводный); UO2(NO3)2·6H2O (кристаллогидрат).
Роль металла в этой соли исполняет катион уранила [UO2]2+.
В настоящее время реализация уранила азотнокислого запрещена на территории Российской Федерации. Возможно аналогичный запрет действует в других странах. Также вероятно, что данный запрет распространяется на все соединения урана.
Физические свойства
Кристаллы жёлтого цвета с зеленоватым отблеском, легко растворимые в воде. Водный раствор имеет кислую реакцию. Также растворим в этаноле, ацетоне и эфире, нерастворим в бензоле, толуоле и хлороформе. Молекулярный вес безводной формы 394,04; кристаллогидрата 502,13.
Химические свойства
При нагревании кристаллы плавятся и выделяют азотную кислоту и воду. Кристаллогидрат легко выветривается на воздухе.
Характерная реакция — при действии аммиака образуется жёлтый осадок урановокислого аммония.
Обладает свойством дубить желатин. Ядовит.
Получение
Получают растворением трехокиси урана в азотной кислоте[1]:
Применение
В фотографии на основе солей серебра применяется как усилитель негативов и для тонирования готовых отпечатков (рецепт на основе азотнокислого уранила окрашивает фотоснимок в красно-коричневые тона). При этом часть серебра в изображении заменяется на железосинеродистый уранил (UO2)2[Fe(CN)6].
Реакции протекают по уравнениям:
В 60-е годы XX века в СССР азотнокислый уранил свободно продавался в фотомагазинах. Входил в состав промышленно выпускаемых усилителей, применяемых в фотопечати, в частности, ОРВО 604.
Примечания
- ↑ Карякин, 1974, с. 366.
Литература
- Волгин А. Г. Фотография. 1000 рецептов. — М.: Химия, 1993.
- Карякин Ю. В., Ангелов И. И. Чистые химические вещества. — М.: Химия, 1974. — 408 с.
- Мархилевич К. И. , Яштолд-Говорко В. А. Фотографическая химия. — М.: Искусство, 1956.


![{\displaystyle {\mathsf {4Ag+4K_{3}[Fe(CN)_{6}]=3K_{4}[Fe(CN)_{6}]+Ag_{4}[Fe(CN)_{6}]}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/07395a0192e55d918edb3b45320e8df31d73a982)
![{\displaystyle {\mathsf {Ag_{4}[Fe(CN)_{6}]+2UO_{2}(NO_{3})_{2}=4AgNO_{3}+(UO_{2})_{2}[Fe(CN)_{6}]}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/27c79c58c97f11ca147db5f1e9b4ba91b3ddcfd1)