Фторид серы(VI)
| Фторид серы(VI) | |||
|---|---|---|---|
| |||
| Общие | |||
| Традиционные названия | гексафторид серы, шестифтористая сера, элегаз | ||
| Хим. формула | SF6 | ||
| Физические свойства | |||
| Состояние | газ | ||
| Молярная масса | 146,06 г/моль | ||
| Плотность |
Газ: 6,164 г/л Жидкость: 1,33 г/см³ |
||
| Энергия ионизации | 19,3 ± 0,1 эВ[1] и 15,33 эВ[2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −50,8 °C | ||
| • сублимации | −83 ± 1 ℉[1] и −63,8 °C[2] | ||
| • кипения |
сублимация при −63,9 °C |
||
| Мол. теплоёмк. | 97,15 Дж/(моль·К) | ||
| Теплопроводность | 0,012058 Вт/(м·K) | ||
| Энтальпия | |||
| • образования | −1219 кДж/моль | ||
| Давление пара | 21,5 ± 0,1 атм[1] | ||
| Структура | |||
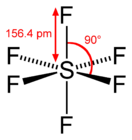
| Координационная геометрия | октаэдрическая | ||
| Кристаллическая структура | орторомбическая | ||
| Дипольный момент | 0 Д | ||
| Классификация | |||
| Рег. номер CAS | 2551-62-4 | ||
| PubChem | 17358 | ||
| Рег. номер EINECS | 219-854-2 | ||
| SMILES | |||
| InChI | |||
| RTECS | WS4900000 | ||
| ChEBI | 30496 | ||
| Номер ООН | 1080 | ||
| ChemSpider | 16425 | ||
| Безопасность | |||
| Токсичность | малотоксичен | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Гексафторид серы (также элегаз или шестифтористая сера, SF6) — неорганическое вещество, при стандартных условиях представляет собой тяжёлый газ (в 5 раз тяжелее воздуха). Соединение было впервые получено и описано в 1900 году Анри Муассаном в ходе работ по изучению химии фтора.
Методы получения
Возможно получать гексафторид серы из простых веществ:
Также гексафторид серы образуется при разложении сложных фторидов серы:
Физико-химические свойства
Практически бесцветный газ, без запаха и вкуса. Обладает высоким пробивным напряжением (89 кВ/см — примерно в 3 раза выше, чем у воздуха при нормальном давлении).
Плохо растворим в воде (1 объём SF6 в 200 объёмах воды), этаноле и диэтиловом эфире[3], хорошо растворим в нитрометане.
Плотность элегаза при температуре 273 K и давлении 0,1 МПа составляет 6,56 кг/м³. Относительная диэлектрическая проницаемость — 1,0021. Полное число степеней свободы молекулы элегаза равно 21, из них три степени свободы — в поступательном движении, три — во вращательном, а остальные — в колебательном. Диаметр молекулы равен 5,33 Å.
Термодинамические величины
| Свойство | Значение при н. у. (газ) |
|---|---|
| Энтальпия образования | −1219 кДж/моль |
| Энтропия образования | 291,6 Дж/(моль·К) |
| Теплоёмкость | 97,15 Дж/(моль·К)[4] |
| Теплопроводность | 12,058 мВт/(м·К)[4] |
| Критическая температура | 318,7 К |
| Критическое давление | 3,71 МПа |
Химические свойства
Гексафторид серы — достаточно инертное соединение, не реагирует с водой, вероятно, из-за кинетических факторов. Не реагирует также с растворами HCl и NaOH[5], однако при действии восстановителей могут протекать некоторые реакции.
В составе молекулы газа 21,95 % серы и 78,05 % фтора по массе.
Взаимодействие с металлическим натрием проходит только при нагревании, однако уже при 64 °C взаимодействует с раствором натрия в аммиаке:
Гексафторид серы реагирует с литием с выделением большого количества тепла:
При этом продукты реакции — элементарная сера и фторид лития — имеют меньший объём, чем исходные вещества, что нашло применение в некоторых экзотических тепловых двигателях (см. ниже).
С водородом и кислородом гексафторид не реагирует. Однако, при сильном нагревании (до 400 °C) SF6 взаимодействует с сероводородом, а при 30 °C — с иодоводородом:
При повышенном давлении и температуре около 500 °C SF6 окисляет PF3 до PF5:
Применение
- как изолятор и теплоноситель в высоковольтной электротехнике;
- как технологическая среда в электронной и металлургической промышленности;
- в системах газового пожаротушения в качестве пожаротушащего вещества;
- как хладагент благодаря высокой теплоёмкости, низкой теплопроводности и низкой вязкости[6];
- для улучшения звукоизоляции в стеклопакетах;
- в полупроводниковой промышленности для плазмохимического травления кремния;
- как окислитель в некоторых экзотических тепловых двигателях — например, в паротурбинной установке американской малогабаритной 324-мм противолодочной торпеды Mark 50, где он используется для окисления металлического лития.
При вдыхании наблюдается эффект пониженной тональности голоса, противоположный действию гелия[7].
Применение в электротехнике
Название «элегаз» шестифтористая сера получила от сокращения «электрический газ». Уникальные свойства элегаза были открыты в СССР, его применение также началось в Советском Союзе. В 30-х годах известный учёный Б. М. Гохберг в ЛФТИ исследовал электрические свойства ряда газов и обратил внимание на некоторые свойства шестифтористой серы SF6 (элегаза)[8]. Потребность в элегазе появилась в стране в начале 1980-х годов и была связана с разработкой и освоением электрооборудования для передач постоянного тока сверхвысокого напряжения. Его промышленное производство в РФ было освоено в 1998 году на Кирово-Чепецком химическом комбинате[9].
Электрическая прочность при атмосферном давлении и зазоре 1 см составляет 89 кВ/см. Характерным является очень большой коэффициент теплового расширения и высокая плотность. Это важно для энергетических установок, в которых проводится охлаждение каких-либо частей устройства, так как при большом коэффициенте теплового расширения легко образуется конвективный поток, уносящий тепло[10].
В центре молекулы элегаза расположен атом серы, а на равном расстоянии от него в вершинах правильного октаэдра располагаются шесть атомов фтора. Это определяет высокую эффективность захвата электронов молекулами, их относительно большую длину свободного пробега и слабую реакционную способность. Поэтому элегаз обладает высокой электрической прочностью.
Элегаз безвреден в смеси с воздухом. Однако вследствие нарушения технологии производства элегаза или его разложения в аппарате под действием электрических разрядов (дугового, коронного, частичных), в элегазе могут возникать чрезвычайно активные в химическом отношении и вредные для человека примеси, а также различные твёрдые соединения, оседающие на стенах конструкции. Интенсивность образования таких примесей зависит от наличия в элегазе примесей кислорода и особенно паров воды.
Некоторое количество элегаза в электротехнической аппаратуре также разлагается в процессе нормальной работы. Например, коммутация тока 31,5 кА в выключателе 110 кВ приводит к разложению 5—7 см³ элегаза на 1 кДж выделяемой в дуге энергии.
Стоимость элегаза довольно высока, однако он нашёл достаточно широкое применение в технике, особенно в высоковольтной электротехнике. Он прежде всего используется как диэлектрик, то есть в качестве основной изоляции для комплектных распределительных устройств, высоковольтных измерительных трансформаторов тока и напряжения и др[11]. Также элегаз используется как среда дугогашения в высоковольтных выключателях[12].
Основные преимущества элегаза перед его основным «конкурентом», трансформаторным маслом, это:
- взрыво- и пожаробезопасность;
- снижения массо-габаритных показателей конструкции за счёт уменьшения изоляционных промежутков и улучшенных условий охлаждения токоведущих частей[источник не указан 4148 дней].
Регламентирующие стандарты
- IEC 60376:2005 — Технические условия на элегаз (SF6) технического сорта для электрического оборудования.
- IEC 60480:2004 — Руководство по проверке и обработке серы шестифтористой (SF6), взятой из электротехнического оборудования, и технические условия на её повторное использование.
- EN 60376:2005 — Технические условия на элегаз (SF6) технического сорта для электрического оборудования.
- EN 60480:2004 — Руководство по проверке и обработке элегаза (SF6), взятого из электротехнического оборудования, и технические условия на его повторное использование.
Вредное воздействие
По степени воздействия на организм человека относится к малоопасным веществам (4-й класс согласно ГОСТ 12.1.007-76).
Имеется возможность отравления продуктами распада элегаза (низшими фторидами), образующимися, например, при работе дугогасительных камер в высоковольтных выключателях.
Потенциал разрушения озонового слоя ODP = 0.
Сильнейший известный парниковый газ, потенциал глобального потепления GWP = 24 900. Из-за небольших объёмов изготовления вклад в глобальное потепление не превышает 0,2 %. Регламентируется Киотским протоколом.
Интересные факты
- Если наполнить гексафторидом серы открытый сверху сосуд (так как газ тяжелее воздуха, то он не будет «выливаться» из сосуда) и поместить туда лёгкую лодочку, сделанную, например, из фольги, то лодочка будет держаться на поверхности и не «утонет». Этот опыт был показан в передаче «Разрушители легенд» как фокус с «прозрачной водой»[14]. Также, из-за высокой плотности, скорость звука в этом газе значительно ниже, чем в воздухе, что приводит к комичному эффекту при вдыхании газа — голос становится очень низким и грубым, подобно голосу Дарта Вейдера. Опыт также демонстрировался в передаче «Разрушители легенд». Аналогичный эффект создаёт и ксенон. А гелий — который в 6 раз легче воздуха — при вдыхании наоборот создаёт тонкий и писклявый голос.
Примечания
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0576.html
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Свойства гексафторида серы на сайте «Химик.ру»
- ↑ 1 2 Sulfur hexafluoride. Air Liquide Gas Encyclopedia. Дата обращения: 22 февраля 2013.
- ↑ Успехи химии, 1975, Том 44, Номер 2, Страницы 193—213.
- ↑ Применение шестифтористой серы
- ↑ Фрагмент передачи «Разрушители мифов»
- ↑ Гохберг Б. М. Ленинградский физико-технический институт Академии наук СССР // Успехи физических наук. — 1940. — Т. XXIV, вып. 1. — С. 11-20. См. стр. 16-17, раздел «Электрическая прочность газов»
- ↑ Уткин В. В. Завод у двуречья. Кирово-Чепецкий химический комбинат имени Б. П. Константинова: строительство, развитие, люди. — Киров: ОАО «Дом печати — Вятка», 2007. — Т. 4 (1973—1992), часть 1. — С. 66—67. — 144 с. — 1000 экз. — ISBN 978-5-85271-293-6.
- ↑ Коробейников С.М., д.ф.м.н., профессор. Диэлектрические материалы. 4.1.2. Электроотрицательные газы, применение газообразных диэлектриков. Дата обращения: 2 июня 2011. Архивировано 20 февраля 2012 года.
- ↑ ЗВА :: Измерительные трансформаторы с газовой изоляцией
- ↑ Применение SF6 в высоковольтной электронике.
- ↑ Элегаз. Свойства
- ↑ Выпуск 105. Вирусное видео. 6 сезон
Литература
- Гохберг Б. М. Элегаз — электрическая газовая изоляция // «Электричество». — 1947. — № 3. — С. 15.
См. также
- Тетрафторид серы — SF4
- Декафторид дисеры — S2F10