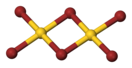
Бромид золота(III)
| Бромид золота(III) | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
Бромид золота (III) | ||
| Традиционные названия | Трибромид золота | ||
| Хим. формула | AuBr3 | ||
| Физические свойства | |||
| Состояние | тёмно-коричневое твёрдое вещество | ||
| Молярная масса | 436,69 г/моль | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 97.5 °C | ||
| • разложения | > 200 °C | ||
| Классификация | |||
| Рег. номер CAS | 10294-28-7 | ||
| PubChem | 82525 и 11373975 | ||
| Рег. номер EINECS | 233-654-2 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 30079 | ||
| ChemSpider | 9548892 и 74477 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Бромид золота(III) (трибромид золота) — бинарное неорганическое химическое соединение золота с бромом.
История
Первые упоминания об исследованиях галогенидов золота встречаются в начале XIX века[1][2][3][4].
Физические свойства
Кристаллическое вещество, тёмно-коричневые блестящие пластинки[5], цвет — от тёмно-красного до черного.
Растворим в воде, эфире, броме, бромоформе, метилацетате и SbCl3[5].
Мало растворим в сероуглероде и четыреххлористом углероде[5].
Структура
Эмпирическая формула AuBr3, но представляет собой димер состава Au2Br6.
Химические свойства
При нагревании разлагается на бромид золота(I) и бром[5].
Бромид золота(III) является кислотой Льюиса и легко образует комплексы. Например, в бромистоводородной кислоте димер Au2Br6 растворяется с образованием кислоты HAuBr4.
Во влажном воздухе AuBr3 быстро гидролизуется, горячей водой разлагается.
Синтез
Бромид золота(III) может быть получен:
- прямым синтезом из простых веществ при 140 °С и избытке брома (жидкого, паров или бромной воды):
- 2Au + 3Br2 → Au2Br6 (реакция начинается уже при обычной температуре[5])
- обменной реакцией:
- Au2Cl6 + 6HBr → 6HCl + Au2Br6
Применение
Бромид золота(III) используется в качестве катализатора в различных реакциях, интересный вариант использования — в реакции Дильса-Альдера. В частности, соединение катализирует реакцию между енильными и карбонильными соединениями с образованием шестичленных циклов:
Другой пример использования AuBr3 в качестве катализатора — в реакциях нуклеофильного замещения:
Токсичность
Как и другие соединения золота, при длительном контакте бромид золота(III) вызывает у человека специфические аллергические дерматиты и экземы, проявляющиеся в виде рецидивирующих папулезных высыпаниях на кистях, предплечьях и лице[6].
Источники
- И. Л. Кнунянц. Краткая химическая энциклопедия т. 2, М.: Советская энциклопедия, 1963, с. 119
- И. Л. Кнунянц. Краткая химическая энциклопедия т. 2, М.: Советская энциклопедия, Москва, 1990, с. 170
Ссылки
- Важнейшие соединения золота
- Таблица неорганических и координационных соединений
- Gold(III) bromide (англ.)
Примечания
- ↑ Lengefield, F. American Chemical Journal 1901, vol. 26, pp. 324 (англ.)
- ↑ Thomsen, J. J. prakt. Chem. 1876, vol. 13, pp. 337 (англ.)
- ↑ Schottländer, Ann. Chem. (Liebig), vol. 217, pp. 312 (нем.)
- ↑ Krüss, G. Ber. d. chem. Ges. 1887, vol. 20, pp. 2634 (нем.)
- ↑ 1 2 3 4 5 Важнейшие соединения золота. Дата обращения: 20 января 2012. Архивировано из оригинала 4 февраля 2013 года.
- ↑ Лазарев Н. В. Вредные вещества в промышленности, Л., «Химия», 1977, т. III, с. 342