Плазмиды

Плазми́ды (англ. plasmids) — небольшие молекулы ДНК, физически обособленные от хромосом и способные к автономной репликации. Главным образом плазмиды встречаются у бактерий, а также у некоторых архей и эукариот (грибов и высших растений). Чаще всего плазмиды представляют собой двухцепочечные кольцевые молекулы. Несмотря на способность к размножению, плазмиды, как и вирусы, не рассматриваются в качестве живых организмов[1].
Размеры плазмид варьируют от менее чем 1 тысячи до 400—600 тысяч пар оснований (п. о.)[2]. Некоторые плазмиды содержатся в клетке в количестве одной-двух копий, другие — в количестве нескольких десятков. Плазмиды разных классов могут сосуществовать в клетке.
В природе плазмиды обычно содержат гены, повышающие приспособленность бактерий к окружающей среде (например, обеспечивают устойчивость к антибиотикам). Нередко они могут передаваться от одной бактерии к другой того же вида, рода, семейства и даже между клетками бактерий и растений, являясь таким образом средством горизонтального переноса генов. Перенос плазмиды в клетку может осуществляться двумя путями: либо при непосредственном контакте клетки-хозяина с другой клеткой в процессе конъюгации, либо путём трансформации, то есть захвата экзогенной ДНК из внешней среды.
Искусственные плазмиды используются как векторы в клонировании ДНК, причём благодаря их способности к репликации обеспечивается возможность репликации рекомбинантной ДНК[англ.]* в клетке-хозяине.
Физические характеристики
Размеры и численность

Величина плазмид различна. Если самые маленькие плазмиды содержат менее 2 тысяч пар оснований, то так называемые мегаплазмиды включают сотни тысяч пар оснований (обычно до 600 тыс.). В этом случае уже сложно провести чёткую границу между мегаплазмидой и минихромосомой[англ.]. Некоторые виды бактерий могут одновременно содержать множество различных плазмид, так что их суммарный генетический материал превосходит по размеру таковой у самой бактерии. Например, симбиотическая почвенная бактерия Sinorhizobium meliloti[англ.] содержит 3 репликона размером 3,65, 1,68 и 1,35 миллиона п. о. (мегабаз) соответственно вдобавок к её собственной хромосоме (6,69 мегабазы)[3].
Мелкие плазмиды, содержащиеся в клетке в большом количестве копий, реплицируются независимо от бактериальной хромосомы, хотя существуют системы, контролирующие их численность. При некоторых условиях, например, при подавлении синтеза белка, бактериальная хромосома уже не может удваиваться, а плазмиды активно реплицируются и их численность увеличивается. Этот феномен используют при выделении плазмидной ДНК. Мегаплазмиды, к числу которых относится, например, F-плазмида, содержатся в клетке в виде одной или двух копий. Их репликация контролируется так же, как репликация бактериальной хромосомы, и при запуске удвоения геномной ДНК мегаплазмида также начинает реплицироваться[4].
Хотя в большинстве случаев плазмиды автономны, некоторые из них могут встраиваться в геномную ДНК бактерии-хозяина, а при определённых условиях вновь обособляться, иногда даже захватывая с собой фрагменты геномной ДНК. Такие плазмиды называют эписомами[2].
Конкретные механизмы репликации плазмид рассматриваются ниже.
Геометрия

Большинство плазмид — кольцевые молекулы, но известно и много примеров бактерий с линейными плазмидами. Поскольку линейным плазмидам необходим механизм репликации концов, которого нет у кольцевых хромосом, эти плазмиды обычно имеются у бактерий, содержащих также линейные хромосомы (хотя из этого правила известны исключения)[5][6].
Кольцевые плазмиды могут иметь более одной топологической конфигурации, что обеспечивается соотношением противоположного действия ДНК-гираз и топоизомераз. Обычно плазмидная ДНК находится в виде ковалентно замкнутого суперскрученного кольца. Если одна из цепей ДНК претерпевает разрыв, то суперскрученная плазмида расплетается в простое кольцо, которое при электрофорезе медленнее, чем суперскрученная форма, проходит через агарозный гель. Если разрыв претерпевают обе цепи ДНК, то образуется линейная форма. Кроме того, из-за гомологичной рекомбинации плазмидные мономеры могут объединяться в димеры, которые из-за своих более крупных размеров медленнее мономеров проходят в агарозном геле при электрофорезе. Явление различной скорости прохождения различных форм плазмид через агарозный гель при электрофорезе используется для их электрофоретического разделения[источник не указан 2153 дня].
В нижеследующей таблице приведены некоторые плазмиды и их основные физические характеристики[3].
| Плазмида | Хозяин | Размер плазмиды (тыс. пар оснований) |
Геометрия плазмиды | Число копий плазмиды на клетку |
|---|---|---|---|---|
| pUB110 | Bacillus subtilis | 2,3 | Кольцевая | 20—50 |
| ColEl | Escherichia coli | 6,6 | Кольцевая | 10—30 |
| lp25 | Borrelia burgdorferi[англ.] | 24,2 | Линейная | 1—2 |
| pNOB8 | Sulfolobus[англ.] sp.a (архея) |
41,2 | Кольцевая | 2—40 |
| F | Escherichia coli | 99,2 | Кольцевая | 1—2 |
| SCP1 | Streptomyces coelicolor[англ.] | 350,0 | Линейная | 4 |
| pSymA | Sinorhizobium meliloti | 1354,2 | Кольцевая | 2—3 |
Строение
Для того, чтобы быть способной к репликации, любая плазмида должна включать следующие элементы:
- точка начала репликации (ori);
- структурные гены репликации (rep);
- локус cop, содержащий гены, ответственные за копийность плазмиды[англ.];
- гены par, контролирующие распределение плазмид между дочерними клетками при делении;
- детерминанты ccd, ответственные за поддержание числа копий[7].
Количество сайтов ori варьирует. У плазмиды ColE1[англ.] он один, а у R6K — целых три. Как правило, при наличии нескольких ori функционирует преимущественно один, а остальные являются резервными на случай повреждения основного. У большинства плазмид вблизи ori находятся повторяющиеся последовательности, которые строго необходимы для функционирования ориджина[7].
Гены rep кодируют белки (Rep), которые участвуют в инициации репликации плазмиды, связываясь с ori. Однако основная часть генов, продукты которых участвуют во всех этапах репликации плазмиды, находится в геномной ДНК бактерии. Белки Rep разных плазмид имеют различные аминокислотные последовательности и структуры, но последовательности Rep-белков малых плазмид pPF1, pGL3, pPBS1, pBLX и pPB1 совпадают на 98 %. Существуют плазмиды, полностью лишённые генов rep[7].
В состав локуса cop входят один или два гена, отрицательно влияющих на количество копий плазмиды в клетке. В этом локусе обнаружены пять повторов, сходных с повторами около ориджина репликации. С этими повторами связывается белок repE, из-за чего он не может взаимодействовать с ori, что препятствует инициации репликации. Гены par (от англ. partition) отвечают за распределение копий плазмид по дочерним клеткам при делении материнской клетки. У F-плазмиды локус состоит из примерно 3 тысяч п. о. и содержит два гена: parA и parB, причём белковый продукт гена parB играет вспомогательную роль. Детерминанты ccd, по сути, представляют собой систему токсин-антитоксин, из-за которой клетки, не унаследовавшие плазмиду при делении, погибают. В разных плазмидах могут присутствовать и другие структурные гены помимо упомянутых[7].
Репликация
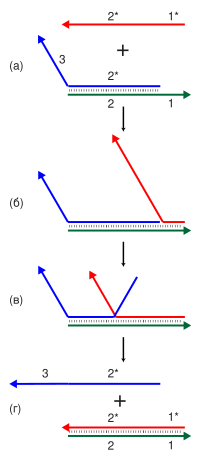
Как отмечалось выше, важным свойством плазмид является их способность к автономной репликации, в той или иной мере проходящей под контролем бактериальной хромосомы. Механизмы этого контроля подробнее освещены ниже.
Этапы репликации
В репликации плазмид выделяют 3 этапа:
- инициация;
- элонгация;
- терминация[8].
Так как ДНК-полимераза не может начинать репликацию de novo[англ.], то есть с нуля, для начала её работы требуется затравка — праймер. Эта проблема решается следующими способами:
- открытие цепей и последующее РНК-праймирование (репликация по тета-механизму или репликация по механизму замещения цепи);
- разрыв одной из цепей с образованием свободного 3'-ОН-конца (репликация по типу катящегося кольца).
Наиболее часто инициация катализируется несколькими инициаторными белками, кодируемыми плазмидой, которые узнают определённый сайт на ДНК плазмиды и таким образом определяют точку начала репликации (ori). В некоторых случаях эти белки также непосредственно участвуют в создании праймера. Они также могут играть роль направляющих белков в сборке реплисомы плазмиды[8].
Элонгацию обычно осуществляет холофермент ДНК-полимеразы III (в некоторых случаях на ранней стадии — ДНК-полимераза I[англ.]) при участии некоторых белков хозяйской клетки, входящих в состав реплисомы[8].
Контроль репликации

Если плазмида содержится в клетке в большом количестве копий, она, скорее всего, будет передаваться всем дочерним клеткам при делении. Однако количество копий плазмид, которые могут содержаться в одной клетке, всё-таки ограничено. Удвоение плазмиды очень затратно для клетки с метаболической точки зрения, поэтому, если затраты станут особенно велики, естественный отбор будет способствовать сокращению численности плазмид[9].
Механизмы контроля репликации работают на стадии инициации репликации. Эти механизмы поддерживают определённую частоту циклов репликации на плазмиду в данной клетке и способны чувствовать отклонения от этой частоты[8]. Системы контроля обеспечивают поддержание определённой численности плазмид в популяции бактерий. Молекулами, непосредственно его осуществляющими, могут быть:
- РНК с противоположной полярностью (антисмысловые РНК);
- последовательности ДНК (итероны);
- антисмысловые РНК вместе с белками[10].
Итероны — это короткие (17—22 п. о.) повторяющиеся последовательности ДНК, которые находятся вблизи точки начала репликации плазмиды. С итеронами связывается белок RepA. Если в клетке имеется больше одной копии плазмиды, то RepA связывается и со второй копией. В результате две плазмиды оказываются связаны друг с другом, что не даёт им удваиваться[11].
С помощью антисмысловых РНК регулируется репликация, например, плазмиды R100. Белок RepA в данном случае выступает как положительный регулятор репликации, поскольку он необходим для её инициации. Экспрессия RepA находится под контролем антисмысловой РНК CopA, которая связывается с мРНК RepA и подавляет его трансляцию. Кроме того, транскрипция гена repA репрессируется белком CopB. Когда плазмида только попадает в клетку, CopB там нет, и начинается экспрессия RepA и репликация плазмиды. Однако постепенно начинает экспрессироваться и CopB, который сдерживает дальнейшую репликацию[12][13].
Некоторые белки, инициирующие репликацию плазмид, могут делать это лишь единожды. Так, при инициации репликации плазмиды pT181 инициаторные белки Rep формируют димеры RepC/RepC, а при терминации репликации один из мономеров подвергается посттрансляционным модификациям, которые делают его нефункциональным[14].
Некоторые плазмиды, например, ColE1, экспрессируют ингибитор собственной репликации. Концентрация белка-ингибитора в клетке напрямую зависит от количества копий плазмид, поэтому он сдерживает численность плазмиды в клетке[14].
Механизмы репликации
Репликация по тета-механизму

Этот механизм, сопровождающийся образованием так называемой тета-структуры[англ.], хорошо изучен у плазмид грамотрицательных бактерий, хотя такой механизм описан и у плазмид грамположительных бактерий: плазмид стрептококков/энтерококков семейства Inc18, некоторых репликонов лактококков[англ.] и у как минимум одной плазмиды Bacillus subtilis.
Репликация по тета-механизму включает в себя следующие этапы:
- расплетание двух родительских цепей;
- синтез праймерной РНК (пРНК) на каждой из них;
- инициация репликации при помощи ковалентного нарастания пРНК на каждой из них;
- синтез комплементарной цепи ДНК на каждой из родительских цепей. Одна из цепей при этом выступает лидирующей, другая — отстающей, хотя синтез цепей происходит одновременно.
Тета-репликация может начинаться одновременно с одной или нескольких точек и быть при этом одно- или двунаправленной. В электронный микроскоп репликационная структура выглядит как греческая буква Θ (тета), отчего и называется тета-структурой. Если же специальные ферменты разрезают эту структуру в точке начала репликации, то получается Y-образная структура («вилка»). Репликационные структуры также можно определить при одно- или двумерном электрофорезе. Этот анализ позволяет установить природу репликационных соединений, направление репликации, точки начала и конца репликации, угол между лидирующей и отстающей цепями[8].
За редкими исключениями плазмидам с тета-типом репликации необходим кодируемый плазмидой инициаторный белок Rep. Некоторые репликоны на ранних этапах репликации также нуждаются в ДНК-полимеразе I хозяйской клетки[8].
Репликация по механизму замещения цепи
Наиболее известным примером плазмид с репликацией по механизму замещения цепи являются плазмиды семейства IncQ, чьим прототипом является плазмида RSF1010. Членам этого семейства для репликации необходимы 3 белка, кодируемых плазмидой. Эти белки запускают инициацию репликации в каждой из двух точек начала репликации, локализованных симметрично по одной на каждой цепи ДНК[8].
Сущность механизма замещения цепи заключается в том, что новосинтезированная цепь ДНК, комплементарная одной из родительских цепей, вытесняет одну из них. В результате образуется одноцепочечная кольцевая ДНК (вытесненная родительская цепь) и суперспирализованная двухцепочечная ДНК (комплементарные друг другу оставшаяся родительская цепь и дочерняя). В дальнейшем двухцепочечная структура одноцепочечной кольцевой ДНК восстанавливается[8].

Репликация по типу катящегося кольца
Многие мелкие (менее 10 тысяч п. о.) плазмиды бактерий и архей, а также некоторые бактериофаги (например, фаг M13[англ.] E. coli) используют репликацию по типу катящегося кольца (разматывающегося рулона, или репликацию σ-типа[15]). Особенно часто этот механизм встречается среди плазмид грамположительных бактерий[16].
Сущность этого механизма заключается в следующем. Вначале инициаторный белок Rep совершает одноцепочечный разрыв в цепи ДНК. Появившаяся при этом свободная 3'-OH-группа служит праймером для синтеза ДНК ДНК-полимеразой III клетки-хозяина. В этом процессе задействованы также и другие белки клетки-хозяина, например, хеликаза и белок, связывающийся с одноцепочечной ДНК. Так синтезируется лидирующая цепь и восстанавливается двухцепочечная структура исходной ДНК. Содержащая разрыв цепь ДНК при этом удаляется, и происходит её репликация ДНК-полимеразой III, сопровождающаяся созданием праймера РНК-полимеразой. После полной репликации ДНК-полимераза I заменяет праймер на ДНК, а ДНК-лигаза сшивает концы, образуя тем самым окончательную двухцепочечную ДНК[8][17].
Репликация линейных плазмид
ДНК-полимеразы не могут синтезировать цепь ДНК без короткой РНК-затравки — праймера. Для синтеза лидирующей цепи необходима всего одна затравка, с которой и начинается удвоение, продолжающееся до самого конца молекулы. Отстающая цепь синтезируется прерывисто: для синтеза коротких фрагментов Оказаки всякий раз нужна новая затравка. При удвоении линейных плазмид репликация лидирующей цепи доходит до конца, а удвоение отстающей цепи не проходит полностью: РНК-праймер не может быть синтезирован строго на 3'-конце цепи. Такая же проблема стоит перед линейными бактериальными хромосомами. Разные бактерии нашли разные пути решения этой проблемы. У Borrelia концы обеих цепей ковалентно соединены друг с другом с образованием небольших шпилек. Такая псевдокольцевая структура подвергается типичной двунаправленной репликации. Образующаяся кольцевая структура разрезается на две линейные плазмиды специальными ферментами, и на их концах формируются шпильки. У Streptomyces с 5'-концами ДНК связан особый белок TP (от англ. terminal protein — концевой белок). При репликации отстающей цепи TP формирует особые вторичные структуры в области неудвоенных участков за счёт содержащихся в них инвертированных повторов[англ.][18].
Функции плазмид
Многие плазмиды не вызывают заметных изменений в фенотипе своих хозяев, в этом случае они называются криптическими. Другие, напротив, ответственны за проявление у клетки-хозяина свойств, помогающих ей выжить в определённых условиях окружающей среды, и без этих плазмид бактерии погибали бы или их рост замедлялся бы[19].
Плазмиды могут выполнять различные функции в бактериальной клетке. Наиболее изучены плазмиды, содержащие гены устойчивости к антибиотикам. Их называют R-плазмидами, или R-факторами (от англ. resistance — устойчивость)[20]. Сами по себе гены устойчивости очень разнообразны: от кодируемых плазмидами β-лактамаз, разрушающих пенициллин, до мембранных белков, которые не дают тетрациклину накапливаться в клетках. Из-за быстрого распространения плазмид устойчивости в бактериальных популяциях проблема антибиотикорезистентности встаёт всё более остро. Бактерии могут приобретать устойчивость к нескольким антибиотикам одновременно из-за нескольких плазмид, защищающих от разных антибиотиков, или благодаря одной плазмиде, содержащей гены устойчивости к разным антибиотикам. Важную роль в образовании плазмид, несущих гены резистентности к антибиотикам, играют транспозоны, способствующие переносу генов от одной плазмиды к другой или от бактериальной хромосомы к плазмиде[21]. R-фактор передаётся при трансдукции и обычном делении клетки. Некоторые R-плазмиды могут передаваться при конъюгации бактерий, то есть являются конъюгативными. Возможна передача R-плазмид между бактериями различных видов, родов и даже семейств. Так, RP1, плазмида, ответственная за устойчивость к ампициллину, тетрациклину и канамицину у бактерий рода Pseudomonas[англ.] семейства Pseudomonadaceae, может передаваться E. coli, относящейся к семейству Enterobacteriaceae[22].
Многие плазмиды содержат гены, кодирующие белки с антимикробными свойствами, которые, как правило, вредны только для близкородственных организмов. Например, некоторые штаммы E. coli вырабатывают белки, убивающие клетки других штаммов E. coli. Эти белки называют колицинами, а штаммы, способные к их образованию, — колициногенными. Гены колицинов находятся на плазмидах (Col-плазмидах), и в тех же плазмидах находятся гены, защищающие от колицинов те клетки, которые их производят[23]. Некоторые бактерии кодируют белки, токсичные для небактериальных организмов. У энтеропатогенных штаммов E. coli[англ.] имеются так называемые Ent-плазмиды, кодирующие энтеротоксины[англ.][24]. У ряда грамположительных (Staphylococcus aureus, Streptococcus pyogenes и др.) и грамотрицательных (Pseudomonas aeruginosa, P. morgani, E. coli и др.) бактерий есть Hly-плазмиды, которые также называют плазмидами гемолитической активности. Они несут гены токсичных белков гемолизинов, способных лизировать мембраны эритроцитов животных и человека[25].
У некоторых патогенных бактерий гены, кодирующие токсины, действующие на организм-хозяин, находятся на плазмидах. Из-за таких плазмид некоторые штаммы E. coli могут вызывать заболевание, напоминающее холеру. E. coli выделяют токсины LT, похожие на холерный токсин, однако у Vibrio cholerae ген, кодирующий токсин, находится в составе профага, а не в составе плазмиды[26]. Зачастую плазмиды кодируют белки, которые необходимы для вирулентности патогенных бактерий или усиливают её. Такая плазмида есть, например, у видов рода Yersinia, в том числе Yersinia pestis — возбудителя чумы. Плазмида содержит гены, кодирующие белки, благодаря которым бактерия может впрыскивать в иммунные клетки вещества, нарушающие их работу или даже убивающие их[27]. У ряда патогенных бактерий, например, некоторых болезнетворных штаммов E. coli, имеются плазмиды антигенной колонизации, которые содержат гены, ответственные за синтез антигенов[28].

Особые плазмиды имеются у бактерий, вызывающих заболевания у растений, например, Agrobacterium tumefaciens, которая вызывает появление похожих на опухоль образований — галлов. Патогенные штаммы этой бактерии несут T-плазмиду, или Ti-плазмиду (от англ. tumor inducing — «вызывающий опухоль»), причём часть этой плазмиды переносится в растительные клетки. У азотфиксирующих бактерий, которые вызывают образование клубеньков на корнях бобовых растений (например, Rhizobium), гены, необходимые для формирования клубеньков и фиксации азота, находятся на плазмидах[27].
Нередко плазмиды обеспечивают своего обладателя новыми метаболическими путями. Например, способность сбраживать лактозу может передаваться вместе с плазмидами. В связи с этим лабораторная диагностика бактерий, основанная на их специфических биохимических свойствах, очень затруднена. Например, биохимически патогенных представителей рода Salmonella от непатогенных штаммов E. coli можно отличить именно по способности сбраживать лактозу. Плазмиды могут содержать гены, ответственные за сбраживание других сахаров, например, сахарозы, гидролиз мочевины или образование сероводорода[10].
Гены, содержащиеся в плазмидах, могут давать возможность их обладателям разрушать потенциально токсичные соединения. Например, у Pseudomonas putida[англ.] имеется плазмида pWWO, содержащая гены ряда ферментов, которые превращают циклические углеводороды толуол и ксилол в бензоат. На ней же находится оперон, ответственный за разрушение бензоата до метаболитов, которые могут быть использованы в биосинтетических процессах или для получения энергии. Поэтому Pseudomonas putida может расти в условиях, когда толуол является единственным источником углерода. Способность бактерий разлагать вредные для окружающей среды соединения составляет основу биоремедиации[29].
В следующей таблицы приведены примеры отдельных естественных плазмид и функций, ими выполняемых[19]:
| Плазмида | Хозяин | Размер плазмиды (тыс. пар оснований) |
Известная функция |
|---|---|---|---|
| pT181 | Staphylococcus aureus | 4,4 | Устойчивость к тетрациклину |
| ColEl | Escherichia coli | 6,6 | Образование колицина и устойчивость к нему |
| pMBl | Escherichia coli | 8,5 | Система рестрикции-модификации |
| pAMpi | Enterococcus faecalis[англ.] | 26,0 | Устойчивость к эритромицину |
| pSK41 | Staphylococcus aureus | 46,4 | Множественная устойчивость |
| pBM4000 | Bacillus megaterium | 53,0 | Оперон рРНК |
| pI258 | Staphylococcus aureus | 28,0 | Устойчивость к ионам тяжёлых металлов |
| pSLT | Salmonella enterica sv. Typhimurium | 93,9 | Детерминанта вирулентности |
| pMT1 | Yersinia pestis | 101,0 | Детерминанта вирулентности |
| pADP-1 | Pseudomonas sp. | 108,8 | Катаболизм атразина (гербицид) |
| pWW0 | Pseudomonas putida | 117,0 | Деградация ароматических углеводородов |
| pX01 | Bacillus anthracis | 181,7 | Синтез энтеротоксинов |
| pSOL1 | Clostridium acetobutylicum | 192,0 | Образование сольвента |
| pSymB | Sinorhizobium meliloti | 1683,3 | Множественные функции |
Передача

1. Клетка-донор выпускает половой пиль.
2. Пиль прикрепляется к клетке-реципиенту, соединяя две клетки.
3. В мобильной плазмиде происходит однонитевой разрыв, и одна цепь ДНК переходит в клетку-реципиент.
4. Обе клетки достраивают вторую цепь ДНК плазмиды, восстанавливая двухцепочечную кольцевую плазмиду, и образуют половые пили. Теперь обе клетки являются полноценными донорами
Плазмиды могут приобретаться бактериальной клеткой при непосредственном контакте с другой клеткой (конъюгация) или захватываться из окружающей среды (трансформация)[30].
Основным способом приобретения плазмид у бактерий является конъюгация. Этот процесс был описан в 1946 году Э. Татумом и Дж. Ледербергом у E. coli, позднее конъюгацию открыли и у других бактерий, в числе которых Proteus[англ.], Klebsiella, Shigella, Salmonella и Pseudomonas[31]. Контакт между двумя клетками опосредуются плазмидоспецифичными половыми пилями. Плазмиды, запускающие конъюгацию для собственного распространения, называют конъюгативными. Переходя из одной клетки в другую, они иногда захватывают с собой неконъюгативные плазмиды или копию геномной ДНК. Общая схема процесса конъюгации такова. Между бактериями устанавливается контакт при помощи полых белковых пилей. Цепи ДНК плазмиды в клетке-доноре разделяются, одна из них передаётся в клетку-реципиент, после чего на обеих одиночных цепях достраиваются комплементарные им цепи, и плазмиды вновь становятся двуцепочечными[32].
Наиболее известной конъюгативной плазмидой является F-плазмида, или F-фактор. F-плазмида является эписомой длиной около 100 тыс. пар оснований. У неё есть собственные точка начала репликации (oriV) и точка разрыва (oriT)[33]. F-плазмида, как и все конъюгативные плазмиды, кодирует белки, противодействующие прикреплению пилей других бактерий к клеточной стенке данной. Помимо прочей генетической информации, F-плазмида несёт локусы tra и trb, организованные в один оперон. Содержащиеся в них гены ответственны за различные аспекты процесса конъюгации: синтез пилина[англ.] и сборку половых пилей, запуск и регулирование процесса переноса генетического материала, разрыв в локусе oriT и расплетание цепи ДНК[34][35]. Локус tra имеется и у других F-подобных конъюгативных плазмид; в нём находятся ориджин конъюгативного переноса и 20 генов, кодирующих необходимые для конъюгации белки[36]. Любопытно, что F-подобные плазмиды, такие как R100, R6-5, R1 и ColV2, ингибируют перенос плазмиды F[37]. Известен также так называемый летальный зигозис, который заключается в том, что количество жизнеспособных трансконъюгантов понижается при смешивании численно преобладающих клеток-доноров по сравнению с количеством клеток-реципиентов из-за образования многочисленных мостиков передачи ДНК к одной клетке-реципиенту[38].
Под трансформацией понимают получение клеткой плазмидной ДНК из внешней среды (совокупность всех плазмид, находящихся в некотором месте, называют плазмидомом[англ.]). Трансформация описана как у грамположительных, так и грамотрицательных бактерий, в частности, у представителей родов Streptococcus, Hemophilus[англ.], Neisseria, Bacillus, актиномицетов, цианобактерий и других. Для того, чтобы ДНК могла проникнуть в бактериальную клетку, клетка должна находиться в состоянии компетентности[англ.], то есть её покровы должны стать проницаемыми для больших молекул ДНК. В лаборатории компетентные клетки получают при стрессовом воздействии: при действии хлорида кальция или при помощи электропорации. Для некоторых бактерий показана трансформация в естественных условиях, например, для Streptococcus pneumoniae в организме заражённого животного. Некоторые бактерии поглощают ДНК любого происхождения, а другие, например, Hemophillus, могут поглощать только свою ДНК. После попадания в бактериальную клетку одна из нитей ДНК плазмиды расщепляется, одноцепочечный фрагмент физически объединяется с ДНК реципиента[39].
Стабильность
Для плазмид характерна нестабильность. Определяемые ими свойства исчезают из популяций гораздо чаще, чем если бы за этим стоял нормальный процесс накопления мутаций. Одни плазмиды стабильнее других, причём естественные плазмиды существенно стабильнее искусственно сконструированных. На стабильность плазмиды влияют её целостность, способность передаваться при делении и дифференциальная скорость роста. Зачастую плазмиды теряют часть своих генов, поскольку содержат «горячие точки» рекомбинации. Когда происходит рекомбинация между участками повторов, нередко появляются инверсии и делеции[40].
Для сохранения плазмиды в популяции бактерий необходимо, чтобы она передавалась дочерним клеткам при делении. Высококопийные плазмиды, как правило, распределяются между дочерними клетками случайным образом. Однако одинаковые плазмиды при репликации и при рекомбинации нередко формируют мультимерные структуры. Поскольку димер из двух плазмид содержит два ori репликации, его репликация более эффективна, чем репликация мономера, а мультимеры реплицируются ещё быстрее. В конце концов может появиться так называемая «катастрофа димеров»: почти все плазмиды входят в состав димеров и мультимеров, что мешает их передаче при делении клеток. Впрочем, некоторые плазмиды могут возвращаться в нормальное, мономерное состояние. Так, плазмида ColE1 содержит сайт cer, на который действуют белки XerC и XerD. Происходит сайт-специфическая рекомбинация, в результате которой димер превращается в два мономера. Низкокопийные плазмиды не могут рассчитывать на случайное распределение между соседними клетками, поэтому многие из них содержат систему токсин-антитоксин, обеспечивающую уничтожение клеток, потерявших плазмиду при делении[41].
Иногда скорость роста клеток, содержащих плазмиду, и клеток, не содержащих её, различается. Разница в росте, возможно, связана с метаболическими особенностями, происходящими из необходимости удваивать плазмиду и экспрессировать её гены. Для большинства природных плазмид эти издержки невелики и, вероятно, не оказывают существенного эффекта на скорость роста. В то же время искусственные плазмиды часто присутствуют в клетках в огромном количестве копий, и их гены активно экспрессируются, поэтому для клеток, содержащих искусственные плазмиды, проблема их нестабильности стоит особенно остро[42].
Несовместимость
Для плазмид характерно явление несовместимости: зачастую в одной клетке не могут одновременно сосуществовать две конкретные плазмиды. Как правило, несовместимые плазмиды содержат гомологичные последовательности. Однако несовместимость может быть вызвана также наличием в плазмиде транспозонов и других генетических элементов, делающих её нестабильной. Все известные на данный момент плазмиды разделили на 30 групп несовместимости: плазмиды внутри одной группы несовместимы друг с другом, но совместимы с плазмидами из других групп. Однако широко распространена так называемая атипичная несовместимость, при которой некоторые плазмиды несовместимы не только с плазмидами из своей группы несовместимости, но и некоторыми плазмидами из других групп[43].
Существует несколько моделей несовместимости плазмид. Была предложена гипотеза, согласно которой плазмиды конкурируют за сайты прикрепления к клеточной мембране. Так как плазмиды из одной группы несовместимости прикрепляются к мембране в одних и тех же местах, то они будут вытеснять друг друга. Согласно другой гипотезе, плазмиды кодируют некий белок-репрессор, сдерживающий репликацию плазмид из той же группы несовместимости. Эта гипотеза получила некоторые экспериментальные подтверждения[43].
Имеются данные, что в формировании несовместимости задействованы повторы, расположенные вблизи ориджинов репликации. Кроме того, одна плазмида может подавлять другую при помощи некодирующих РНК[43].
Участие генов клетки-хозяина
Хотя репликация плазмид контролируется их собственными белками и РНК, клетка-хозяин также вносит свой вклад в регуляцию копийности плазмиды[14]. Ни одна из известных плазмид не содержит полного набора генов, необходимых для её репликации. Например, для репликации F-плазмиды необходимы ДНК-полимераза III клетки-хозяина и продукты генов dnaB, dnaC и dnaA[англ.], которые локализованы в геномной ДНК. Плазмида RK2 удваивается, когда с её ДНК связаны белковый продукт гена dnaA и клеточная мембрана[44].
По способности реплицироваться в клетках других бактерий плазмиды делятся на плазмиды узкого круга хозяев (способны реплицироваться только в клетках определённого вида) или широкого круга хозяев (репликация за пределами вида)[45]. Например, плазмида NP1-1 нормально реплицируется в клетках Pseudomonas aeruginosa, в клетках других бактерий процесс идёт с трудом. Некоторые плазмиды могут существовать в клетках многих видов бактерий; к числу таких плазмид относят, например, pC194, pMV158, pM3 и pMT2. Причинами, по которым плазмида не может удваиваться в клетках некоторых видов бактерий, являются особенности строения промотора, неэффективное взаимодействие инициаторного белка RepA с белком DnaA, кодируемым геномной ДНК, и бактериальными шаперонами. Кроме того, на ограничение круга хозяев влияют особенности ori. Численность плазмид также может зависеть от вида бактерии-хозяина. Так, плазмида pER2 в клетках E. coli существует в большем числе копий, чем в клетках Corynebacterium. Количество плазмиды также определяется фазой роста, в которой находится бактериальная культура. Численность плазмид в логарифмической фазе роста больше, чем в стационарной, вероятно, в связи с накоплением в клетках ингибитора репликации. На копийность некоторых плазмид может оказывать влияние состав питательной среды, в которой растут бактерии[44].
При делении клетки-хозяина многокопийные плазмиды распределяются между дочерними клетками случайным образом, и вероятность того, что одна из дочерних клеток не получит ни одной копии плазмиды, очень мала. Однако для малокопийных плазмид вопрос регуляции их распределения при делении клетки стои́т очень остро. Как упоминалось выше, система разделения плазмид[англ.] (par), содержащаяся в них, включает набор генов, которые обеспечивают точное распределение копий плазмиды между дочерними клетками. Эта система автономна, не связана с репликацией и не оказывает влияния на копийность. Однако распределение копий плазмиды pSN19035 по дочерним клеткам контролируется областью SegB, один из генов которой также влияет и на копийность плазмиды. Для плазмид F и R1 показано, что белки, регулирующие распределение плазмид при делении, могут подавлять свою собственную транскрипцию по механизму отрицательной обратной связи. Возможно, избыточная концентрация этих белков блокирует правильное распределение плазмид. Эти белки могут образовывать филаментоподобные структуры, «расталкивающие» копии плазмид в разные дочерние клетки без участия мембранных белков-рецепторов клетки-хозяина[46].
Механизм поддержания плазмид
В поддержании плазмид в клетке задействована система токсин-антитоксин. В простейшем случае она представлена двумя генами области ccd, один из которых убивает клетку и называется токсином, а другой подавляет его и называется антитоксином, причём токсин значительно стабильнее антитоксина. Если при делении одна из дочерних клеток не унаследует плазмиды с системой токсин-антитоксин, то попавший в неё антитоксин полностью разрушится раньше, чем токсин, который в отсутствие антитоксина вызывает гибель клетки[47].
Важным вариантом системы токсин-антиоксин являются системы рестрикции-модификации, которые являются источником ферментов рестрикции, используемых в генетической инженерии[48][49]. Роль токсина в системах выполняет фермент рестрикции, который узнаёт определённые последовательности ДНК. Если последовательность не содержит метильных остатков, блокирующих действие рестриктазы, она вносит двухцепочечный разрыв, который приводит к деградации ДНК-мишени. Метилаза, которая узнаёт ту же последовательность, что рестриктаза, выступает в роли антитоксина, блокируя активность рестриктазы. Помимо роли поддержания плазмиды, системы рестрикции-модификации выполняют защитную функцию против чужеродной ДНК, в частности, бактериофагов[50].
Классификация
Ко второму десятилетию XXI века существует несколько систем классификации плазмид, которые учитывают их различия в топологии, особенностях репликации, способности или неспособности индуцировать перенос генетического материала, наличии или отсутствии факторов антибиотикорезистентности и других свойствах. Важнейшим свойством плазмиды является её способность (или неспособность) передаваться от одной бактериальной клетки к другой в ходе конъюгации. Передающиеся плазмиды называют конъюгативными. Плазмиды, которые сами по себе не могут передаваться между клетками, иногда всё-таки делают это, подхватываемые конъюгативными плазмидами. Среди конъюгативных плазмид выделяют плазмиды, которые содержат только гены репликации переноса, и конъюгативные коинтегративные плазмиды, которые, помимо генов переноса и репликации, содержат гены, отвечающие за некоторые фенотипические признаки. К числу коинтегративных плазмид относятся R-плазмиды, Col-плазмиды, дающие штаммам E. coli способность к образованию и секреции колицинов, Hly-плазмиды, содержащие гены гемолизинов, и Ent-плазмиды, ответственные за синтез энтеротоксинов[51].
Кроме того, широко распространена классификация, основанная на свойстве совместимости/несовместимости плазмид. Известные плазмиды разделили на несколько групп так, что бактерии одной группы несовместимы друг с другом, но совместимы с любой плазмидой из другой группы несовместимости[52].
Как отмечалось выше, по количеству копий на клетку плазмиды делят на малокопийные и многокопийные. Плазмиды также разделяют по тому, узок или широк их круг хозяев[52].
Плазмиды грибов
Среди эукариот плазмиды обнаружены у грибов. Плазмиды грибов представлены линейными или кольцевыми молекулами ДНК, которые могут локализоваться в ядре клетки, цитоплазме, однако большая часть находится в митохондриях и не вызывает фенотипических изменений. Среди грибных плазмид выделяют:
- линейные плазмиды, не имеющие гомологии с митохондриальной ДНК (мтДНК);
- кольцевые плазмиды, не имеющие гомологии с мтДНК;
- кольцевые плазмиды, демонстрирующие гомологию с мтДНК[53].
Плазмиды двух последних групп появляются в процессе старения. Плазмиды были выявлены у таких грибов, как дрожжи Saccharomyces cerevisiae, Neurospora[англ.], Aspergillus niger и Kluyveromyces lactis[англ.]. Грибные плазмиды могут передаваться через анастомозы мицелия (горизонтально) и через конидии (вертикально)[53].
Эволюция
В 1968 году Э. Мейнелл и соавторы выдвинули гипотезу, что первым этапом эволюции плазмид было возникновение примитивного репликона, который мог автономно существовать вне хромосомы. Репликон же мог возникнуть из нуклеоидной ДНК или же развился из экстрахромосомной структуры вроде центросомы, так как в то время считалось возможным существование митоза у бактерий на ранних этапах их эволюции (в настоящее время эта гипотеза признана неверной). В 1976 году С. Коэн предположил, что ориджин репликации мог возникнуть de novo из дезоксинуклеотидов и в дальнейшем к нему присоединились гены, связанные с саморепликацией, и гены, кодирующие всё необходимое для генетического переноса. Высказывалась гипотеза, что плазмиды появились из повторяющихся последовательностей бактериальной геномной ДНК, которые оказались в цитоплазме вследствие реципрокного кроссинговера. Однако все вышеперечисленные гипотезы не получили экспериментальной поддержки[54].
Впоследствии возникло мнение об общности происхождения плазмид и умеренных бактериофагов из-за сходства в их организации. Плазмиды рассматривались как фаги, лишённые генов, кодирующих белки капсида, но имеющие гены, ответственные за их удвоение и распределение в дочерние клетки при делении. Так, бактериофаги N15[англ.], øKO2 и PY54, сходные с фагом лямбда, который стал источником первых векторов, не интегрируются в геном бактерии, а во время лизогенного цикла существуют в виде линейных плазмид[55].
Убедительное экспериментальное подтверждение получила теория эволюции R-плазмид, обеспечивающих антибиотикорезистентность. Они произошли от экстрахромосомных элементов, несущих гены устойчивости или приобретших их в результате мутаций. Когда эти элементы объединились с факторами переноса, возникли конъюгативные R-плазмиды. Заметную роль в эволюции плазмид сыграли транспозоны, которые меняли экспрессии тех или иных плазмидных генов[54].
Применение

Использование плазмид в исследовательской деятельности огромно. Искусственные плазмиды активно используются в генетической инженерии в качестве векторов, в которые вставляются целевые кодирующие области[56]. Размножая такие плазмиды в бактериальных клетках, можно вырабатывать огромные количества нужного белка. Например, именно таким образом в настоящее время получают инсулин[57]. Искусственные плазмиды, которые предназначены для использования в качестве векторов, коммерчески доступны и всегда содержат ориджин репликации, гены, обеспечивающие устойчивость к некоторому антибиотику (для отбора на средах с антибиотиком бактериальных клеток, получивших плазмиду), а также несколько сайтов, распознаваемых разными рестриктазами. Вставку фрагмента осуществляют за счёт обработки рестриктазами плазмиды и фрагмента и последующего лигирования. В обычные векторы можно вставлять фрагменты до 15 килобаз длиной. Для клонирования более крупных фрагментов используют другие векторы, такие как космиды (плазмиды, содержащие локус cos бактериофага λ), фазмиды, также известные как фагемиды (плазмиды, содержащие ориджин репликации фага f1[англ.][58]), бактериальные и дрожжевые искусственные хромосомы[англ.][59].

Последовательности плазмид, созданных разными исследователями, можно найти в публичных базах данных, таких как Addgene, BCCM/LMBP и NCBI database. Для создания искусственных плазмид с заданными свойствами создано множество биоинформатических программ и инструментов. С помощью них можно находить сайты рестрикции и получать последовательности плазмид со вставками, то есть осуществлять «виртуальное клонирование». В качестве примера таких инструментов можно привести ApE, Clone Manager[англ.], GeneConstructionKit, Geneious, Genome Compiler[англ.], LabGenius, Lasergene, MacVector[англ.], pDraw32, Serial Cloner, SnapGene, VectorFriends, Vector NTI[англ.] и WebDSV[60].
Плазмиды рассматривают как перспективный инструмент для генной терапии, поскольку с них могут экспрессироваться белки, которых недостаёт в клетках пациента. На плазмидах в клетки можно доставлять гены, кодирующие такие инструменты для редактирования генома, как нуклеазы, содержащие домены типа цинковый палец[англ.], и компоненты системы CRISPR/Cas: белок Cas9 и направляющую РНК[61][62].
Плазмиды, дающие бактериям возможность разрушать трудноразлагаемые субстраты, могут быть использованы в биоремедиации. Плазмиды находят широкое применение в создании вакцин и новых лекарственных препаратов, а также увеличении продуктивности организмов, синтезирующих биологически активные вещества[63].
История изучения

В 1952 году был открыт фактор F (теперь известный как F-плазмида) у E. coli, который передаётся из клетки в клетку при конъюгации. Тогда же, в 1952 году, Джошуа Ледерберг предложил термин «плазмида» для обозначения фактора F, для которого уже удалось показать его внехромосомную природу[64]. Сначала термин использовался для обозначения любого генетического материала бактерий, который существует внехромосомно, по крайней мере, в течение части его цикла репликации, но поскольку это описание включает в себя бактериальные вирусы, понятие плазмиды было уточнено — это генетические элементы, которые реплицируются автономно от хромосомы[65].
Впоследствии плазмиды были обнаружены и у других видов бактерий. Становилось очевидным их чрезвычайное разнообразие по физическим и молекулярным характеристикам. Некоторые учёные предлагали рассматривать плазмиды как симбиотические или паразитические внутриклеточные организмы. В конце 1950-х годов был установлен факт передачи антибиотикорезистентности от одних бактерий к другим без участия нуклеоида. Так были открыты R-плазмиды. В 1963 году была показана возможность рекомбинации между внехромосомными элементами и нуклеоидной ДНК. В 1980-х годах были описаны линейные плазмиды. Постепенно плазмиды стали находить применение в молекулярно-биологических методах[66].
Примечания
- ↑ Sinkovics, J; Harvath J; Horak A. The Origin and evolution of viruses (a review) (англ.) // Acta Microbiologica et Immunologica Hungarica[англ.] : journal. — 1998. — Vol. 45, no. 3—4. — P. 349—390. — PMID 9873943.
- ↑ 1 2 Гигани, 2017, с. 10.
- ↑ 1 2 Shintani M., Sanchez Z. K., Kimbara K. Genomics of microbial plasmids: classification and identification based on replication and transfer systems and host taxonomy. (англ.) // Frontiers In Microbiology. — 2015. — Vol. 6. — P. 242—242. — doi:10.3389/fmicb.2015.00242. — PMID 25873913.
- ↑ Dale & Park, 2004, p. 142—143.
- ↑ Hayes F. The function and organization of plasmids. (англ.) // Methods In Molecular Biology (Clifton, N.J.). — 2003. — Vol. 235. — P. 1—17. — doi:10.1385/1-59259-409-3:1. — PMID 12904641.
- ↑ Современная микробиология / Под ред. Й. Ленгелера, Г. Древса[нем.], Г. Шлегеля[нем.]. — М.: Мир, 2005. — Т. 1. — С. 437. — 654 с. — ISBN 978-5-03-003707-3.
- ↑ 1 2 3 4 Гигани, 2017, с. 23—29.
- ↑ 1 2 3 4 5 6 7 8 9 del Solar G., Giraldo R., Ruiz-Echevarría M. J., Espinosa M., Díaz-Orejas R. Replication and control of circular bacterial plasmids. (англ.) // Microbiology And Molecular Biology Reviews : MMBR. — 1998. — June (vol. 62, no. 2). — P. 434—464. — PMID 9618448.
- ↑ Dale & Park, 2004, p. 142.
- ↑ 1 2 Dale & Park, 2004, p. 139—140.
- ↑ Dale & Park, 2004, p. 148.
- ↑ Dale & Park, 2004, p. 147.
- ↑ Гигани, 2017, с. 42.
- ↑ 1 2 3 Гигани, 2017, с. 47.
- ↑ Арефьев В. А., Лисовенко Л. А. rolling circle model, σ-type replication // Англо-русский толковый словарь генетических терминов. — М.: Изд-во ВНИРО, 1995. — ISBN 5-85382-132-6.
- ↑ Lorenzo-Díaz F., Fernández-López C., Garcillán-Barcia M. P., Espinosa M. Bringing them together: plasmid pMV158 rolling circle replication and conjugation under an evolutionary perspective. (англ.) // Plasmid. — 2014. — July (vol. 74). — P. 15—31. — doi:10.1016/j.plasmid.2014.05.004. — PMID 24942190.
- ↑ Khan S. A. Rolling-circle replication of bacterial plasmids. (англ.) // Microbiology And Molecular Biology Reviews : MMBR. — 1997. — December (vol. 61, no. 4). — P. 442—455. — PMID 9409148.
- ↑ Dale & Park, 2004, p. 151—154.
- ↑ 1 2 The Function and Organization of Plasmids: Plasmid-Encoded Traits. Дата обращения: 24 июля 2013. Архивировано из оригинала 17 августа 2013 года.
- ↑ Госманов Р. Г., Галиуллин А. К., Волков А. Х., Ибрагимова А. И. Микробиология: учебное пособие. — СПб.: Лань, 2011. — С. 126. — 496 с. — ISBN 978-5-8114-1180-1.
- ↑ Dale & Park, 2004, p. 137—138.
- ↑ R Plasmids and Resistance to Antibiotics. (недоступная ссылка)
- ↑ Dale & Park, 2004, p. 138.
- ↑ Гигани, 2017, с. 82.
- ↑ Гигани, 2017, с. 82—83.
- ↑ Dale & Park, 2004, p. 138—139.
- ↑ 1 2 Dale & Park, 2004, p. 139.
- ↑ Гигани, 2017, с. 90.
- ↑ Dale & Park, 2004, p. 140—141.
- ↑ Инге-Вечтомов, 2010, с. 241.
- ↑ Гигани, 2017, с. 74.
- ↑ Гигани, 2017, с. 53.
- ↑ Ryan K. J., Ray C. G. (editors). Sherris Medical Microbiology. — 4th. — N. Y.: McGraw-Hill Education, 2004. — С. 60—64. — ISBN 0-8385-8529-9.
- ↑ Sheela Srivastava. Genetics of Bacteria. — Delphi, India: Springer, 2013. — P. 79. — 215 p. — ISBN 978-81-322-1089-4.
- ↑ Инге-Вечтомов, 2010, с. 247.
- ↑ Гигани, 2017, с. 54.
- ↑ Гигани, 2017, с. 67.
- ↑ Гигани, 2017, с. 72.
- ↑ Инге-Вечтомов, 2010, с. 250—251.
- ↑ Dale & Park, 2004, p. 155—156.
- ↑ Dale & Park, 2004, p. 157—160.
- ↑ Dale & Park, 2004, p. 160—161.
- ↑ 1 2 3 Гигани, 2017, с. 16—20.
- ↑ 1 2 Гигани, 2017, с. 50—52.
- ↑ Loftie-Eaton W., Yano H., Burleigh S., Simmons R. S., Hughes J. M., Rogers L. M., Hunter S. S., Settles M. L., Forney L. J., Ponciano J. M., Top E. M. Evolutionary Paths That Expand Plasmid Host-Range: Implications for Spread of Antibiotic Resistance. (англ.) // Molecular Biology And Evolution. — 2016. — April (vol. 33, no. 4). — P. 885—897. — doi:10.1093/molbev/msv339. — PMID 26668183.
- ↑ Гигани, 2017, с. 48—49.
- ↑ Гигани, 2017, с. 49—50.
- ↑ Primrose, Sandy B.; Old, R. W. Principles of gene manipulation: an introduction to genetic engineering (англ.). — Oxford: Blackwell Scientific, 1994. — ISBN 0-632-03712-1.
- ↑ Micklos, David A.; Bloom, Mark V.; Freyer, Greg A. Laboratory DNA science: an introduction to recombinant DNA techniques and methods of genome analysis (англ.). — Menlo Park, Calif.: Benjamin/Cummings Pub. Co, 1996. — ISBN 0-8053-3040-2.
- ↑ Wilson Geoffrey G., Murray Noreen E. Restriction and Modification Systems (англ.) // Annual Review of Genetics. — 1991. — December (vol. 25, no. 1). — P. 585—627. — ISSN 0066-4197. — doi:10.1146/annurev.ge.25.120191.003101.
- ↑ Гигани, 2017, с. 13—15.
- ↑ 1 2 Гигани, 2017, с. 15.
- ↑ 1 2 Гигани, 2017, с. 94—96.
- ↑ 1 2 Гигани, 2017, с. 106—109.
- ↑ Casjens S. R., Hendrix R. W. Bacteriophage lambda: Early pioneer and still relevant. (англ.) // Virology. — 2015. — May (vol. 479-480). — P. 310—330. — doi:10.1016/j.virol.2015.02.010. — PMID 25742714.
- ↑ Modern Microbial Genetics / Uldis N. Streips, Ronald E. Yasbin. — 2nd. — Wiley-Blackwell, 2002. — С. 248. — ISBN 978-0471386650.
- ↑ Шмид Р. Наглядная биотехнология и генетическая инженерия. — М.: БИНОМ. Лаборатория знаний, 2014. — С. 122. — 325 с. — ISBN 978-5-94774-767-6.
- ↑ Richard J. Reece. Analysis of Genes and Genomes. — John Wiley & Sons, 2004. — P. 140. — ISBN 9780470091579.
- ↑ Chapter 2 — Choosing a Cloning Vector // E. Coli Plasmid Vectors: Methods and Applications (англ.) / Nicola Casali, Andrew Preston. — Totowa, N.J.: Humana Press[англ.], 2003. — P. 19—26. — (Methods in Molecular Biology, Vol. 235). — ISBN 978-1-58829-151-6.
- ↑ Vector NTI feedback video. The DNA Lab. Дата обращения: 30 октября 2018. Архивировано 29 сентября 2018 года.
- ↑ Kandavelou K., Chandrasegaran S. Plasmids for Gene Therapy // Plasmids: Current Research and Future Trends (англ.). — Norfolk, U. K.: Caister Academic Press[англ.], 2008. — ISBN 978-1-904455-35-6.
- ↑ Shinmyo Y., Tanaka S., Tsunoda S., Hosomichi K., Tajima A., Kawasaki H. CRISPR/Cas9-mediated gene knockout in the mouse brain using in utero electroporation // Scientific Reports. — 2016. — Vol. 6. — P. 20611. — doi:10.1038/srep20611. — PMID 26857612.
- ↑ Гигани, 2017, с. 99.
- ↑ LEDERBERG J. Cell genetics and hereditary symbiosis. (англ.) // Physiological Reviews. — 1952. — October (vol. 32, no. 4). — P. 403—430. — doi:10.1152/physrev.1952.32.4.403. — PMID 13003535.
- ↑ Stanley Falkow. Microbial Genomics: Standing on the Shoulders of Giants. Microbiology Society. Дата обращения: 2 ноября 2018. Архивировано 26 октября 2018 года.
- ↑ Гигани, 2017, с. 6—9.
Литература
- Гигани О. Б. Плазмиды. — М.: РУСАЙНС, 2017. — 154 с. — ISBN 978-5-4365-1976-0.
- Инге-Вечтомов С. Г. Генетика с основами селекции. — СПб.: Издательство Н-Л, 2010. — 718 с. — ISBN 978-5-94869-105-3.
- Jeremy W. Dale, Simon F. Park. Molecular Genetics of Bacteria. — 4th Edition. — Chichester, West Sussex; Hoboken, N. J.: John Wiley & Sons, Ltd, 2004. — ISBN 0-470-85084-1.
Эта статья входит в число избранных статей русскоязычного раздела Википедии. |