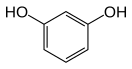
Резорцин
| Резорцин | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Традиционные названия | резорцин | ||
| Хим. формула | С6H4(OH)2 | ||
| Физические свойства | |||
| Состояние | твёрдое | ||
| Молярная масса | 110,1 г/моль | ||
| Плотность | 1,27 г/см³ | ||
| Энергия ионизации | 8,63 ± 0,01 эВ[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 110 °C | ||
| • кипения | 280,8 °C | ||
| • вспышки | 127 °C | ||
| Пределы взрываемости | 1,4 ± 0,1 об.%[1] | ||
| Удельная теплота испарения | 862000 Дж/кг | ||
| Давление пара | 0,0002 ± 0,0001 мм рт.ст.[1] и 1 Па | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 9,15; 11,33 | ||
| Растворимость | |||
| • в воде | 140 г/100 мл | ||
| • в бензоле | 1,93 г/100 мл | ||
| Структура | |||
| Дипольный момент | 2,70 Д | ||
| Классификация | |||
| Рег. номер CAS | 108-46-3 | ||
| PubChem | 5054 | ||
| Рег. номер EINECS | 203-585-2 | ||
| SMILES | |||
| InChI | |||
| RTECS | VG9625000 | ||
| ChEBI | 27810 | ||
| Номер ООН | 2876 | ||
| ChemSpider | 4878 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Резорци́н (резорцинол, 1,3-дигидроксибензол, мета-дигидроксибензол) — органическое соединение c химической формулой С6H4(OH)2, двухатомный фенол.
Бесцветные кристаллы со специфическим запахом.
Изомерен пирокатехину (орто-дигидроксибензол) и гидрохинону, (пара-дигидроксибензол) отличаясь от них лишь относительным расположением гидроксильных групп.
Физические свойства
Бесцветные кристаллы, до 70,8 °C существуют в α-модификации, выше в β-модификации. Легко растворим в этаноле, диэтиловом эфире, ацетоне, воде, труднорастворим в СНСl3, CS2, бензоле (в 100 г 2,2 г при 20 °C, 14,1 г при 60 °C).
Получение
Получают сульфированием бензола и затем сплавлением 1,3-бензолдисульфокислоты с щелочью, в частности едким натром[2].

Другие мета-замещённые производные бензола, например, 1,3-бромфенол, 1,3-бензолсульфокислота при сплавлении со щёлочью дают резорцин.
Также его получают окислением 1,3-диизопропилбензола кислородом воздуха с последующим кислотным гидролизом образующегося бисгидропероксида до резорцина и ацетона.

Химические свойства
Резорцин обладает свойствами фенолов. С щелочами образует соли — феноляты, с диметилсульфатом даёт монометиловый эфир резорцина и диметиловый эфир резорцина[3].

При взаимодействии с аммиаком образует 3-аминофенол.
Взаимное влияние двух групп ОН обеспечивает легкость вступления резорцина в реакции электрофильного замещения главным образом в положения 4(6), труднее — в положение 2. Так при взаимодействии с хлором и бромом образует 2,4,6-тригалогензамещенные, йодирование одним эквивалентом йода в водном растворе бикарбоната натрия ведет к образованию 2-йодрезоорцина с выходом 66%[4].
При действии азотистой кислоты на резорцин образуется 4-нитрозорезорцин, который конденсируется при окислении с резорцином с образованием резазурина[5]:
При взаимодействии с концентрированной азотной кислотой (d = 1,4 г/см³) и концентрированной серной кислоты нитруется до 2,4,6-тринитрорезорцина (стифниновой кислоты).
Резорцин легко вступает в реакции азосочетания, например с диазотированной сульфаниловой кислотой дает краситель резорциновый жёлтый.

С фталевым ангидридом в присутствии хлорида цинка (175—196 °С) конденсируется с образованием флуоресцеина.

С ледяной уксусной кислотой в присутствии хлорида цинка при 145 °C образует ацетофеноны.

Восстанавливает фелингову жидкость и аммиачный раствор хлорида серебра.
С пикриновой кислотой дает пикрат, т. пл. 89-90 °C.
Цветная реакция на резорцин: при взаимодействии с FeCl3 появляется темно-фиолетовое окрашивание, переходящее в чёрное.
При неправильном хранении резорцин из-за легкой склонности к окислению приобретает розовато-оранжевый цвет.
Применение
Резорцин применяется в производстве синтетических красителей, некоторых полимеров (например, резорцино-альдегидных смол), в медицине как обеззараживающее средство при лечении кожных заболеваний, из-за дубящих свойств вещества.
Как реагент для колориметрического определения фурфурола, углеводов, Zn, Pb и других элементов. Также применяется при производстве пластификаторов и в качестве поглотителя ультрафиолетового излучения в полимерах.
Является сырьем для производства стифниновой кислоты и других ВВ.
В прошлом резорцин-формалиновая паста использовалась в стоматологии для герметизации каналов зубов. В настоящее время редко используется из-за многочисленных побочных эффектов[6].
Безопасность
Пыль и пары резорцина раздражают кожу и слизистые оболочки глаз и дыхательных путей, вызывают кашель[7].
См. также
Примечания
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0543.html
- ↑ Бюлер К., Пирсон Д. Органические синтезы. Часть 1. М., Мир, 1973, стр. 281
- ↑ Органикум. Том 1. Москва, Мир, 1992, стр. 282
- ↑ "PREPARATION OF BENZOCYCLOBUTENONE DERIVATIVES BASED ON AN EFFICIENT GENERATION OF BENZYNES". Organic Syntheses. 84: 272. 2007. doi:10.15227/orgsyn.084.0272. eISSN 2333-3553. ISSN 0078-6209. Архивировано 14 апреля 2021. Дата обращения: 23 сентября 2020.
- ↑ Weselsky, P; Benedikt, R. {{{заглавие}}} (неопр.) // Monats.. — 1880. — Т. f. — С. 889.
- ↑ НЕКОТОРЫЕ АСПЕКТЫ ИСПОЛЬЗОВАНИЯ РЕЗОРЦИН-ФОРМАЛИНОВОГО МЕТОДА
- ↑ Диденко, 1995.
Литература
- Диденко С. И. Резорцин // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1995. — Т. 4: Полимерные — Трипсин. — С. 228. — 639 с. — 40 000 экз. — ISBN 5-85270-039-8.