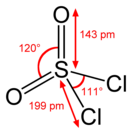
Сульфурилхлорид
| Сульфурилхлорид | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Систематическое наименование |
Хлорид сульфурила |
||
| Хим. формула | SO2Cl2 | ||
| Физические свойства | |||
| Состояние | бесцветная жидкость | ||
| Молярная масса | 134.965 г/моль | ||
| Плотность | 1.665 г/см³ | ||
| Поверхностное натяжение | 28,78 ± 0,01 мН/м[1] | ||
| Энергия ионизации | 12,05 эВ[2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −54,7 °C | ||
| • кипения | 69,2 °C | ||
| Энтальпия | |||
| • образования | −391,2 кДж/моль | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | гидролизуется | ||
| Структура | |||
| Дипольный момент | 6,0E−30 Кл·м[2] | ||
| Классификация | |||
| Рег. номер CAS | [7791-25-5] | ||
| PubChem | 24648 | ||
| Рег. номер EINECS | 232-245-6 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 29291 | ||
| ChemSpider | 23050 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Сульфурилхлорид (хлористый сульфурил) SO2Cl2 — хлорангидрид серной кислоты.
Свойства
Бесцветная, резко пахнущая жидкость, хорошо растворимая в хлороформе и уксусной кислоте, в избытке воды растворяется с частично протекающим гидролизом. Дымит на воздухе, гидролизуется по реакции:
Гидролиз идёт слабо в холодной воде, в горячей воде протекает быстро.
При хранении желтеет, поскольку распадается на SO2 и зеленовато-жёлтый хлор.
Получение
Получают взаимодействием SO2 с Cl2 в присутствии катализаторов (активированный уголь, камфора).
Применение
Сульфурилхлорид используется как растворитель для ряда органических и неорганических соединений.
Применяют в синтезе органических веществ (с ним активно проходит хлорирование[3]), вступает в реакции сульфохлорирования тиофенов через образование комплекса с ДМФА[4].
Пропусканием аммиака через раствор в петролейном эфире сульфурилхлорида и тионилхлорида получают хлорид α-сульфанура.
Примечания
- ↑ CRC Handbook of Chemistry and Physics (англ.) / David R. Lide, Jr. — 78 — United States of America: CRC Press, 1997. — P. 6—135. — ISBN 978-0-8493-0478-1
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Реми, Генрих. Курс неорганической химии. Том 1. /Пер. с нем. XI изд. под ред. акад. А. В. Новосёловой. Москва: Мир, 1972. —с. 700—701.
- ↑ Tyo Sone. The use of N,N-dimethylformamide-sulfonyl chloride complex for the preparation of thiophenesulfonyl chlorides (англ.) // Bull. Chem. Soc. Jpn.. — 1985. — Т. 58. — С. 1063-1064. — doi:10.1246/bcsj.58.1063.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4 (Пол-Три). — 639 с. — ISBN 5-82270-092-4.