Энергия сродства к электрону
Эне́ргия сродства́ к электро́ну, или сродство к электрону — энергия, выделяющаяся или поглощающаяся в процессе присоединения электрона к атому, молекуле или многоатомной системе.
В химии и атомной физике


В химии и атомной физике, под объектом, к которому будет присоединяться электрон, подразумевается свободный атом в его основном состоянии или молекула, превращающиеся при этом в отрицательный ион A−:
Здесь — энергия сродства к электрону.
Так понимаемое cродство к электрону численно равно и противоположно по знаку энергии ионизации соответствующего изолированного однозарядного аниона. Оно выражается в килоджоулях на моль (кДж/моль) или в электрон-вольтах на атом (эВ/атом).
В отличие от ионизационного потенциала атома, имеющего всегда эндоэнергетическое значение, сродство атома к электрону описывается как экзоэнергетическими, так и эндоэнергетическими значениями.
| Элемент | ε | Элемент | ε | Элемент | ε |
|---|---|---|---|---|---|
| H | 0,7542 | Na | 0,548 | K | 0,502 |
| He | -0,54 | Mg | -0,4 | Ca | -0,3 |
| Li | 0,618 | Al | 0,441 | Sc | 0,14 |
| Be | -0,5 | Si | 1,385 | Ti | -0,40 |
| B | 0,277 | P | 0,747 | V | -0,94 |
| C | 1,263 | S | 2,077 | Cr | -0,98 |
| N | -0,07 | Cl | 3,617 | Mn | 1,07 |
| О | 1,461 | Br | 3,365 | Fe | -0,58 |
| F | 3,399 | I | 3,06 | Co | -0,94 |
| Ne | -1,2(2) | Ni | -1,28 | ||
| Cu | -1,80 |
Сродство к электрону определяет окислительную способность частицы. Молекулы с большим сродством к электрону являются сильными окислителями. Наибольшим сродством к электрону обладают элементы 1 и 7 группы (p-элементы VII группы). Наименьшее сродство к электрону у атомов с конфигурацией s2 (Be, Mg, Zn) и s2p6 (Ne, Ar) или с наполовину заполненными p-орбиталями (N, P, As):
| Li | Be | B | C | N | O | F | Ne | |
|---|---|---|---|---|---|---|---|---|
| Электронная конфигурация | s1 | s2 | s2p1 | s2p2 | s2p3 | s2p4 | s2p5 | s2p6 |
| ε, эВ | -0,59 | 0,19 | -0,30 | -1,27 | 0,21 | -1,47 | -3,45 | 0,22 |
Небольшие расхождения в цифрах между табл. 1 и табл. 2 обусловлены тем, что данные взяты из разных источников, а также погрешностью измерений.
Наибольшее значение сродства к электрону имеет гексафторид платины: 7,00±0,35 эВ[1].
В физике твёрдого тела

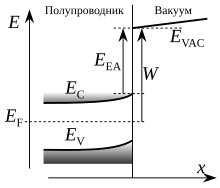
В физике твёрдого тела, в физике полупроводников и диэлектриков под сродством к электрону понимается разность между энергией края зоны проводимости материала и минимальной энергией электрона в вакууме[2].
Эта разность равна энергии, выделяющейся при перемещении электрона из вакуума (уровень энергии ) в среду, с попаданием данного электрона по энергии на дно зоны проводимости .
В таком случае объектом, принимающим электрон, становится не отдельный атом или молекула, а толща материала. Для энергии сродства к электрону в физике твёрдого тела используется обозначение или (от англ. electron affinity) а в качестве единицы измерения обычно используется электрон-вольт:
Численные значения величины существенно отличаются от значений для отдельных атомов того же вещества. Например, сродство к электрону к кремниевому кристаллу составляет 4,05 эВ, а к изолированному атому кремния 1,39 эВ/атом.
Знание величин важно для построения энергетических зонных диаграмм многослойных гетероструктур, так как от этих величин зависит разрыв зон на гетерограницах.
Наряду со сродством к электрону при изучении полупроводниковых структур используется понятие работы выхода, равной разности между уровнем вакуума и энергией Ферми вблизи поверхности рассматриваемого материала. При этом, если практически не зависит от концентрации легирующих примесей и наличия внешнего напряжения, то может варьироваться. Такое варьирование обусловлено изменением положения по отношению к краям энергетических зон , , зависящего, например, от степени легирования.
Примечания
- ↑ Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4 (Пол-Три). — 639 с. — ISBN 5-82270-092-4.
- ↑ Глазков В. Н. Контактные явления в полупроводниках. Построение энергетических диаграмм контактов полупроводников (заметки к лекциям по общей физике). MФТИ (2018). — см. стр. 5. Дата обращения: 26 сентября 2021. Архивировано 25 января 2022 года.
Литература
- Ахметов Н. С. Актуальные вопросы курса неорганической химии. — М.: Просвещение, 1991. — 224 с. ISBN 5-09-002630-0
- Корольков Д. В. Основы неорганической химии. — М.: Просвещение, 1982. — 271 с.










