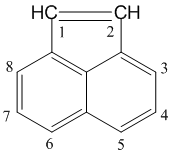
Аценафтилен
| Аценафтилен | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Аценафтилен |
| Хим. формула | C12H8 |
| Физические свойства | |
| Молярная масса | 152,18 г/моль |
| Плотность | 0,899 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 92-93 °C |
| • кипения | с разложением 265-275 °C |
| Классификация | |
| Рег. номер CAS | 208-96-8 |
| PubChem | 9161 |
| Рег. номер EINECS | 205-917-1 |
| SMILES | |
| InChI | |
| ChEBI | 33081 |
| ChemSpider | 8807 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Аценафтилен (трицикло-[6.3.1.04,12]-додека-1(12),2,4,6,8,10-гексаен) — полициклический ароматический углеводород.
Свойства
[править | править код]Аценафтилен представляет собой жёлтые кристаллы, нерастворимые в воде, но растворяющиеся в органических растворителях. Имеет высокую летучесть.
Благодаря наличию двойной связи аценафтилен способен полимеризоваться при 150—200°С с образованием полиаценафтилена. Он также образует сополимеры, в частности, с метилметакрилатом, стиролом и винилацетатом. Полимеризацией сопровождаются также реакции гидрирования, нитрования и сульфирования аценафтилена.
Способен легко реагировать с диенами, например, с бутадиеном образует продукт, дегидрирование которого приводит к флуорантену.
Нахождение в природе и получение
[править | править код]Аценафтилен обнаруживается в продуктах переработки сланцев, каменноугольной смоле и тяжёлой смоле пиролиза углеводородов. Синтез аценафтилена заключается в дегидрировании паров аценафтена при атмосферном давлении в присутствии воздуха или инертных разбавителей при температурах 300—600°С на катализаторах (например, оксид алюминия с оксидом марганца(III). Лабораторный метод состоит в сплавлении аценафтен-3-сульфокислоты или аценафтен-5-сульфокислоты со щелочами.
Применение
[править | править код]Аценафтилен используется как антиоксидант в получении полиолефинов и синтетических каучуков, а также как сополимер в производстве полимеров, углеводород-формальдегидных и углеводород-фенолоформальдегидных смол.
Литература
[править | править код]- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.