Циркадный ритм

Цирка́дные (циркадиа́нные) ри́тмы (от лат. circa «около, кругом» + dies «день») — циклические колебания интенсивности различных биологических процессов, связанные со сменой дня и ночи. Период циркадных ритмов обычно близок к 24 часам.
Несмотря на связь с внешними стимулами, циркадные ритмы имеют эндогенное происхождение, представляя, таким образом, биологические часы организма[1].
Циркадные ритмы присутствуют у таких организмов, как цианобактерии[2], грибы, растения, животные.
Самым известным циркадным ритмом является ритм сон-бодрствование.
История открытия
[править | править код]Впервые об изменении положения листьев в течение дня у тамаринда (Tamarindus indicus) упоминает описывавший походы Александра Македонского Андростен.
В Новое время в 1729 году французский астроном Жан-Жак де Меран сообщил о ежедневных движениях листьев у мимозы стыдливой (Mimosa pudica). Эти движения повторялись с определённой периодичностью даже если растения помещались в темноту, где отсутствовали такие внешние стимулы как свет, что позволило предположить эндогенное происхождение биологических ритмов, к которым были приурочены движения листьев растения. Де Меран предположил, что эти ритмы могут иметь что-то общее с чередованием сна и бодрствования у человека.
Декандоль в 1834 году определил, что период, с которыми растения мимозы совершают данные листовые движения, короче длины суток и составляет примерно 22—23 часа.
В 1880 году Чарльз Дарвин и его сын Фрэнсис сделали предположение о наследственной природе циркадных ритмов. Предположение о наследственной природе циркадных ритмов было подтверждено окончательно опытами, во время которых скрещивались растения фасоли, периоды циркадных ритмов которых различались. У гибридов длина периода отличалась от длины периода у обоих родителей.
Эндогенная природа циркадных ритмов была окончательно подтверждена в 1984 году во время опытов с грибами вида Нейроспора густая (Neurospora crassa), проведёнными в космосе. Эти опыты показали независимость околосуточных ритмов от геофизических сигналов, связанных с вращением Земли вокруг своей оси.
В 1970-е годы Сеймур Бензер и его ученик Рональд Конопка изучали, можно ли идентифицировать гены, которые контролируют циркадный ритм у плодовых мух. Они продемонстрировали, что мутации неизвестного гена нарушают циркадные часы мух. Неизвестный ген получил название ген периода — Per (от англ. period).
В 1984 году Джеффри Холл и Майкл Росбаш, работающие в тесном сотрудничестве в Брандейском университете в Бостоне, и Майкл Янг из Рокфеллеровского университета в Нью-Йорке смогли выделить ген Per. Затем Джеффри Холл и Майкл Росбаш обнаружили, что белок PER, кодируемый геном Per, накапливается в течение ночи и деградирует в течение дня. Таким образом, уровень белка PER колеблется в течение суток синхронно с циркадным ритмом. Учёные предположили, что белок PER блокирует активность гена Per. Они обосновали, что с помощью ингибирующей петли обратной связи белок может препятствовать своему собственному синтезу и тем самым регулировать собственный уровень в непрерывном циклическом ритме. Однако, чтобы блокировать активность гена Per, белок PER, который продуцируется в цитоплазме, должен был каким-то образом достигнуть клеточного ядра, где расположен генетический материал, — этот вопрос оставался невыясненным.
В 1994 году Майкл Янг обнаружил второй «часовой ген» циркадного ритма, timeless, кодирующий белок TIM, который требовался для нормального циркадного ритма. Майкл Янг показал, что когда белок TIM связан с белком PER, оба белка могут проникать в ядро клетки, где они блокируют активность гена Per, таким образом замыкая ингибирующую петлю обратной связи. Майкл Янг идентифицировал ещё один ген, doubletime, кодирующий белок DBT, который задерживал накопление белка PER. Совместное действие обнаруженных генов обеспечило понимание, как корректируется циркадный ритм для более точного соответствия 24-часовому циклу.
В последующие годы были выяснены другие молекулярные компоненты механизма, объясняющие его стабильность и функционирование. Были определены дополнительные белки, необходимые для активации гена Per, а также механизм, посредством которого свет может синхронизировать цикл.
В 2017 году Джеффри Холл, Майкл Росбаш и Майкл Янг были удостоены Нобелевской премии за открытие молекулярных механизмов, контролирующих циркадный ритм[3].
Циркадные ритмы растений
[править | править код]Циркадные ритмы растений связаны со сменой дня и ночи и важны для адаптации растений к суточным колебаниям таких параметров как температура, освещение, влажность. Растения существуют в постоянно меняющемся мире, поэтому циркадные ритмы важны для того, чтобы растение могло дать надлежащий ответ на абиотический стресс. Изменение положения листьев в течение суток — лишь один из многих ритмических процессов у растений. В течение суток колеблются такие параметры, как активность ферментов, интенсивность газообмена и фотосинтетическая активность.
В способности растений распознавать чередование дня и ночи играет роль фитохромная система. Примером работы такой системы является ритм цветения у растения Pharbitis nil. Цветение у этого растения зависит от длины светового дня: если день короче определённого интервала, то растение цветет, если длиннее — вегетирует. В течение суток условия освещения меняются из-за того, что солнце находится под разными углами к горизонту, и соответственно меняется спектральный состав света, что воспринимается различными фитохромами которые возбуждаются светом с разной длиной волны. Так, вечером в спектре много дальних красных лучей, которые активизируют только фитохром А, давая растению сигнал о приближении ночи. Получив этот сигнал, растение принимает соответствующие меры. Важность фитохромов для температурной адаптации была выяснена во время опытов с трансгенными осинами Populus tremula, у которых продукция фитохрома A была повышена. Растениям постоянно «казалось», что они получают свет высокой интенсивности, и таким образом не могли адаптироваться к суточным колебаниям температуры и страдали от ночных заморозков.
При исследовании суточных ритмов у арабидопсис была также показана фотопериодичность работы трёх генов для белков CO, FKF1 и G1. Ген constans участвует в определении времени цветения. Синтез продукта гена — белка CO запускается комплексом из белков FKF1 и G1. В этом комплексе продукт гена FKF1 играет роль фоторецептора. Синтез белка CO запускается через 4 часа после начала освещения и останавливается в темноте. Синтезированный белок за ночь разрушается, и таким образом необходимая для цветения растения концентрация белка достигается только в условиях долгого летнего дня.
Циркадные ритмы у животных
[править | править код]Практически все животные приспосабливают свои физиологические и поведенческие процессы к суточным колебаниям абиотических параметров. Примером циркадного ритма у животных является цикл сон-бодрствование. У человека и других животных существуют внутренние часы (часто применяется термин «биологические часы»), которые идут даже в отсутствие внешних стимулов и дают информацию о времени суток. Исследование молекулярно-биологической природы этих часов началось в 1960-х — 1970-х годах[4]. Сеймур Бензер и Рональд Конопка, работавшие в Калифорнийском технологическом институте, обнаружили три мутантные линии дрозофил, циркадные ритмы которых отличались от циркадных ритмов мушек дикого типа. Дальнейший анализ показал, что у мутантов изменения затрагивали аллели одного локуса, который был назван исследователями per (от period).
В отсутствие нормальных сигналов окружающей среды период околосуточной активности у мушек дикого типа составлял 24 часа, у мутантов per-s — 19 часов (short period[5]), у мутантов per-l — 29 часов (long period[5]), у мутантов per-0 вообще не наблюдалось никакого ритма. Впоследствии было обнаружено, что продукты генов per есть во многих клетках дрозофил, участвующих в продукции циркадного ритма насекомого. Более того, у мушек дикого типа наблюдаются циркадные колебания в концентрации матричной РНК (мРНК) гена per[4] и белка PER (по существующей в молекулярной биологии номенклатуре гены обозначаются строчными, а их белковые продукты — прописными буквами[6]), в то время как у мушек per-0, у которых нет циркадного ритма, экспрессия генов не наблюдается.
У млекопитающих главными генами, лежащими в основе циркадианного молекулярного осциллятора супрахиазматического ядра (СХЯ) гипоталамуса, являются гены mPer1 и mPer2 («m» означает «mammalian», то есть period-ген млекопитающих). Экспрессия mPer1 и mPer2 регулируется транскрипционными факторами CLOCK и BMAL1. Гетеромеры CLOCK/BMAL1 связываются с промоторами генов mPer1 и mPer2, что инициирует их транскрипцию. Образующиеся в результате этого мРНК транслируются в цитоплазме клеток СХЯ в белки mPER1 и mPER2. Эти белки проникают в ядра клеток и, будучи теперь уже связанными с белками mCRY1 и mCRY2, подавляют транскрипцию генов mPer1 и mPer2, связываясь с CLOCK/BMAL1-белками. Таким образом, по механизму отрицательной обратной связи формируется чередование подъёмов и спадов продукции мРНК, а затем и самих белков mPER1 и mPER2 с фазой, равной приблизительно 24 ч. Этот цикл подстраивается под ритм освещенности[7].
Существует несколько дополнительных молекулярных циклов, регулирующих циклическую экспрессию генов mPer1 и mPer2. Белок BMAL1 тоже синтезируется циклически, и его продукция находится в противофазе с ритмом экспрессии генов mPer1 и mPer2. Транскрипция гена Bmal1 индуцируется белком mPER2 и тормозится белком REV-ERBα. В промоторах генов Cry1 и Cry2 содержится та же нуклеотидная последовательность (Е-box), что и в промоторах генов mPer1 и mPer2, поэтому транскрипция генов Cry1 и Cry2 позитивно регулируется комплексом CLOCK/BMAL1. То же самое справедливо и для транскрипции гена Rev-Erbα[7].
Осцилляции, генерируемые на уровне этих генов и белковых продуктов их экспрессии, амплифицируются и распространяются за пределы СХЯ по всему организму. Например, ген вазопрессина, одного из нейромедиаторов СХЯ, также имеет промотор, содержащий E-box, в результате чего за счёт вазопрессина циркадианный сигнал передаётся в другие отделы нервной системы. Другие нейромедиаторные системы, находящиеся под контролем СХЯ — глутамат- и ГАМК-эргические, пептидергические и моноаминергические системы. Также имеется нейрогуморальный путь распространения циркадианного сигнала по всему организму с вовлечением эпифизарного гормона мелатонина[7].
В зависимости от предмета рассмотрения, биологические часы как понятие, относящееся к чувству времени и ведению суточных ритмов, располагают или в СХЯ, или в эпифизе[8]:261, или понятие экстраполируется на всю систему[9]:11.
Циркадные ритмы и цикл сон-бодрствование человека
[править | править код]Эндогенная продолжительность циркадного ритма
[править | править код]Первые эксперименты по изоляции людей от таких датчиков времени, как часы и солнечный свет, привели к тому, что у подопытных вырабатывался примерно 25-часовой циркадный ритм. Ошибка эксперимента состояла в том, что участникам разрешалось включать и выключать свет (торшер с тусклым освещением[10]:241) по своему усмотрению. Чрезмерное использование искусственного освещения перед сном приводило к увеличению продолжительности ритма. Последующее более корректно проведённое исследование показало, что период эндогенного циркадного ритма составляет в среднем 24 часа 11 минут[11][12]. Ещё одно исследование в группе из 157 человек показало следующие результаты:
- 24,15±0,2 ч (24 ч 9±12 мин) — для всей группы;
- 24,09±0,2 ч (24 ч 5±12 мин) — у женщин;
- 24,19±0,2 ч (24 ч 11±12 мин) — у мужчин.
Циркадный период у женщин оказался несколько короче, чем у мужчин, период менее 24 часов наблюдался у 35 % женщин и у 14 % мужчин[13].
А. А. Путилов, ссылающийся на данные большинства проведённых экспериментов, указывает среднее значение периода свободно текущего ритма у человека, находящегося в условиях постоянного тусклого освещения, в интервале 23,47—24,64 часа[10]:247. К. В. Даниленко указывает верхнюю границу интервала 24,78 часа (середина интервала 24,12 часа)[14].
Эндогенный ход биологических (или внутренних) часов в организме пропорционален периоду суточных ритмов в культуре фибробластов, оценённому на основании экспрессии гена Bmal1, — это подтверждает, что суточная ритмичность генетически детерминирована[15].
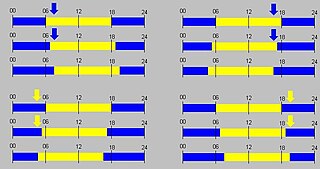
Состояние внутренних часов, полоса:
синяя — «ночь», жёлтая — «день».
Воздействие датчика времени, стрелка:
синяя — темнота, жёлтая — свет.
Вверху слева: В 6:00 (время здесь и далее условно) внутренние часы уже ожидают наступления дня (жёлтая полоса), но в 7:00 ещё темно (синяя стрелка). Организм адаптируется к более позднему рассвету.
Вверху справа: Внутренние часы в состоянии «день» не ожидают наступления ночи до 18:00, но в 17:00 уже темно. Организм адаптируется к более раннему наступлению ночи.
Внизу слева: В 5:00 внутренние часы всё ещё в состоянии «ночь», но уже светло.
Внизу справа: В 19:00 внутренние часы уже в состоянии «ночь», но ещё светло
Синхронизация с внешними условиями
[править | править код]Одним из наиболее эффективных внешних сигналов («синхронизаторов», или «датчиков времени»[16] — нем. Zeitgeber, англ. time giver), поддерживающих 24-часовый цикл, является свет. Воздействие света в ранние утренние часы способствует опережению ритма внутренних часов, то есть более раннему пробуждению и последующему за периодом бодрствования засыпанию. Воздействие света в поздние вечерние часы приводит к задержке ритма — более позднему засыпанию и пробуждению. Таким образом световое воздействие ежедневно подстраивает (увлекает, англ. entrainment — увлечение, унос) свободно текущий ритм утром и вечером[10]:247. В этом процессе участвуют как палочки и колбочки, взаимодействующие с ганглионарными клетками сетчатки глаза, так и особые светочувствительные ганглионарные клетки[англ.] сетчатки (ipRGC), содержащие пигмент меланопсин[англ.], которые воспринимают синий цвет спектра и напрямую посылают сигнал в СХЯ. Благодаря второму механизму некоторые из слепых людей с полной потерей цветового и светового зрения не испытывают проблем с подстройкой ритма под 24-часовой цикл освещённости[10]:240[17].
Среди других возможных синхронизирующих факторов в ряде работ отмечались солнечно-суточные вариации геомагнитного поля[18]:85—87, достигающие сравнительно больших значений в средних широтах[19][20], а также суточные вариации электрического поля атмосферы Земли[21]. Однако пока неизвестно, как эти изменения влияют на происходящие в организме биохимические и биофизические процессы — как действуют приёмники (рецепторы) геомагнитных и электрических сигналов (см. Магниторецепция, Электрорецепция), реагирует ли человек на воздействие всем организмом, отдельными органами или на клеточном уровне. Исследования показывают, что, например, геомагнитные бури вызывают адаптационный стресс, сбивающий циркадный ритм так же, как и резкая смена часовых поясов[18]:85—87.
У людей в изолированных условиях, например у космонавтов, 24-часовой циркадный ритм поддерживается с помощью освещения[22]. Для возможного полёта людей на Марс проводились исследования по увлечению циркадного ритма человека воздействием освещения с периодом 23,5 часа и 24,65 часа (последнее соответствует периоду марсианских солнечных суток). Показана возможность такого увлечения воздействием умеренно яркого света в первой или во второй половине запланированного эпизода бодрствования[23].
В условиях низкой освещённости (до 30 лк) такие факторы, как стабильный режим сна-бодрствования, приём пищи, положение тела, знание времени суток, неэффективны (по сравнению с циклом свет — темнота) для синхронизации 24-часового циркадного ритма, поэтому фазы суточных ритмов секреции мелатонина и температуры тела сдвигаются в равной степени на более раннее или позднее время, что отражает эндогенный ход центральных биологических часов[14]. Если человек не спит ночью и воспринимает свет или, наоборот, спит днём и не воспринимает свет, то циклические процессы в его организме не получают правильного внешнего сигнала и между ними возникает рассогласование, десинхроноз[15].
Способность светового воздействия сдвигать фазу внутренних часов как на запаздывание (свет в начале ночи), так и на опережение (свет перед пробуждением) используется в фототерапии, причём воздействие в самом начале или в самом конце ночи приводит к небольшим сдвигам. Чем ближе световое воздействие к середине ночи, тем больше фазовый сдвиг — он может достигать нескольких часов. Световое воздействие в дневном интервале суточного ритма практически не сдвигает его фазу. Для исследования реакции циркадного ритма на внешнее воздействие в практику хронобиологии был введён инструмент под названием «кривая фазового отклика[англ.]»[10]:244—245.
«Сильные» и «слабые» ритмы
[править | править код]Два циркадных ритма с одним и тем же свободно текущим периодом могут по-разному вести себя в зависимости от силы лежащего в их основе колебательного процесса. Генерируемый организмом ритм называют «сильным», если область возможной подстройки его периода достаточно узкая, например, в пределах 23,5—24,5 часа. К группе «сильных» ритмов относятся в первую очередь ритмы температуры тела и секреции мелатонина (самые изученные процессы), а также, например, ритм «бодрость-сонливость». Последний не является простым отражением цикла «сон-бодрствование», относящегося к группе «слабых» ритмов. Для «слабых» ритмов характерна более широкая область подстройки периода. Так, человек, изолированный от внешних сигналов времени, в условиях тусклого освещения может довольно долго жить по навязанному ему режиму сна-бодрствования с периодом 21 или 27 часов (а также 20 или 28 часов[24]). Под такой режим неспособно подстроиться большинство ритмических процессов, наиболее стабильных в условиях постоянного освещения и наиболее строго контролируемых биологическими часами[10]:242, 248.
Хронотип
[править | править код]Циркадная система человека имеет индивидуальные отличия. Наиболее ярким их проявлением служит хронотип. Он бывает ранним («жаворонки»), промежуточным («голуби») и поздним («совы»). Люди, относящиеся к раннему хронотипу, ложатся спать и просыпаются в среднем на два часа раньше «сов» и достигают пика интеллектуальной и физической активности в первой половине дня. У людей, относящихся к позднему хронотипу, максимум умственной и физической работоспособности приходится на вторую половину дня. Среди мужчин и двадцатилетней молодежи преобладают «совы», а дети и пожилые люди чаще «жаворонки»[25].
Как правило (не строго), эндогенная продолжительность циркадного ритма у «жаворонков» меньше 24 часов, а у «сов» больше — у них сон, особенно зимой, уходит на более позднее время[10]:261[26].
Ритм работы внутренних органов
[править | править код]Некоторые авторы описывают суточные ритмы работы внутренних органов человека[27]. Поскольку статьи с такими сведениями практически или вовсе не цитируются в научной литературе, их ценность сомнительна.
Нарушения циркадного ритма человека
[править | править код]С нарушениями циркадного ритма тесно связаны нарушения сна — джетлаг, расстройство, связанное со сменным графиком работы, бессонница выходного дня и т. п.[28] Также с нарушением циркадного ритма связывают такие нарушения сна, как[29][30]:
- синдром задержки фазы сна — характеризуется поздним засыпанием и пробуждением с невозможностью сместить время сна на более ранние часы;
- синдром опережения фазы сна — характеризуется слишком ранним наступлением сонливости и ранним пробуждением;
- синдром не-24-часового сна-бодрствования — характеризуется ежедневным смещением времени засыпания и пробуждения на более позднее время;
- нерегулярный ритм сна-бодрствования — характеризуется отсутствием стабильного ритма сна-бодрствования; пациенты спят несколько раз в сутки в разное время.
См. также
[править | править код]Примечания
[править | править код]- ↑ Красавин B. А., Лебедев A. H.; Бодров B. А. (косм.), Луговой Л. А. (физ.). Биологические ритмы // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б. В. Петровский. — 3-е изд. — М. : Советская энциклопедия, 1976. — Т. 3 : Беклемишев — Валидол. — С. 157—160. — 584 с. : ил.
- ↑ Опыт показал связь циркадного ритма и клеточного деления Архивная копия от 23 октября 2010 на Wayback Machine. — 23 марта 2010
- ↑ Нобелевская премия по физиологии и медицине 2017. Дата обращения: 2 октября 2017. Архивировано 11 октября 2017 года.
- ↑ 1 2 Химия и Жизнь - О летнем времени и биологических часах. www.hij.ru. Дата обращения: 23 февраля 2017. Архивировано 23 февраля 2017 года.
- ↑ 1 2 Влияние генов на поведение мушки-дрозофилы. biofile.ru. Дата обращения: 23 февраля 2017. Архивировано 23 февраля 2017 года.
- ↑ Хронобиология - Стр 20. StudFiles. Дата обращения: 23 февраля 2017. Архивировано 23 февраля 2017 года.
- ↑ 1 2 3 Разыграев А.В., Керкешко Г.О., Арутюнян А.В. Пути циркадианного контроля продукции гонадотропин- рилизинг-гормона // Журнал акушерства и женских болезней. — 2011. — Т. LX, вып. 2. — С. 88—98. — ISSN 1684-0461. Архивировано 28 января 2022 года.
- ↑ Мичурина С. В., Васендин Д. В., Ищенко И. Ю. Физиологические и биологические эффекты мелатонина: некоторые итоги и перспективы изучения Архивная копия от 8 января 2021 на Wayback Machine // Российский физиологический журнал им. И. М. Сеченова. — 2018. — Т. 104, № 3. — С. 257—271.
- ↑ Цфасман А. З. Мелатонин: нормативы при различных суточных режимах, профессиональные аспекты в патологии Архивная копия от 16 мая 2018 на Wayback Machine // Научный клинический центр ОАО «РЖД». МИИТ — кафедра «Железнодорожная медицина», Академия транспортной медицины. — 2015. — 64 с.
- ↑ 1 2 3 4 5 6 7 Путилов А. А. Хронобиология и сон (Глава 9) Архивная копия от 20 октября 2021 на Wayback Machine // Национальное руководство памяти А. М. Вейна и Я. И. Левина. — М.: ООО «Медконгресс», 2019. — С. 235—265.
- ↑ Charles A. Czeisler, Jeanne F. Duffy, Theresa L. Shanahan, Emery N. Brown, Jude F. Mitchell, David W. Rimmer, Joseph M. Ronda, Edward J. Silva, James S. Allan, Jonathan S. Emens, Derk-Jan Dijk, Richard E. Kronauer. Stability, Precision, and Near-24-Hour Period of the Human Circadian Pacemaker // Science : журнал. — 1999. — 25 июня (т. 284, № 5423). — doi:10.1126/science.284.5423.2177. — PMID 10381883. Архивировано 23 июля 2018 года.
- ↑ William J. Cromie. Human Biological Clock Set Back an Hour // The Harvard Gazette : сайт. — 1999. — 15 июля. Архивировано 11 июля 2016 года.
- ↑ Jeanne F. Duffy, Sean W. Cain, Anne-Marie Chang, Andrew J. K. Phillips, Mirjam Y. Münch. Sex difference in the near-24-hour intrinsic period of the human circadian timing system // Proceedings of the National Academy of Sciences of the United States of America. — 2011-09-13. — Т. 108, вып. Suppl 3. — С. 15602–15608. — ISSN 0027-8424. — doi:10.1073/pnas.1010666108. Архивировано 17 марта 2021 года.
- ↑ 1 2 Даниленко К. В. Роль световых воздействий в регуляции суточной, месячной и годовой цикличности у человека. — Новосибирск, 2009. Архивировано 24 октября 2021 года.
- ↑ 1 2 Буш Е. Десинхроноз: природа всегда права Архивная копия от 16 октября 2021 на Wayback Machine / Наука и практика. Интервью с Константином Даниленко // Медицинская газета. — 2013. — № 53. (19 июля).
- ↑ Биологические ритмы. medbookaide.ru. Дата обращения: 18 марта 2016. Архивировано 27 марта 2016 года.
- ↑ Синий и зелёный свет будят человека по-разному • Новости науки. «Элементы» (4 июня 2010). Дата обращения: 14 октября 2021. Архивировано 24 октября 2021 года.
- ↑ 1 2 Беспятых А. Ю. и др. Мелатонин: теория и практика Архивная копия от 20 сентября 2021 на Wayback Machine / Под ред. С. И. Рапопорта, В. А. Голиченкова. — М.: ИД «Медпрактика-М», 2009. — 99 с.
- ↑ Лекция 4. StudFiles. Дата обращения: 15 августа 2018. Архивировано 15 августа 2018 года.
- ↑ Хальберт Е. О. Вариации магнитного поля Земли и полярные сияния Архивная копия от 10 августа 2017 на Wayback Machine // Успехи физических наук. — 1937. — Т. XVIII, вып. I. — С. 20—30.
- ↑ Торопов А. А., Козлов В. И., Каримов Р. Р. Вариации атмосферного электрического поля по наблюдениям в Якутске Архивная копия от 12 января 2019 на Wayback Machine // Наука и образование. — 2016. — № 2. — С. 60—61.
- ↑ Нобелиаты по медицине: «Лучшее, что можно сделать при джетлаге, — это спать». indicator.ru (7 декабря 2017). Дата обращения: 13 октября 2021. Архивировано 27 октября 2021 года.
- ↑ Frank A.J.L. Scheer, Kenneth P. Wright, Richard E. Kronauer, Charles A. Czeisler. Plasticity of the Intrinsic Period of the Human Circadian Timing System // PLoS ONE. — 2007-08-08. — Т. 2, вып. 8. — ISSN 1932-6203. — doi:10.1371/journal.pone.0000721. Архивировано 7 мая 2021 года.
- ↑ James K. Wyatt, Angela Ritz-De Cecco, Charles A. Czeisler, Derk-Jan Dijk. Circadian temperature and melatonin rhythms, sleep, and neurobehavioral function in humans living on a 20-h day.
- ↑ Часовые пояса с точки зрения хронобиологии | Научно-популярный журнал "Химия и Жизнь". hij.ru. Дата обращения: 7 апреля 2020. Архивировано 7 апреля 2020 года.
- ↑ Ложитесь спать. sib.fm. Дата обращения: 24 октября 2021. Архивировано 24 октября 2021 года.
- ↑ Земскова Ю.А. Биоритмы и часы работы внутренних органов // Наука и современность : журнал. — 2014. — № 27. — С. 31—35. Архивировано 24 октября 2021 года.
- ↑ Комплекс статей по циркадным нарушениям ритма (популярные, научные). Дата обращения: 26 июля 2014. Архивировано 31 июля 2014 года.
- ↑ Кельмансон И. А. Экологические и клинико-биологические аспекты нарушений циркадианных ритмов сон-бодрствование у детей и подростков // Биосфера : междисциплинарный научный и прикладной журнал. — 2015. — Т. 7, № 1. Архивировано 2 апреля 2022 года.
- ↑ Международная классификация болезней 10-го пересмотра. ICD10data.com. Дата обращения: 11 апреля 2018. Архивировано 29 марта 2018 года.
Литература
[править | править код]- Purves D. et al (2004). ‘’Neuroscience’’. Sinauer Associates, Inc. Publishers Sunderland, Massachusetts U.S.A
- Алехина Н. Д. и др (2005) ‘’Физиология растений’’. М.: Издательский центр «Академия»
- McClung C. (2006). ‘’Plant Circadian rhythms’’
- Zehring W. A., Wheeler D. A., Reddy P., Konopka R. J., Kyriacou C. P., Rosbash M., and Hall J. C. (1984). P-element transformation with period locus DNA restores rhythmicity to mutant, arrhythmic Drosophila melanogaster. Cell 39, 369—376.
- Bargiello T. A., Jackson F. R., and Young M. W. (1984). Restoration of circadian behavioural rhythms by gene transfer in Drosophila. Nature 312, 752—754.
- Siwicki K. K., Eastman C., Petersen G., Rosbash M., Hall J. C. (1988). Antibodies to the period gene product of Drosophila reveal diverse tissue distribution and rhythmic changes in the visual system. Neuron 1, 141—150.
- Hardin P. E., Hall J. C., and Rosbash M. (1990). Feedback of the Drosophila period gene product on circadian cycling of its messenger RNA levels. Nature 343, 536—540.
- Liu X., Zwiebel L. J., Hinton D., Benzer S., Hall J. C., and Rosbash M. (1992). The period gene encodes a predominantly nuclear protein in adult Drosophila. J Neurosci 12, 2735—2744.
- Vosshall L. B., Price J. L., Sehgal A., Saez L., and Young M. W. (1994). Block in nuclear localization of period protein by a second clock mutation, timeless. Science 263, 1606—1609.
- Price J. L., Blau J., Rothenfluh A., Abodeely M., Kloss B., and Young M. W. (1998). double-time is a novel Drosophila clock gene that regulates PERIOD protein accumulation. Cell 94, 83-95.