Нитрат хлора
| Нитрат хлора | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
нитрат хлора | ||
| Традиционные названия | нитрилгипохлорит | ||
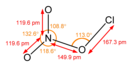
| Хим. формула | ClNO3 | ||
| Рац. формула | ClONO2 | ||
| Физические свойства | |||
| Состояние | желтоватая жидкость | ||
| Молярная масса | 97,46 г/моль | ||
| Плотность | 1,65 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -107 °C | ||
| • кипения | 22,3 °C | ||
| Химические свойства | |||
| Растворимость | |||
| • в тетрахлорметане | растворим | ||
| • в трихлорфторметане | растворим[1] | ||
| Классификация | |||
| Рег. номер CAS | 14545-72-3 | ||
| PubChem | 114934 | ||
| SMILES | |||
| InChI | |||
| ChemSpider | 102875 | ||
| Безопасность | |||
| Пиктограммы ECB |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Нитрат хлора — неорганическое соединение с формулой ClNO3. Подвижная бледно-жёлтая жидкость, которая взрывается при контакте с многими органическими веществами, металлами и их хлоридами.
Получение
[править | править код]Взаимодействие оксида хлора(I) и азотного ангидрида:
При более низкой температуре вещество можно получить из фторида хлора(I) и безводной азотной кислоты:
Нитрат хлора также образуется в стратосфере при реакции радикала ClO с диоксидом азота[2]:
Применение
[править | править код]Может использоваться как источник нитрат-ионов, который, в отличие от N2O4 и N2O5, не осложняет реакции катионами NO+ и NO2+[3]:
Примечания
[править | править код]- ↑ Martin Schmeisser. Chlorine(I) nitrate // Inorganic Syntheses. — McGraw-Hill Book Company, Inc, 1967. — С. 127–130.
- ↑ James J. Margitan: Chlorine nitrate photochemistry. Photolysis products and kinetics of the reaction atomic chlorine + chlorine nitrate (ClONO2) .fwdarw. molecular chlorine + nitrate. In: The Journal of Physical Chemistry. 87, 1983, S. 674—679, doi:10.1021/j100227a029
- ↑ Нитрат хлора представляет собой жёлтую жидкость с температурой плавления —107°, … — Справочник химика 21