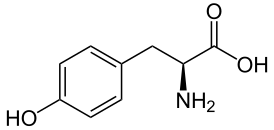
Тирозин
| Тирозин | |
|---|---|
  | |
| Общие | |
| Систематическое наименование |
2-амино-3-(4- гидроксифенил) пропановая кислота |
| Сокращения |
Тир, Tyr, Y UAU,UAC |
| Хим. формула | C9H11NO3 |
| Рац. формула | C9H11NO3 |
| Физические свойства | |
| Молярная масса | 181,19 г/моль |
| Плотность | 1,456 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 343 °C |
| Химические свойства | |
| Константа диссоциации кислоты |
2,24 9,04 10,10 |
| Изоэлектрическая точка | 5,66 |
| Классификация | |
| Рег. номер CAS | [60-18-4] |
| PubChem | 6057 и 6942100 |
| Рег. номер EINECS | 200—460-4 |
| SMILES | |
| InChI | |
| ChEBI | 17895 и 58315 |
| ChemSpider | 5833 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Тирози́н (α-амино-β-(п-гидроксифенил) пропионовая кислота, сокращения: Тир, Tyr, Y) — ароматическая альфа-аминокислота. Существует в двух оптически изомерных формах — L и D и в виде рацемата (DL). По строению соединение отличается от аминокислоты фенилаланина наличием фенольной гидроксильной группы в пара-положении бензольного кольца.
В составе белков и других соединений остаток молекулы тирозина принято называть тирозил.
Также известны биохимически менее важные мета- и орто- изомеры тирозина.
История
[править | править код]Тирозин впервые выделил — в 1846 году, из белка казеина, содержащегося в сыре, — немецкий химик Юстус фон Либих и он же дал аминокислоте название, происходящее от греческого слова «tyros», означающее «сыр»[1][2].
Функции
[править | править код]L-тирозин является протеиногенной аминокислотой и входит в состав белков всех известных живых организмов. Тирозин входит в состав ферментов, во многих из которых именно тирозину отведена ключевая роль в ферментативной активности и её регуляции. Местом атаки фосфорилирующих ферментов протеинкиназ часто является именно фенольный гидроксил остатков тирозина. Остаток тирозина в составе белков может подвергаться и другим посттрансляционным модификациям. В некоторых белках (резилин насекомых) присутствуют молекулярные сшивки, возникающие в результате посттрансляционной окислительной конденсации остатков тирозина с образованием дитирозина и тритирозина.
Остаток тирозина также играет важную роль в фотосинтезе. В хлоропластах (фотосистема II) он действует как донор электронов при восстановлении окисленного хлорофилла. В этом процессе он теряет атом водорода своей фенольной ОН-группы. Этот радикал впоследствии восстанавливается в фотосистеме II четырьмя основными кластерами марганца.
Окрашивание в результате ксантопротеиновой качественной реакции на белки определяется преимущественно нитрованием остатков тирозина (нитруются также остатки фенилаланина, триптофана, и гистидина).
Биосинтез
[править | править код]
В процессе биосинтеза тирозина промежуточными соединениями являются шикимат, хоризмат, префенат. Из центральных метаболитов тирозин в природе синтезируют микроорганизмы, грибы и растения. Животные не синтезируют тирозин de novo, но способны гидроксилировать незаменимую аминокислоту фенилаланин в тирозин. Более подробно биосинтез тирозина рассмотрен в статье шикиматный путь.
Тирозин относят к заменимым для человека и большинства других животных аминокислотам, так как в организме эта аминокислота образуется из другой (незаменимой) аминокислоты — фенилаланина.
Метаболизм
[править | править код]
Фосфорилирование и сульфатирование
[править | править код]Некоторые из остатков тирозина могут быть помечены (по гидроксильной группе) фосфатной группой (фосфорилированной) протеинкиназами. В своей фосфорилированной форме тирозин называется фосфотирозином. Фосфорилирование тирозина считается одним из ключевых этапов передачи сигнала и регуляции ферментативной активности. Фосфотирозин может быть обнаружен с помощью специфических антител. Остатки тирозина также могут быть модифицированы путём добавления сульфатной группы (процесс, известный как сульфатирование тирозина)[3]. Сульфатирование тирозина катализируется тирозилпротеинсульфотрансферазой (TPST). Как и упомянутые выше антитела к фосфотирозину, недавно были описаны антитела, которые специфически обнаруживают сульфотирозин[4].
Предшественник нейротрансмиттеров и гормонов
[править | править код]В дофаминергических клетках головного мозга тирозин превращается в L-ДОФА с помощью фермента тирозингидроксилазы (TH). Это фермент, ограничивающий скорость, участвующий в синтезе нейромедиатора дофамина. Затем дофамин может быть преобразован в другие катехоламины, такие как норадреналин (норадреналин) и адреналин (адреналин).
Гормоны щитовидной железы трийодтиронин (Т3) и тироксин (Т4) в коллоиде щитовидной железы также являются производными веществами от тирозина.
Предшественник алкалоидов
[править | править код]Было показано, что латекс Papaver somniferum, опийного мака, превращает тирозин в алкалоид морфин, и был установлен биосинтетический путь от тирозина к морфину с использованием радиоактивно меченого углеродом-14 тирозина для изучения пути синтеза in vivo[5].
Предшественник природных фенолов
[править | править код]Тирозин-аммиачная лиаза (TAL) представляет собой фермент в пути биосинтеза природных фенолов. Он превращает L-тирозин в п-кумаровую кислоту.
Предшественник пигментов
[править | править код]Тирозин также является предшественником пигмента меланина.
Роль в синтезе коэнзима Q10
[править | править код]Тирозин (или его предшественник фенилаланин) необходим для синтеза структуры бензохинона, которая входит в состав кофермента Q10.
Деградация
[править | править код]
В организм человека и других животных тирозин поступает с пищей. Также тирозин образуется из фенилаланина (реакция протекает в печени под действием фермента фенилаланин-4-гидроксилазы). Превращение фенилаланина в тирозин в организме в большей степени необходимо для удаления избытка фенилаланина, а не для восстановления запасов тирозина, так как тирозин обычно в достаточном количестве поступает с белками пищи, и его недостатка в организме, как правило, не возникает. Таким образом уменьшается избыток тирозина, образующегося при расщеплении белков. Тирозин путём переаминирования с α-кетоглутаровой кислотой превращается в 4-гидроксифенилпируват, который далее окисляется (с одновременной миграцией и декарбоксилированием кетокарбоксиэтильного заместителя) в гомогентизат. Гомогентизат через стадии образования 4-малеилацетоацетата и 4-фумарилацетоацетата распадается до фумарата и ацетоацетата. Окончательное разрушение этих продуктов происходит в цикле Кребса.
Таким образом, у животных и человека тирозин распадается до фумарата (превращается в оксалоацетат, являющийся субстратом глюконеогенеза) и ацетоацетата (повышает уровень кетоновых тел в крови), поэтому тирозин, а также превращающийся в него фенилаланин, по характеру катаболизма у животных относят к глюко-кетогенным (смешанным) аминокислотам (см. классификацию аминокислот).
Также известны и другие пути метаболизма тирозина в других организмах.
Орто- и мета-тирозин
[править | править код]
Известны три структурных изомера L-тирозина. В дополнение к распространенной аминокислоте L-тирозину, который является параизомером (пара-tyr, p-tyr или 4-гидроксифенилаланин), существуют два дополнительных региоизомера, а именно метатирозин (также известный как 3-гидроксифенилаланин, L-m-тирозин и m-tyr) иорто-тирозин (o-tyr или 2-гидроксифенилаланин), встречающийся в природе. Редкие изомеры m-tyr и o-tyr образуются в результате неферментативного свободнорадикального гидроксилирования фенилаланина в условиях окислительного стресса[6][7].
м-Тирозин и его аналоги (редкие в природе, но доступные синтетически) показаны при болезни Паркинсона, болезни Альцгеймера и артрите[8].
Клиническое значение
[править | править код]С обменом тирозина связаны некоторые известные наследственные заболевания. При наследственном заболевании фенилкетонурии превращение фенилаланина в тирозин нарушено, и в организме происходит накопление фенилаланина и его метаболитов (фенилпируват, фениллактат, фенилацетат, орто-гидроксифенилацетат, фенилацетилглутамин), избыточное количество которых отрицательно сказывается на развитии нервной системы. При другом известном наследственном заболевании — алкаптонурии — нарушено превращение гомогентизата в 4-малеилацетоацетат.
Известно также несколько относительно редких заболеваний (тирозинемий), вызванных нарушениями обмена тирозина. Терапия этих заболеваний, как и фенилкетонурии, — диетическое ограничение белка.
Медицинское применение
[править | править код]Тирозин является предшественником нейротрансмиттеров и повышает уровни нейротрансмиттеров в плазме крови (особенно дофамина и норадреналина)[9], но практически не влияет на настроение у нормальных людей[10][11][12]. Ряд исследований показал, что тирозин полезен при стрессе, простуде, усталости, снижении веса из-за стресса — у мышей[13]; снижении уровня гормонов стресса[14] — у крыс; длительной работе и лишении сна[15][16] — у людей, улучшая их когнитивную и физическую работоспособность[11][17][18].
Тирозин, по-видимому, не оказывает какого-либо существенного влияния на когнитивную или физическую работоспособность в обычных обстоятельствах[19], но помогает лучше поддерживать рабочую память во время многозадачности[20].
Роль в питании
[править | править код]| Вид продукта | Содержание, мг/100 г |
|---|---|
| Изолят соевого белка | 3222 |
| Яичный белок сушёный | 3153 |
| Спирулина сушёная | 2584 |
| Арахисовая мука обезжиренная | 2122 |
| Треска атлантическая вяленая и солёная | 2121 |
| Кунжутная мука нежирная | 2100 |
| Сыр пармезан твёрдый | 1995 |
| Яйцо целое сушёное | 1981 |
| Соевая мука обезжиренная | 1778 |
| Молоко сухое обезжиренное | 1746 |
| Тофу вялено-замороженный (коядофу) | 1604 |
L-тирозин является заменимой аминокислотой. Содержание в некоторых продуктах питания приведено в таблице[21][22].
Применение
[править | править код]Тирозин подавляет аппетит, способствует уменьшению отложения жиров, способствует выработке меланина и улучшает функции надпочечников, щитовидной железы и гипофиза.[источник не указан 5185 дней]
См. также
[править | править код]Примечания
[править | править код]- ↑ "Tyrosine". The Columbia Electronic Encyclopedia, 6th ed. Infoplease.com — Columbia University Press. 2007. Архивировано 8 октября 2012. Дата обращения: 20 апреля 2008.
- ↑ Harper D. Tyrosine. Online Etymology Dictionary (2001). Дата обращения: 20 апреля 2008. Архивировано 8 ноября 2016 года.
- ↑ Adam J. Hoffhines, Eugen Damoc, Kristie G. Bridges, Julie A. Leary, Kevin L. Moore. Detection and purification of tyrosine-sulfated proteins using a novel anti-sulfotyrosine monoclonal antibody // The Journal of Biological Chemistry. — 2006-12-08. — Т. 281, вып. 49. — С. 37877–37887. — ISSN 0021-9258. — doi:10.1074/jbc.M609398200. Архивировано 22 сентября 2022 года.
- ↑ Yogita Kanan, Robert A. Hamilton, David M. Sherry, Muayyad R. Al-Ubaidi. Focus on molecules: sulfotyrosine // Experimental Eye Research. — 2012-12. — Т. 105. — С. 85–86. — ISSN 1096-0007. — doi:10.1016/j.exer.2012.02.014. Архивировано 21 сентября 2022 года.
- ↑ A. R. Battersby, R. Binks, B. J. T. Harper. 692. Alkaloid biosynthesis. Part II. The biosynthesis of morphine (англ.) // Journal of the Chemical Society (Resumed). — 1962. — P. 3534. — ISSN 0368-1769. — doi:10.1039/jr9620003534.
- ↑ Molnár GA, Wagner Z, Markó L, Kó Szegi T, Mohás M, Kocsis B, et al. (November 2005). "Urinary ortho-tyrosine excretion in diabetes mellitus and renal failure: evidence for hydroxyl radical production". Kidney International. 68 (5): 2281—7. doi:10.1111/j.1523-1755.2005.00687.x. PMID 16221230.
- ↑ Molnár GA, Nemes V, Biró Z, Ludány A, Wagner Z, Wittmann I (December 2005). "Accumulation of the hydroxyl free radical markers meta-, ortho-tyrosine and DOPA in cataractous lenses is accompanied by a lower protein and phenylalanine content of the water-soluble phase". Free Radical Research. 39 (12): 1359—66. doi:10.1080/10715760500307107. PMID 16298866. S2CID 31154432.
- ↑ Humphrey CE, Furegati M, Laumen K, La Vecchia L, Leutert T, Müller-Hartwieg JC, Vögtle M (2007). "Optimized Synthesis of L-m-Tyrosine Suitable for Chemical Scale-Up". Organic Process Research & Development. 11 (6): 1069—1075. doi:10.1021/op700093y.
- ↑ Rasmussen DD, Ishizuka B, Quigley ME, Yen SS (October 1983). "Effects of tyrosine and tryptophan ingestion on plasma catecholamine and 3,4-dihydroxyphenylacetic acid concentrations". The Journal of Clinical Endocrinology and Metabolism. 57 (4): 760—3. doi:10.1210/jcem-57-4-760. PMID 6885965.
- ↑ Leathwood PD, Pollet P (1982). "Diet-induced mood changes in normal populations". Journal of Psychiatric Research. 17 (2): 147—54. doi:10.1016/0022-3956(82)90016-4. PMID 6764931.
- ↑ 1 2 Deijen JB, Orlebeke JF (1994). "Effect of tyrosine on cognitive function and blood pressure under stress". Brain Research Bulletin. 33 (3): 319—23. doi:10.1016/0361-9230(94)90200-3. PMID 8293316. S2CID 33823121.
- ↑ Lieberman HR, Corkin S, Spring BJ, Wurtman RJ, Growdon JH (August 1985). "The effects of dietary neurotransmitter precursors on human behavior". The American Journal of Clinical Nutrition. 42 (2): 366—70. doi:10.1093/ajcn/42.2.366. PMID 4025206.
- ↑ Hao S, Avraham Y, Bonne O, Berry EM (February 2001). "Separation-induced body weight loss, impairment in alternation behavior, and autonomic tone: effects of tyrosine". Pharmacology, Biochemistry, and Behavior. 68 (2): 273—81. doi:10.1016/S0091-3057(00)00448-2. PMID 11267632. S2CID 46405659.
- ↑ Reinstein DK, Lehnert H, Wurtman RJ (December 1985). "Dietary tyrosine suppresses the rise in plasma corticosterone following acute stress in rats". Life Sciences. 37 (23): 2157—63. doi:10.1016/0024-3205(85)90566-1. PMID 4068899.
- ↑ Magill RA, Waters WF, Bray GA, Volaufova J, Smith SR, Lieberman HR, et al. (August 2003). "Effects of tyrosine, phentermine, caffeine D-amphetamine, and placebo on cognitive and motor performance deficits during sleep deprivation". Nutritional Neuroscience. 6 (4): 237—46. doi:10.1080/1028415031000120552. PMID 12887140. S2CID 21300076.
- ↑ Neri DF, Wiegmann D, Stanny RR, Shappell SA, McCardie A, McKay DL (April 1995). "The effects of tyrosine on cognitive performance during extended wakefulness". Aviation, Space, and Environmental Medicine. 66 (4): 313—9. PMID 7794222.
- ↑ Deijen JB, Wientjes CJ, Vullinghs HF, Cloin PA, Langefeld JJ (January 1999). "Tyrosine improves cognitive performance and reduces blood pressure in cadets after one week of a combat training course". Brain Research Bulletin. 48 (2): 203—9. doi:10.1016/S0361-9230(98)00163-4. PMID 10230711. S2CID 27927524.
- ↑ Mahoney CR, Castellani J, Kramer FM, Young A, Lieberman HR (November 2007). "Tyrosine supplementation mitigates working memory decrements during cold exposure". Physiology & Behavior. 92 (4): 575—82. doi:10.1016/j.physbeh.2007.05.003. PMID 17585971. S2CID 207372821. Архивировано 20 сентября 2022. Дата обращения: 20 сентября 2022.
- ↑ Strüder HK, Hollmann W, Platen P, Donike M, Gotzmann A, Weber K (April 1998). "Influence of paroxetine, branched-chain amino acids and tyrosine on neuroendocrine system responses and fatigue in humans". Hormone and Metabolic Research. 30 (4): 188—94. doi:10.1055/s-2007-978864. PMID 9623632.
- ↑ Thomas JR, Lockwood PA, Singh A, Deuster PA (November 1999). "Tyrosine improves working memory in a multitasking environment". Pharmacology, Biochemistry, and Behavior. 64 (3): 495—500. doi:10.1016/S0091-3057(99)00094-5. PMID 10548261. S2CID 24717770.
- ↑ Tyrosine Rich Foods (амер. англ.). Medindia. Дата обращения: 13 апреля 2023. Архивировано 13 апреля 2023 года.
- ↑ SR28 — Page Reports : USDA ARS. www.ars.usda.gov. Дата обращения: 13 апреля 2023. Архивировано 13 апреля 2023 года.
Литература
[править | править код]- Тирозин : [арх. 10 августа 2022] // Большая российская энциклопедия : [в 35 т.] / гл. ред. Ю. С. Осипов. — М. : Большая российская энциклопедия, 2004—2017.
- Шапошников А. М. Тирозин // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б. В. Петровский. — 3-е изд. — М. : Советская энциклопедия, 1985. — Т. 25 : Тениус — Углекислота. — 544 с. : ил.
- Report of Medical Research Council on the Dietary Management of PKU. Recommendations on the Dietary Management of PKU. Arch. Dis. Child. 1993: 68; 426-7.
- Dixon M., MacDonald A, White F. Disorders of Amino Acid Metabolism, Organic Acidemias and Urea Cycle Defects PKU in Lawson M, Shaw V (eds.). Clinical Paediatric Dietetics. Oxford:Blackwell Science, 2001,p233-294.
- Holme E, Linstedt S. Tyrosinemia Type I adn NTBC (2-(2-nitro-4-triflourom othylbenoyl)-1,3-cyclohexanedione). J. Inherit. Metab. Dis. 1998:21;507-517.
- Ellaway CJ., Holme E, Standing S. et al. Outcome of Tyrosinemia Type III. J. Inherit. Metab. Dis 2001:24;824-32.

