Трифосфат натрия: различия между версиями
| [непроверенная версия] | [непроверенная версия] |
QBA-bot (обсуждение | вклад) м Защитил страницу Трифосфат натрия: повторяющиеся неконсенсусные правки ([Редактирование=только автоподтверждённые] (истекает 21:34, 28 августа 2024 (UTC)) [Переименование=только автоподтверждённые] (истекает 21:34, 28 августа 2024 (UTC))) |
раздел Применение |
||
| Строка 69: | Строка 69: | ||
}} |
}} |
||
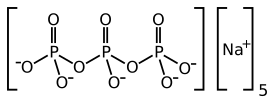
'''Трифосфат натрия''' — соль триполифосфорной кислоты Na<sub>5</sub>Р<sub>3</sub>О<sub>10</sub>. Является [[пищевой стабилизатор|пищевым стабилизатором]], более известным как Е451. |
'''Трифосфат натрия''' — соль триполифосфорной кислоты Na<sub>5</sub>Р<sub>3</sub>О<sub>10</sub>. |
||
== Применение == |
|||
Является [[пищевой стабилизатор|пищевым стабилизатором]], более известным как Е451. |
|||
Фосфаты ослабляют электростатическое взаимодействие внутри актомиозинового комплекса. Только фосфаты могут расщеплять актин и миозин, и это является главной причиной распространения фосфатов. |
Фосфаты ослабляют электростатическое взаимодействие внутри актомиозинового комплекса. Только фосфаты могут расщеплять актин и миозин, и это является главной причиной распространения фосфатов. |
||
Версия от 20:06, 31 августа 2024
| Трифосфат натрия | |
|---|---|
 | |
| Общие | |
| Хим. формула | Na5Р3О10 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 367.864 г/моль |
| Плотность | 2.52 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 622 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 14.5 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7758-29-4 |
| PubChem | 24455 |
| Рег. номер EINECS | 231-838-7 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E451 |
| RTECS | YK4570000 |
| ChemSpider | 22863 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Трифосфат натрия — соль триполифосфорной кислоты Na5Р3О10.
Применение
Является пищевым стабилизатором, более известным как Е451.
Фосфаты ослабляют электростатическое взаимодействие внутри актомиозинового комплекса. Только фосфаты могут расщеплять актин и миозин, и это является главной причиной распространения фосфатов.
Практически все пищевые фосфаты и их смеси, которые используются мясоперерабатывающей и рыбной промышленностью, имеют щелочную реакцию. Добавка щелочных фосфатов в мясо и рыбу приводит к росту pH, и, как следствие, к увеличению влагосвязывающего свойства белков.
Пирофосфаты (E450) и триполифосфат (E451) лучше всего способствуют эмульгированию жира, что объясняет включение этого вещества в состав многих стиральных порошков и средств для посудомоечных машин.
Потребление фосфатов выше разрешённых норм может негативно сказаться на здоровье человека, из-за чего происходит ухудшение усвоения кальция, что приводит к отложению в почках кальция и фосфора и способствует развитию остеопороза.
Синтез
Трифосфат натрия синтезируется путём конденсации из ортофосфорной кислоты:
В лабораторных условиях он синтезируется из фосфата натрия и дифосфата натрия:
Также возможен синтез из триметафосфата натрия:[1]
Примечания
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 547-8.
Литература
- Химический энциклопедический словарь / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1983. — 792 с.
Ссылки
Это заготовка статьи по химии. Помогите Википедии, дополнив её. |




