Оксид рутения(VIII)
Перейти к навигации
Перейти к поиску
| Оксид рутения(VIII) | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Оксид рутения(VIII) |
| Традиционные названия | Тетраоксид рутения |
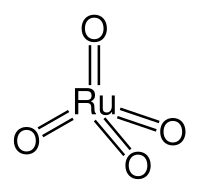
| Хим. формула | RuO4 |
| Рац. формула | RuO4 |
| Физические свойства | |
| Состояние | жёлто-оранжевые кристаллы |
| Молярная масса | 165,07 г/моль |
| Плотность | 3,29 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 25,4; 25,5; 27 °C |
| • кипения | разл.[источник не указан 2570 дней] ≈100 °C |
| Энтальпия | |
| • образования | -305,2 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 1,710; 2,0320; 2,2574 г/100 мл |
| Классификация | |
| Рег. номер CAS | 20427-56-9 |
| PubChem | 119079 |
| Рег. номер EINECS | 243-813-8 |
| SMILES | |
| InChI | |
| ChemSpider | 106401 |
| Безопасность | |
| Предельная концентрация | 0,2 мг/м³ |
| ЛД50 | 14,1 мг/кг |
| Токсичность | Чрезвычайно ядовит |
| Пиктограммы СГС |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид рутения(VIII) — неорганическое соединение, оксид металла рутения с формулой RuO4, жёлто-оранжевые кристаллы, умеренно растворимые в воде, образует гидраты.
Получение
[править | править код]- Окисление кислородом воздуха рутения при нагревании:
- Окисление рутения броматом калия:
- Разложение оксида рутения(IV) при нагревании:
- Окисление оксида рутения(IV) кислородом:
- Окисление тетраоксорутената(VI) калия хлором:
Физические свойства
[править | править код]Оксид рутения(VIII) образует жёлто-оранжевые кристаллы.
Тетраоксид рутения — летучее соединение и легко возгоняется[1].
При нагревании выше 100°С разлагается со взрывом.[источник не указан 2570 дней]
Сильный окислитель, пахнет озоном, со спиртом реагирует со взрывом.
Умерено растворяется в воде, водные растворы являются слабой кислотой p K1 = 11,0.
Химические свойства
[править | править код]- Разлагается при нагревании:
- Является сильным окислителем. Реагирует с разбавленным раствором соляной кислоты:
- Взаимодействует с щелочами:
Примечания
[править | править код]- ↑ Откуда мог взяться рутений-106 Архивная копия от 2 декабря 2017 на Wayback Machine, статья от 24.11.2017 г. с интервью заведующего Лабораторией Института ядерных исследований РАН Б. Жуйкова. Газета «Троицкий вариант — Наука». Н. Демина.
Физиологическое действие
[править | править код]Тетраоксид рутения очень ядовит, летуч, сильный окислитель, поэтому он должен храниться в запаянных ампулах.
Литература
[править | править код]- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-82270-092-4.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
- Неорганическая химия / под ред. Ю.Д. Третьякова. — М.: Академия, 2007. — Т. 3. — 400 с.







![{\displaystyle {\mathsf {RuO_{4}+10HCl\ \xrightarrow {} \ H_{2}[RuCl_{6}]+2Cl_{2}\uparrow +4H_{2}O}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/80e216134af91f9dc3d7aebf64760310536ab7fa)



