Трастузумаб эмтанзин
| Трастузумаб эмтанзин | |
|---|---|
| trastuzumab emtansine | |
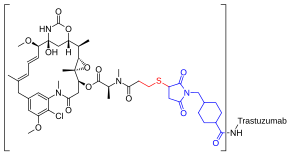 | |
| Химическое соединение | |
| Молярная масса | 973,5557 |
| CAS | 1018448-65-1 |
| DrugBank | DB05773 |
| Состав | |
| Классификация | |
| АТХ | L01XC14 |
| Другие названия | |
| Kadcyla, Trastuzumab emtansine, Ado-trastuzumab emtansine, T-DM1, TDM1, Trastuzumab-MCC-DM1, Trastuzumab-DM1, Immunoglobulin G1 | |
Трастузумаб эмтанзин — лекарственное средство для лечения рака молочной железы. В 2013 году одобрен для применения в России, Европейском союзе и США[1]. Препарат выпускается компанией Рош под торговой маркой «Кадсила»[2][3].
В молекуле трастузумаб эмтанзина объединены трастузумаб, действующий против HER-2-чувствительных опухолей, и эмтанзин[англ.] (одна из форм мертанзина, DM1), который препятствует митозу и способствует апоптозу клеток опухоли[1].
Общее описание
[править | править код]Трастузумаб эмтанзин разработан швейцарской фармацевтической компанией Рош (англ. Roche) для лечения неоперабельного HER2-позитивного местно-распространённого или метастатического рака молочной железы[3]. В 2013 году Комитет Европейского Союза по лекарственным препаратам для человека рекомендовал препарат для использования в ЕС. Это решение было принято по результатам клинических испытаний III фазы «EMILIA»[3]. Уже первичные результаты исследования показали, что трастузумаб эмтанзин по сравнению со стандартной на 2012 год химиотерапией (Лапатиниб и Капецитабин) показал лучшие результаты в продолжительности и улучшении качества жизни пациенток[3][4]. Это дорогое лекарство, стоимость курса лечения составляет приблизительно 91 000 £ (≈$153 000 US). Национальный институт здоровья и качества медицинской помощи Великобритании[англ.] (англ. NICE) в 2014 году отказался от государственного финансирования закупок препарата «Кадсила» из-за его высокой цены[2].
Препарат представляет собой конъюгат анти-HER2 моноклонального антитела (трастузумаб) и ингибитора полимеризации тубулина (DM1 в форме эмтанзина[англ.])[1]
Фармакологические свойства
[править | править код]Фармакокинетика
[править | править код]Этот раздел статьи ещё не написан. |
Механизм действия
[править | править код]Моноклональное антитело G1 (трастузумаб) действует против HER-2-позитивных клеток опухоли и доставляет в них ингибитор полимеризации тубулина эмтанзин[англ.], являющийся одной из форм DM1 (другая его форма — мертанзин[англ.])[1][3]. Эти компоненты связаны между собой стабильным линкером, что обеспечивает адресную доставку цитотоксичного эмтанзина в клетки опухоли[3]. Эмтанзин препятствует митозу клеток опухоли и стимулирует их апоптоз[1].
Применение
[править | править код]Трастузумаб эмтанзин с 2013 года применяется в качестве таргетной терапии метастатического HER2-положительного рака молочной железы[5][6]. С 2019 года FDA одобрила этот препарат для адъювантной терапии[англ.] при ранних стадиях HER2-положительного рака молочной железы[3][6]. Он может назначаться в качестве монотерапии взрослым пациентам, если они ранее получали трастузумаб и таксаны[3].
Способ применения — внутривенная инфузия.
Побочные действия
[править | править код]Трастузумаб эмтанзин — токсичный препарат. Его применение сопровождается повреждениями сердца, печени, плода у беременных. Среди побочных эффектов встречается также усталость, тошнота, мышечные боли, запор, тромбоцитопения, повышение уровня печеночных ферментов в крови[5].
Противопоказания
[править | править код]Этот раздел статьи ещё не написан. |
Беременность
[править | править код]Женщины детородного возраста во время лечения и 7 месяцев после него должны использовать контрацепцию.
Примечания
[править | править код]- ↑ 1 2 3 4 5 Ballantyne A. Trastuzumab emtansine : first global approval : [англ.] / Anita Ballantyne, Sohita Dhillon // Drugs : j. — 2013. — Vol. 73, no. 7. — P. 755–765. — doi:10.1007/s40265-013-0050-2. — PMID 23620199.
- ↑ 1 2 Жулина, Ксения. Эксперты NICE считают, что стоимость препарата Кадсила (трастузумаб эмтанзин) компании Roche необоснованно высокая : [арх. 31 августа 2019] // Больничная аптека. — 2014. — 28 апреля.
- ↑ 1 2 3 4 5 6 7 8 Препарат Кадсила для лечения рака молочной железы рекомендован к одобрению в Европе : [арх. 16 июля 2020] // Больничная аптека.
- ↑ Verma, Sunil. Trastuzumab Emtansine for HER2-Positive Advanced Breast Cancer : [англ.] / Sunil Verma, David Miles, Luca Gianni … [et al.] // New England journal of medicine. — 2012. — Vol. 367. — P. 1783–1791. — doi:10.1056/nejmoa1209124. — PMID 23020162. — PMC 5125250.
- ↑ 1 2 KADCYLA — ado-trastuzumab emtansine injection, powder, lyophilized, for solution (англ.). DailyMed. U. S. National Library of Medicine (26 ноября 2019).
- ↑ 1 2 New Populations // New Drug Therapy Approvals 2019 : Advancing Health Through Innovation : [англ.] : [арх. 19 августа 2020] / Center for Drug Evaluation and Research’s (CDER). — FDA, 2020. — January. — P. 30. — 44 p.
Литература
[править | править код]- A Study of Trastuzumab Emtansine Versus Capecitabine + Lapatinib in Participants With HER2-positive Locally Advanced or Metastatic Breast Cancer (EMILIA) : NCT00829166 // ClinicalTrials.gov. — U. S. National Library of Medicine, 2016. — 31 октября.