Хлорофилл
| Хлорофилл | |
|---|---|
  | |
| Общие | |
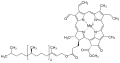
| Хим. формула | C55H72MgN4O5 |
| Классификация | |
| Рег. номер CAS | 1406-65-1 |
| Рег. номер EINECS | 215-800-7 |
| SMILES | |
| Кодекс Алиментариус | E140 |
| ChEBI | 28966 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлорофи́лл (от греч. χλωρός, «зелёный» и φύλλον, «лист») — зелёный пигмент, окрашивающий хлоропласты растений в зелёный цвет. При его участии происходит фотосинтез. По химическому строению хлорофиллы — магниевые комплексы различных тетрапирролов. Хлорофиллы имеют порфириновое строение и близки гему. Хлорофилл зарегистрирован в качестве пищевой добавки Е140.
История открытия
[править | править код]В 1817 году Жозеф Бьенеме Каванту и Пьер Жозеф Пеллетье выделили из листьев растений зелёный пигмент, который они назвали хлорофиллом[1]. В 1900-х годах Михаил Цвет[2] и Рихард Вильштеттер независимо друг от друга обнаружили, что хлорофилл состоит из нескольких компонентов. Вильтштеттер очистил и кристаллизовал два компонента хлорофилла, названные им хлорофиллами а и b и установил брутто-формулу хлорофилла а. В 1915 году за исследования хлорофилла ему была вручена Нобелевская премия. В 1940 Ханс Фишер, получивший в 1930 Нобелевскую премию за открытие структуры гема, установил химическую структуру хлорофилла a. Его синтез был впервые осуществлён в 1960 Робертом Вудвордом[3], а в 1967 была окончательно установлена его стереохимическая структура[4].
В природе
[править | править код]

Хлорофилл присутствует во всех фотосинтезирующих организмах — высших растениях, водорослях, синезелёных водорослях (цианобактериях), фотоавтотрофных простейших (протистах) и бактериях.
Некоторые растения, в том числе ряд высших растений, утратили хлорофилл (как, например, петров крест).
Синтез
[править | править код]Синтезирован Робертом Вудвордом в 1960 году.
Синтез включает в себя 15 реакций, которые можно разделить на 3 этапа. Исходными веществами для синтеза хлорофилла являются глицин и ацетат. На первом этапе образуется аминолевулиновая кислота. На втором этапе происходит синтез одной молекулы протопорфирина из четырёх пиррольных колец. Третий этап представляет собой образование и превращение магнийпорфиринов.
Свойства и функция при фотосинтезе
[править | править код]В процессе фотосинтеза молекула хлорофилла претерпевает изменения, поглощая световую энергию, которая затем используется в фотохимической реакции взаимодействия углекислого газа и воды с образованием органических веществ (как правило, углеводов):
После передачи поглощённой энергии молекула хлорофилла возвращается в исходное состояние.
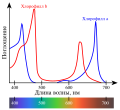
Хотя максимум непрерывного спектра солнечного излучения расположен в «зелёной» области 550 нм (где находится и максимум чувствительности глаза), поглощается хлорофиллом преимущественно синий, частично — красный свет из солнечного спектра (чем и обуславливается зелёный цвет отражённого света).
Растения могут использовать и свет с теми длинами волн, которые слабо поглощаются хлорофиллом. Энергию фотонов при этом улавливают другие фотосинтетические пигменты, которые затем передают энергию хлорофиллу. Этим объясняется разнообразие окраски растений (и других фотосинтезирующих организмов) и её зависимость от спектрального состава падающего света.
Химическая структура
[править | править код]Хлорофиллы можно рассматривать как производные протопорфирина — порфирина с двумя карбоксильными заместителями (свободными или этерифицированными). Так, хлорофилл a имеет карбоксиметиловую группу при С10, фитоловый эфир пропионовой кислоты — при С7. Удаление магния, легко достигаемое мягкой кислотной обработкой, даёт продукт, известный как феофитин. Гидролиз фитоловой эфирной связи хлорофилла приводит к образованию хлорофиллида (хлорофиллид, лишённый атома металла, известен как феофорбид a).
Все эти соединения интенсивно окрашены и сильно флуоресцируют, исключая те случаи, когда они растворены в органических растворителях в строго безводных условиях. Они имеют характерные спектры поглощения, пригодные для качественного и количественного определения состава пигментов. Для этой же цели часто используются также данные о растворимости этих соединений в соляной кислоте, в частности для определения наличия или отсутствия этерифицированных спиртов. Хлороводородное число определяется как концентрация HCl (%, масс./об.), при которой из равного объёма эфирного раствора пигмента экстрагируется 2/3 общего количества пигмента. «Фазовый тест» — окрашивание зоны раздела фаз — проводят, подслаивая под эфирный раствор хлорофилла равный объём 30%-го раствора гидроксида калия в метаноле. В интерфазе должно образовываться окрашенное кольцо. С помощью тонкослойной хроматографии можно быстро определять хлорофиллы в сырых экстрактах.
Хлорофиллы неустойчивы на свету; они могут окисляться до алломерных хлорофиллов на воздухе в метанольном или этанольном растворе.
Хлорофиллы образуют комплексы с белками in vivo и могут быть выделены в таком виде. В составе комплексов их спектры поглощения значительно отличаются от спектров свободных хлорофиллов в органических растворителях.
Хлорофиллы можно получить в виде кристаллов. Добавление H2O или Ca2+ к органическому растворителю способствует кристаллизации.
| Хлорофилл a | Хлорофилл b | Хлорофилл c1 | Хлорофилл c2 | Хлорофилл d | Хлорофилл f | |
|---|---|---|---|---|---|---|
| Формула | C55H72O5N4Mg | C55H70O6N4Mg | C35H30O5N4Mg | C35H28O5N4Mg | C54H70O6N4Mg | C55H70O6N4Mg |
| группа C2 | -CH3 | -CH3 | -CH3 | -CH3 | -CH3 | -CHO |
| группа C3 | -CH=CH2 | -CH=CH2 | -CH=CH2 | -CH=CH2 | -CHO | -CH=CH2 |
| группа C7 | -CH3 | -CHO | -CH3 | -CH3 | -CH3 | -CH3 |
| группа C8 | -CH2CH3 | -CH2CH3 | -CH2CH3 | -CH=CH2 | -CH2CH3 | -CH2CH3 |
| группа C17 | -CH2CH2COO-Phytyl | -CH2CH2COO-Phytyl | -CH=CHCOOH | -CH=CHCOOH | -CH2CH2COO-Phytyl | -CH2CH2COO-Phytyl |
| связь C17-C18 | Одинарная | Одинарная | Двойная | Двойная | Одинарная | Одинарная |
| Распространение | Везде | Большинство наземных растений | Некоторые водоросли | Некоторые водоросли | Цианобактерии | Цианобактерии |
-
Общая структура хлорофилла a, b и d
-
Структура хлорофилла c1, c2
-
Структура хлорофилла f
-
Оптический спектр поглощения хлорофиллов a (голубой) и b (красный)
-
Хроматограмма зелёного пигмента растений
Применение
[править | править код]Хлорофилл находит применение в пищевой промышленности как пищевая добавка (регистрационный номер в европейском реестре E140), однако при хранении в этанольном растворе, особенно в кислой среде, неустойчив, приобретает грязно-коричнево-зеленый оттенок, и не может использоваться как натуральный краситель. Нерастворимость нативного хлорофилла в воде также ограничивает его применение в качестве натурального пищевого красителя. Но хлорофилл вполне успешно используется в качестве натуральной замены синтетических красителей при изготовлении кондитерских изделий[источник не указан 4652 дня].
Производное хлорофилла — хлофиллин медный комплекс (тринатриевая соль) получил распространение в качестве пищевого красителя (Регистрационный номер в европейском реестре E141). В отличие от нативного хлорофилла, медный комплекс устойчив в кислой среде, сохраняет изумрудно-зелёный цвет при длительном хранении и растворим в воде и водно-спиртовых растворах. Американская (USP) и Европейская (EP) фармакопеи относят хлорофиллид меди к пищевым красителям, однако вводят лимит на концентрацию свободной и связанной меди (тяжёлый металл).
-
Хлорофилл придаёт листьям зелёный цвет и поглощает свет при фотосинтезе
-
В клетках эукариотов хлорофилл обычно находится в хлоропластах
-
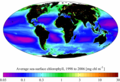
Карта распределения хлорофилла по поверхности мирового океана в период с 1998 по 2006 по данным спутникового прибора SeaWiFS
Безопасность
[править | править код]Объединённый экспертный комитет ФАО/ВОЗ по пищевым добавкам (JECFA) в 1969, 1975 и 1985 годах исследовал токсичность хлорофилла для его использования в качестве пищевой добавки[5]. По итогам проведённых исследований, не удалось установить допустимое суточное потребление (ДСП), поскольку вещество не проявляло негативные эффекты даже в высоких дозировках[5]. В 2015 году Европейское агентство по безопасности продуктов питания (EFSA) провело переоценку хлорофилла и пришло к выводу, что нет никаких оснований полагать, что хлорофилл представляет какую-либо опасность[6].
Примечания
[править | править код]- ↑ Pelletier and Caventou (1817) «Notice sur la matière verte des feuilles» («Замечания о зелёном материале листьев»), Journal de Pharmacie, 3 : 486—491.
- ↑ M. Tswett (1906) Physikalisch-chemische Studien über das Chlorophyll. Die Adsorptionen. (Физико-химические исследования хлорофилла. Адсорбция.) Ber. Dtsch. Botan. Ges. 24, 316—323 .
- ↑ R. B. Woodward, W. A. Ayer, J. M. Beaton, F. Bickelhaupt, R. Bonnett. THE TOTAL SYNTHESIS OF CHLOROPHYLL (англ.) // Journal of the American Chemical Society. — 1960. — Vol. 82, iss. 14. — P. 3800–3802. — doi:10.1021/ja01499a093.
- ↑ Ian Fleming. Absolute Configuration and the Structure of Chlorophyll (англ.) // Nature. — 1967-10-14. — Vol. 216, iss. 5111. — P. 151–152. — doi:10.1038/216151a0.
- ↑ 1 2 World Health Organization. CHLOROPHYLLS // Joint FAO/WHO Expert Committee on Food Additives. Архивировано 28 декабря 2022 года.
- ↑ Scientific Opinion on the re-evaluation of chlorophylls (E 140(i)) as food additives (англ.). European Food Safety Authority (7 мая 2015). Дата обращения: 13 октября 2022. Архивировано 13 октября 2022 года.
Ссылки
[править | править код]- Монтеверде Н. А., Любименко В. Н. Исследования над образованием хлорофилла у растений // Известия Императорской Академии наук. VII серия. — СПб., 1913. — Т. VII, № 17. — С. 1007–1028.
- Speer, Brian R. (1997). «Photosynthetic Pigments» на сайте UCMP Glossary (online). University of California, Berkeley Museum of Paleontology. Verified availability August 4, 2005. (англ.)
- Chlorophyll d: the puzzle resolved (англ.)
- Билич Г. Л., Крыжановский В. А. Биология. Полный курс: В 4 т. — издание 5-е, дополненное и переработанное. — М.: Издательство Оникс, 2009. — Т. 1. — 864 с. — ISBN 978-5-488-02311-6
![{\displaystyle {\ce {xCO2 + xH2O ->[{\ce {h\nu}}] (CH2O)_x + xO2}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/10f19e188b6704ab2bec042304945d74393d9cd9)