鈉鉀泵:修订间差异
补救4个来源,并将0个来源标记为失效。) #IABot (v2.0.7 |
→機制: 修正笔误 |
||
| (未显示6个用户的6个中间版本) | |||
| 第1行: | 第1行: | ||
{{Link style|time=2015-12-12T06:12:53+00:00}} |
|||
{{noteTA |
{{noteTA |
||
|G1=生命科学 |
|G1=生命科学 |
||
}} |
}} |
||
[[File:Sodium Pump.svg|thumb|250px| |
[[File:Sodium Pump.svg|thumb|250px|跨膜钠泵的简化图]] |
||
[[File:3b8e.png|thumb|200px|鈉鉀泵 |
[[File:3b8e.png|thumb|200px|鈉鉀泵[[分子]]結構的飘带模型图]] |
||
[[File:Scheme sodium-potassium pump-zh (zh-tw).svg|thumb|300px|钠钾泵是一种[[原发性主动转运]]的例子]] |
|||
'''鈉鉀泵'''(也可稱為鈉鉀-ATPase, Na<sup>+</sup>/K<sup>+</sup>-ATPase),是一種位於[[細胞膜]]上的[[酶]](EC 3.6.3.9)(或說得更精確一點,離子匣式跨膜[[ATP酶]])可在人類細胞及[[後生動物]]中發現。 |
|||
'''鈉鉀泵'''(sodium–potassium pump)又称'''钠钾ATP酶'''(Na<sup>+</sup>/K<sup>+</sup>-ATPase)、'''鈉鉀ATP酶泵'''(sodium-potassium ATPase pump), 是一種位於[[細胞膜]]上,利用ATP水解把钠离子泵出,而把钾离子泵入细胞的一种[[酶]](EC 3.6.3.9);精确说,是一种“離子匣式跨膜[[ATP酶]]”。鈉鉀泵可在人類細胞及[[後生動物]]中發現,是维持细胞膜电位的重要酶。 |
|||
{{FileTA|Scheme sodium-potassium pump-zh|svg|thumb|300px}} |
|||
鈉鉀泵可以將細胞外相對細胞内較低濃度的[[鉀離子]]送進細胞,並將細胞内相對細胞外較低濃度的[[鈉離子]]送出細胞。經由以具[[放射性]]的鈉、鉀離子標定,可以發現鈉、鉀離子都會經過這個通道,鈉、鉀離子的濃度在細胞膜兩側也都是相互依賴的,所以顯示了鈉、鉀離子都可以經過這個載體運輸。目前已知鈉鉀泵需消耗ATP,並可以將三個鈉離子送出細胞,同時將兩個鉀離子送進細胞。 |
鈉鉀泵可以將細胞外相對細胞内較低濃度的[[鉀離子]]送進細胞,並將細胞内相對細胞外較低濃度的[[鈉離子]]送出細胞。經由以具[[放射性]]的鈉、鉀離子標定,可以發現鈉、鉀離子都會經過這個通道,鈉、鉀離子的濃度在細胞膜兩側也都是相互依賴的,所以顯示了鈉、鉀離子都可以經過這個載體運輸。目前已知鈉鉀泵需消耗ATP,並可以將三個鈉離子送出細胞,同時將兩個鉀離子送進細胞。 |
||
:: <chem>3Na+(in) + 2K+(out) + ATP + H2O -> 3Na+(out) + 2K+(in) + ADP + Pi</chem> |
|||
鈉鉀泵在1950年被[[丹麥]]的科學家[[延斯·克里斯蒂安·斯科|延斯·斯科]](Jens Skou)發現,它代表了人類對離子進出細胞的認識的一個重要的里程碑。它也在細胞刺激上有著重要的意義,像[[神經細胞]]的衝動,就是用鈉鉀泵幫助維持細胞電位使神經衝動得以傳輸。 |
鈉鉀泵在1950年被[[丹麥]]的科學家[[延斯·克里斯蒂安·斯科|延斯·斯科]](Jens Skou)發現,它代表了人類對離子進出細胞的認識的一個重要的里程碑。它也在細胞刺激上有著重要的意義,像[[神經細胞]]的衝動,就是用鈉鉀泵幫助維持細胞電位使神經衝動得以傳輸。 |
||
| 第24行: | 第26行: | ||
=== 訊息轉換子 === |
=== 訊息轉換子 === |
||
在過去這些年中,許多實驗室證明了這些膜蛋白除了可以做傳統的離子運輸外,亦可藉由調控蛋白質上[[酪胺酸]]的磷酸化來結合細胞間的[[哇吧因]](ouabain)傳遞訊息進入細胞內。藉由哇吧因來觸發蛋白質磷酸化產生的下游訊息包括有絲分裂活化蛋白質激酶(mitogen-activated protein kinase, MAPK)訊息的[[梯瀑效應]](cascade)的活化、粒線體活性氧(reactive oxygen species, ROS)的產生、C型磷脂酶(phospholipase C, PLC)及肌醇三磷酸受體(inositol triphosphate receptor, IP<sub>3</sub>R)的活化。<ref>[http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=15975899 Na/K-ATPase Tethers Phospholipase C and IP3 Receptor into a Calcium-regulatory Complex] {{Wayback|url=http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=15975899 |date=20190701112059 }} by Zhaokan Yuan, Ting Cai, Jiang Tian, Alexander V. Ivanov, David R. Giovannucci, and Zijian Xie in [[Molecular Biology of the Cell]] (2005) volume 16, pages 4034-4045.</ref><br /> |
在過去這些年中,許多實驗室證明了這些膜蛋白除了可以做傳統的離子運輸外,亦可藉由調控蛋白質上[[酪胺酸]]的磷酸化來結合細胞間的[[哇吧因]](ouabain)傳遞訊息進入細胞內。藉由哇吧因來觸發蛋白質磷酸化產生的下游訊息包括有絲分裂活化蛋白質激酶(mitogen-activated protein kinase, MAPK)訊息的[[梯瀑效應]](cascade)的活化、粒線體活性氧(reactive oxygen species, ROS)的產生、C型磷脂酶(phospholipase C, PLC)及肌醇三磷酸受體(inositol triphosphate receptor, IP<sub>3</sub>R)的活化。<ref>[http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=15975899 Na/K-ATPase Tethers Phospholipase C and IP3 Receptor into a Calcium-regulatory Complex] {{Wayback|url=http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=15975899 |date=20190701112059 }} by Zhaokan Yuan, Ting Cai, Jiang Tian, Alexander V. Ivanov, David R. Giovannucci, and Zijian Xie in [[Molecular Biology of the Cell]] (2005) volume 16, pages 4034-4045.</ref><br /> |
||
蛋白質交互作用對鈉鉀幫浦媒介的訊息傳遞是很重要的,如:鈉鉀幫浦與無接收子酪胺酸磷酸酶(Src,一種沒有受體得酪胺酸激酶)結合形成接收子複合物(receptor complex)。<ref>[http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=16267270 Binding of Src to Na+/K+-ATPase Forms a Functional Signaling Complex] {{Wayback|url=http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=16267270 |date=20190701112100 }} by Jiang Tian, Ting Cai, Zhaokan Yuan, Haojie Wang, Lijun Liu, Michael Haas, Elena Maksimova,‡ Xin-Yun Huang and Zi-Jian Xie in [[Molecular Biology of the Cell]] (2005) volume 17, pages 317-326.</ref>鈉鉀幫浦亦會與 |
蛋白質交互作用對鈉鉀幫浦媒介的訊息傳遞是很重要的,如:鈉鉀幫浦與無接收子酪胺酸磷酸酶(Src,一種沒有受體得酪胺酸激酶)結合形成接收子複合物(receptor complex)。<ref>[http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=16267270 Binding of Src to Na+/K+-ATPase Forms a Functional Signaling Complex] {{Wayback|url=http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=16267270 |date=20190701112100 }} by Jiang Tian, Ting Cai, Zhaokan Yuan, Haojie Wang, Lijun Liu, Michael Haas, Elena Maksimova,‡ Xin-Yun Huang and Zi-Jian Xie in [[Molecular Biology of the Cell]] (2005) volume 17, pages 317-326.</ref>鈉鉀幫浦亦會與[[锚蛋白]]、肌醇三磷酸受體(IP<sub>3</sub>R)、肌醇三磷酸激酶(PI<sub>3</sub>K)、C型磷脂酶γ(PLC-γ)及切絲蛋白(cofilin)結合。<ref>[http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=1221581 Interaction of the alpha subunit of Na,K-ATPase with cofilin] {{Wayback|url=http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=1221581 |date=20190701112100 }} by K. Lee, J. Jung, M. Kim and G. Guidotti in [[Biochemical Journal|The Biochemical Journal]] (2001) volume 353, pages 377–385.</ref> |
||
== 機制 == |
== 機制 == |
||
[[File:NaKpompe-cycle.jpg|thumb|400px]] |
[[File:NaKpompe-cycle.jpg|thumb|400px]] |
||
# 泵接上[[ATP]],並接上3個細胞內的[[鈉離子]]。 |
# 泵接上[[三磷酸腺苷|ATP]],並接上3個細胞內的[[鈉離子]]。 |
||
# 藉由將ATP水解成ADP,使泵上高度保守的天冬胺酸片段 (highly conserved aspartate residue) 被[[磷酸化]] ( |
# 藉由將ATP水解成ADP,使泵上高度保守的天冬胺酸片段 (highly conserved aspartate residue) 被[[磷酸化]] ({{lang|en|phosphorylation}})。 |
||
# 磷酸化的泵構形改變 (conformational change),對鈉離子的親和力 (affinity) 降低,而將[[鈉離子]]釋放至細胞外。 |
# 磷酸化的泵構形改變 (conformational change),對鈉離子的親和力 (affinity) 降低,而將[[鈉離子]]釋放至細胞外。 |
||
# 泵接上2個[[細胞]]外的鉀離子。此舉造成 |
# 泵接上2個[[細胞]]外的鉀離子。此舉造成泵去磷酸化 (dephosphorylation),回復至原先構形,運送鉀離子進入[[細胞]]內。 |
||
# 無磷酸化的 |
# 無磷酸化的泵構形對鈉離子的親和力高於鉀離子,因此2個鉀離子離開泵,[[三磷酸腺苷|ATP]]接上,過程重新開始。 |
||
== 調節 == |
== 調節 == |
||
=== 內生(Endogenous) === |
=== 內生(Endogenous) === |
||
鈉鉀泵被認為可由cAMP來調降。<ref>[http://ajpcell.physiology.org/cgi/content/full/279/5/C1516 Regulation of Na+-K+-ATPase by cAMP-dependent protein kinase anchored on membrane via its anchoring protein] Kinji Kurihara, Nobuo Nakanishi, and Takao Ueha. Departments of 1 Oral Physiology and 2 Biochemistry, School of Dentistry, Meikai University, Sakado, Saitama 350-0283, Japan</ref>若物質造成cAMP濃度上升,則鈉鉀泵濃度下降;反之,若cAMP濃度下降,則納鉀泵濃度上升。 |
鈉鉀泵被認為可由cAMP來調降。<ref>[http://ajpcell.physiology.org/cgi/content/full/279/5/C1516 Regulation of Na+-K+-ATPase by cAMP-dependent protein kinase anchored on membrane via its anchoring protein] {{Wayback|url=http://ajpcell.physiology.org/cgi/content/full/279/5/C1516 |date=20100905093431 }} Kinji Kurihara, Nobuo Nakanishi, and Takao Ueha. Departments of 1 Oral Physiology and 2 Biochemistry, School of Dentistry, Meikai University, Sakado, Saitama 350-0283, Japan</ref>若物質造成cAMP濃度上升,則鈉鉀泵濃度下降;反之,若cAMP濃度下降,則納鉀泵濃度上升。 |
||
=== 外生(Exopenous) === |
=== 外生(Exopenous) === |
||
2023年6月9日 (五) 14:56的最新版本



鈉鉀泵(sodium–potassium pump)又称钠钾ATP酶(Na+/K+-ATPase)、鈉鉀ATP酶泵(sodium-potassium ATPase pump), 是一種位於細胞膜上,利用ATP水解把钠离子泵出,而把钾离子泵入细胞的一种酶(EC 3.6.3.9);精确说,是一种“離子匣式跨膜ATP酶”。鈉鉀泵可在人類細胞及後生動物中發現,是维持细胞膜电位的重要酶。
鈉鉀泵可以將細胞外相對細胞内較低濃度的鉀離子送進細胞,並將細胞内相對細胞外較低濃度的鈉離子送出細胞。經由以具放射性的鈉、鉀離子標定,可以發現鈉、鉀離子都會經過這個通道,鈉、鉀離子的濃度在細胞膜兩側也都是相互依賴的,所以顯示了鈉、鉀離子都可以經過這個載體運輸。目前已知鈉鉀泵需消耗ATP,並可以將三個鈉離子送出細胞,同時將兩個鉀離子送進細胞。
鈉鉀泵在1950年被丹麥的科學家延斯·斯科(Jens Skou)發現,它代表了人類對離子進出細胞的認識的一個重要的里程碑。它也在細胞刺激上有著重要的意義,像神經細胞的衝動,就是用鈉鉀泵幫助維持細胞電位使神經衝動得以傳輸。
功能
[编辑]鈉鉀泵可以幫忙維持細胞保持在靜止電位,幫助傳輸和調整細胞體積。他也有信號感應和整合的功能,和細胞內的鈣離子一樣幫助調整MAPK途徑、ROS。
靜止膜電位
[编辑]為了維持細胞的電位,細胞內必須保持低濃度的鈉離子和高濃度的鉀離子。當細胞再極化時,細胞會打開鉀離子通道而使細胞的內的鉀離子經由鉀離子通道離開細胞,使細胞內的電位越來越低到達靜止電位。但當鉀離子通道太晚關閉時,細胞內的電位就會過低,而形成了過極化的現象。為了回復適當的電位,鈉鉀泵經由水解ATP獲得能量以主動運輸將三個鈉離子送出細胞,同時將兩個鉀離子送進細胞。最後細胞回復到靜止電位而可以準備開始下一個動作電位。但有一點不要弄錯,動作電位的產生跟鈉鉀泵並沒有直接的關係。
控制細胞體積
[编辑]鈉鉀泵的重要功能之一就是維持細胞體積,機制如下所述。在細胞內部有大量無法分泌至細胞外的物質,如蛋白質及胞器等,這些物質造成滲透壓的差距,而使水由細胞外流入細胞內,若無調控則會導致細胞膨脹,甚至破裂。鈉鉀泵可避免此情況。鈉鉀泵將3個鈉離子運出細胞,並運入2個鉀離子。由於鈉離子對膜的穿透性比鉀離子差(鈉的水合半徑(276 pm)比鉀(232 pm)大),因此讓鈉離子傾向留於細胞外,而造成細胞不斷地流失離子,如此一來,產生相反的滲透壓梯度,使水分子滲出細胞外。所以,一旦細胞有開始膨脹的現象,就會自動活化鈉鉀幫浦將離子運出細胞外。
訊息轉換子
[编辑]在過去這些年中,許多實驗室證明了這些膜蛋白除了可以做傳統的離子運輸外,亦可藉由調控蛋白質上酪胺酸的磷酸化來結合細胞間的哇吧因(ouabain)傳遞訊息進入細胞內。藉由哇吧因來觸發蛋白質磷酸化產生的下游訊息包括有絲分裂活化蛋白質激酶(mitogen-activated protein kinase, MAPK)訊息的梯瀑效應(cascade)的活化、粒線體活性氧(reactive oxygen species, ROS)的產生、C型磷脂酶(phospholipase C, PLC)及肌醇三磷酸受體(inositol triphosphate receptor, IP3R)的活化。[1]
蛋白質交互作用對鈉鉀幫浦媒介的訊息傳遞是很重要的,如:鈉鉀幫浦與無接收子酪胺酸磷酸酶(Src,一種沒有受體得酪胺酸激酶)結合形成接收子複合物(receptor complex)。[2]鈉鉀幫浦亦會與锚蛋白、肌醇三磷酸受體(IP3R)、肌醇三磷酸激酶(PI3K)、C型磷脂酶γ(PLC-γ)及切絲蛋白(cofilin)結合。[3]
機制
[编辑]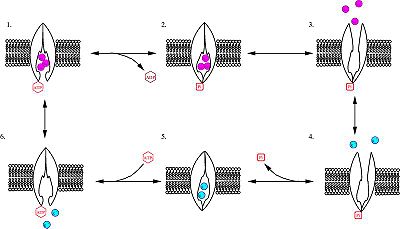
- 泵接上ATP,並接上3個細胞內的鈉離子。
- 藉由將ATP水解成ADP,使泵上高度保守的天冬胺酸片段 (highly conserved aspartate residue) 被磷酸化 (phosphorylation)。
- 磷酸化的泵構形改變 (conformational change),對鈉離子的親和力 (affinity) 降低,而將鈉離子釋放至細胞外。
- 泵接上2個細胞外的鉀離子。此舉造成泵去磷酸化 (dephosphorylation),回復至原先構形,運送鉀離子進入細胞內。
- 無磷酸化的泵構形對鈉離子的親和力高於鉀離子,因此2個鉀離子離開泵,ATP接上,過程重新開始。
調節
[编辑]內生(Endogenous)
[编辑]鈉鉀泵被認為可由cAMP來調降。[4]若物質造成cAMP濃度上升,則鈉鉀泵濃度下降;反之,若cAMP濃度下降,則納鉀泵濃度上升。
外生(Exopenous)
[编辑]鈉鉀泵可被藥物做修飾。例如,心臟細胞膜上的鈉鉀泵是強心甙類(cardiac glycosides)藥物(如地高辛(digoxin)及ouabain)的重要作用目標,藉由增強收縮力來促進心臟表現。
發現
[编辑]丹麥科學家延斯·克里斯蒂安·斯科(Jens Christian Skou)在1957年發現鈉鉀幫浦[5],並在1997年獲得諾貝爾化學獎。"for the first discovery of an ion-transporting enzyme, Na+, K+ -ATPase." [6]
基因
[编辑]參考資料
[编辑]- ^ Na/K-ATPase Tethers Phospholipase C and IP3 Receptor into a Calcium-regulatory Complex (页面存档备份,存于互联网档案馆) by Zhaokan Yuan, Ting Cai, Jiang Tian, Alexander V. Ivanov, David R. Giovannucci, and Zijian Xie in Molecular Biology of the Cell (2005) volume 16, pages 4034-4045.
- ^ Binding of Src to Na+/K+-ATPase Forms a Functional Signaling Complex (页面存档备份,存于互联网档案馆) by Jiang Tian, Ting Cai, Zhaokan Yuan, Haojie Wang, Lijun Liu, Michael Haas, Elena Maksimova,‡ Xin-Yun Huang and Zi-Jian Xie in Molecular Biology of the Cell (2005) volume 17, pages 317-326.
- ^ Interaction of the alpha subunit of Na,K-ATPase with cofilin (页面存档备份,存于互联网档案馆) by K. Lee, J. Jung, M. Kim and G. Guidotti in The Biochemical Journal (2001) volume 353, pages 377–385.
- ^ Regulation of Na+-K+-ATPase by cAMP-dependent protein kinase anchored on membrane via its anchoring protein (页面存档备份,存于互联网档案馆) Kinji Kurihara, Nobuo Nakanishi, and Takao Ueha. Departments of 1 Oral Physiology and 2 Biochemistry, School of Dentistry, Meikai University, Sakado, Saitama 350-0283, Japan
- ^ Skou J. The influence of some cations on an adenosine triphosphatase from peripheral nerves.. Biochim Biophys Acta. 1957, 23 (2): 394–401. PMID 13412736. doi:10.1016/0006-3002(57)90343-8.
- ^ Chemistry 1997. [2008-12-09]. (原始内容存档于2008-05-16).

